黄瓜TRM基因家族鉴定及分析
2021-07-29李豪虎亚静张清霞王丽娜任仲海
李豪,虎亚静,张清霞,王丽娜,任仲海
黄瓜基因家族鉴定及分析
李豪,虎亚静,张清霞,王丽娜*,任仲海*
山东农业大学园艺科学与工程学院, 山东 泰安 271018
黄瓜是我国极为重要的一种经济作物,而果实大小是黄瓜最重要的性状之一。是已被定位到的控制黄瓜果形的少数基因之一,但是目前研究者对黄瓜中TRM (TONNEAU1 Recruiting Motif)家族的认识还比较少。本研究通过生物信息学技术对黄瓜TRM家族基因进行分析,从氨基酸序列的相似性、不同物种TRM的进化关系、结构域、亚细胞定位等方面进行了比较。黄瓜TRM家族共有28个成员,主要分布在1、2、3、5四条染色体上,都有细胞核定位信号。通过等电点分析我们发现,黄瓜中TRM一半偏酸性,一半偏碱性。表达特异性分析表明,大部分TRM在果实中的表达量较高,这说明TRM可能对于果实的生长发育有重要作用。
黄瓜;基因; 生物信息学分析
黄瓜是我国广泛种植的一种蔬菜作物,果实是黄瓜最重要的商品器官。果实形状是影响黄瓜品质的重要因素之一。黄瓜的果形主要由果实长度、果实横径、果形指数等决定,这些因素影响着果实的外观品质和市场等级划分[1]。黄瓜的果实形状由多基因控制。2017年,Pan等在1号染色体上定位到第一个控制黄瓜果实形状的基因[2]。2018年,Wu等在二号染色体上定位到,一个黄瓜果实长度的正调控基因,它是番茄中控制番茄果实形状的基因的同源基因[3]。通过调控乙烯的生物合成来调控细胞分裂,从而调控黄瓜果实形状[4]。Zhao等于2019年鉴定到一个负调控黄瓜果实形状的基因CsFUL1,CsFUL1通过调控的表达来调控细胞分裂和膨大,从而影响果实的形状[5]。2020年Zhang等研究发现,通过影响细胞分裂素和多胺的生物合成和代谢来控制果实细胞的增殖,从而调控果实形状[6]。
TRM家族基因对于植物的生长发育起着重要的作用,其在多种植物中都行使重要功能。在拟南芥中有34个TRM,它们有6个保守基序,其中一个是TON1结合基序。AtTRM1能够与微管蛋白结合,并且可以通过与TON1的互作将其靶向于微管蛋白[7]。TRM5是TRM家族的一个重要成员,有研究表明,()对拟南芥的生长发育起着重要作用,突变体具有明显的发育缺陷表型:叶片生长变慢、花发育迟缓、根变短等[8]。而在番茄中SlTRM5可以与OVTE共同调控番茄果实的形状。另外Tang等的研究将拟南芥中突变掉后会导致胚胎致死和种子败育[9]。
在番茄中有26个,关于番茄中的研究还很少,是唯一一个被研究的家族成员。Wu等的研究表明,在番茄中SlTRM与OVTE在果实发育过程中通过调节细胞的分裂从而共同调控果实形状[3]。但是目前关于黄瓜家族的研究还未见报道。
本文鉴定了黄瓜家族成员,其在染色体上的分布,与番茄和拟南芥中TRM的亲缘关系,黄瓜的基因结构,以及其在不同组织的表达量。这为后面深入研究黄瓜TRM的功能提供了一些参考。
1 材料与方法
1.1 黄瓜TRM家族基因的鉴定
拟南芥基因下载于拟南芥基因组网站(https://www.Arabidopsis.org/),番茄基因的蛋白序列下载于番茄基因组网站(https://solgenomics.net),并以拟南芥和番茄TRM的蛋白序列作为查询序列,在黄瓜基因组网站(http://cucurbitgenomics.org/)上进行Blast,检索并输出最优的比对结果,确定黄瓜家族成员的候选基因,并根据其在染色体上的位置进行命名。
黄瓜家族基因成员蛋白质的相对分子量(Mw)、氨基酸数量(AA)和等电点(pI)使用ExPasy计算(https://web.ExPasy.org/compute_pI/)。使用在线软件预测黄瓜TRM亚细胞定位Plant-mPLoc (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)。
1.2 黄瓜、番茄、拟南芥TRM进化关系分析
本文使用软件MEGA7分析黄瓜、拟南芥和番茄三个物种中的系统发育关系。首先通过Clustal X对所有TRM的蛋白序列进行对比,随后通过邻接法(Neighbor-Joining,NJ)构建系统进化树,并用Bootstrap法(重复次数设定为1000)评估系统进化树。最后利用Evolview (https://www.omicsclass.com/article/671)在线网站对进化树进行可视化和修饰。
1.3 黄瓜TRM染色体定位分析
本文从黄瓜基因组网站(http://cucurbitgenomics.org/)获得黄瓜的物理位置,然后采用Map Inspect绘图工具绘制其基因连锁图谱。
1.4 黄瓜TRM基因及蛋白结构的鉴定
黄瓜家族基因的内含子和外显子信息从黄瓜基因组数据库分析得到,基因的结构通过GSDS (http://gsds.cbi.pku.edu.cn/)在线生成[10,11];使用MEME (https://www.omicsclass.com/article/432)在线网站,对黄瓜家族的保守motif基序进行分析,最后用TBtools[12]可视化。
1.5 黄瓜TRM基因组织表达特异性分析
基于已发表的RNA-seq数据(SRA046916)分析了在各个组织中的表达模式[13],包括根、茎、叶、雌花、雄花、子房、未受精子房、已受精子房和卷须等九个组织[14]。基于FPKM值,使用TBtools软件[12]来可视化基因的表达谱。
2 结果与分析
2.1 黄瓜TRM家族基因的鉴定
本研究以34个拟南芥基因以及26个番茄基因的蛋白序列作为查询序列,在黄瓜基因组网站进行Blast,输出比对结果,最终鉴定到了28个黄瓜成员,并对其进行命名(表1)。通过比较分析发现,它们的内外显子数目并不一致,最少的只有两个外显子(,,),最多的有7个外显子()。其基因长度也是相差甚大,最短的基因为1154bp(),最长的基因为5797bp(),其蛋白质大小差异也很明显,最小的为39351.26 kD(),而最大的为117734.58kD()。等电点方面,有15个成员偏酸性(,,,,,,,,,,,,,,),13个成员偏碱性(,,,,,,,,,,,,)。通过在线工具Plant-mPLoc预测黄瓜的亚细胞定位可知,所有的家族成员都有细胞核定位信号。
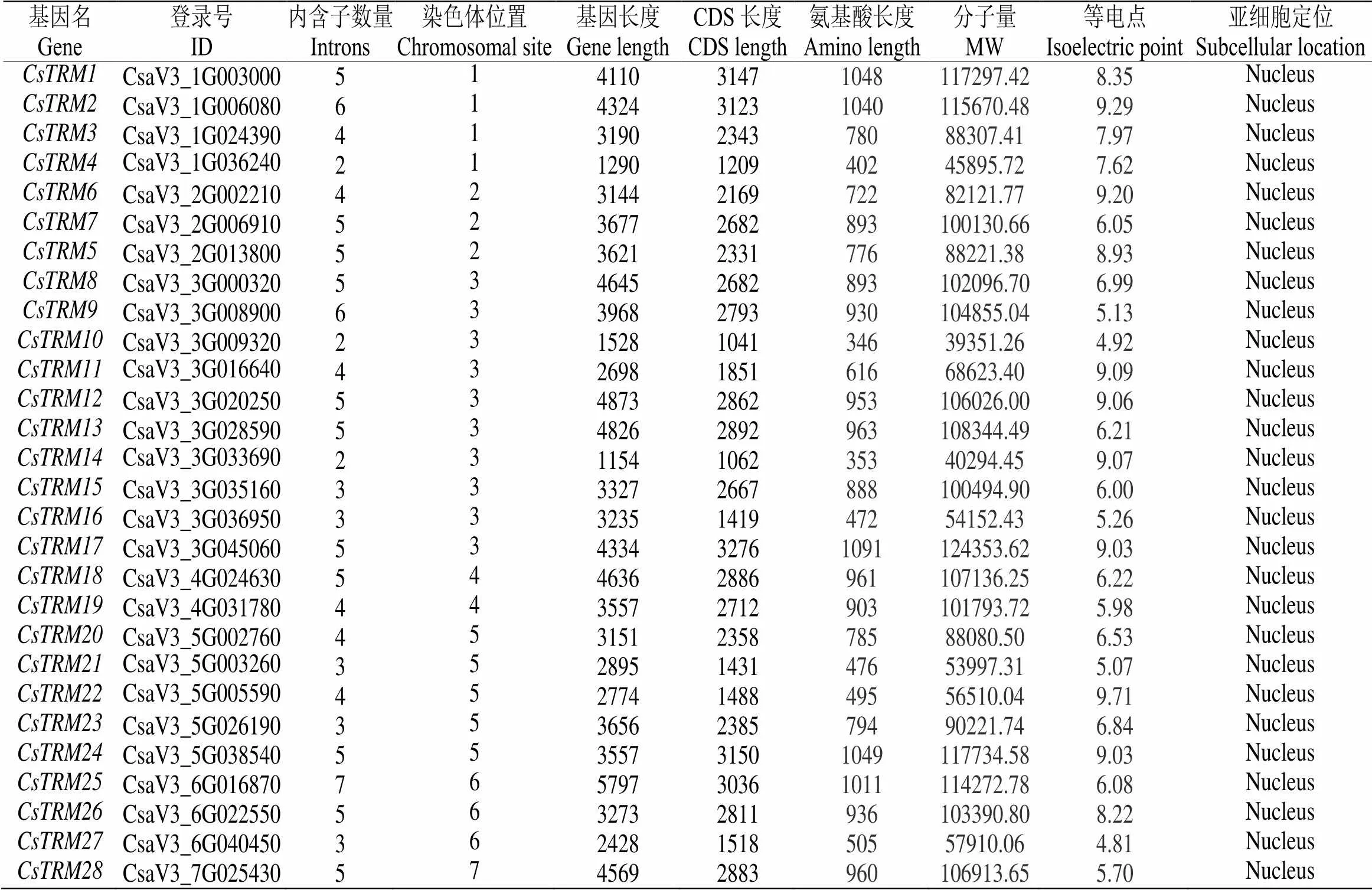
表 1 黄瓜TRM基因家族信息
2.2 黄瓜、番茄、拟南芥TRM进化关系分析
我们利用MEDGA7软件分析了34个拟南芥,26个番茄和28个黄瓜的亲缘关系(图1)。通过分析我们发现根据亲缘关系的远近我们可以将88个分为5个组。第一组包括9个拟南芥(,,,,,,,,),3个番茄(,,),4个黄瓜(,,,)。第二个组包括6个拟南芥(,,,,,),3个番茄(,,),6个黄瓜(,,,,,)。第三个组包括5个拟南芥(,,,,),3个番茄(,,),4个黄瓜(,,,)。第四个组包括7个拟南芥(,,,,,,),6个番茄(,,,,,,,,,),7个黄瓜(,,,,,,)。第五个组包括8个拟南芥(,,,,,,,),11个番茄(,,,,,,,,,,),9个黄瓜(,,,,,,,,)。
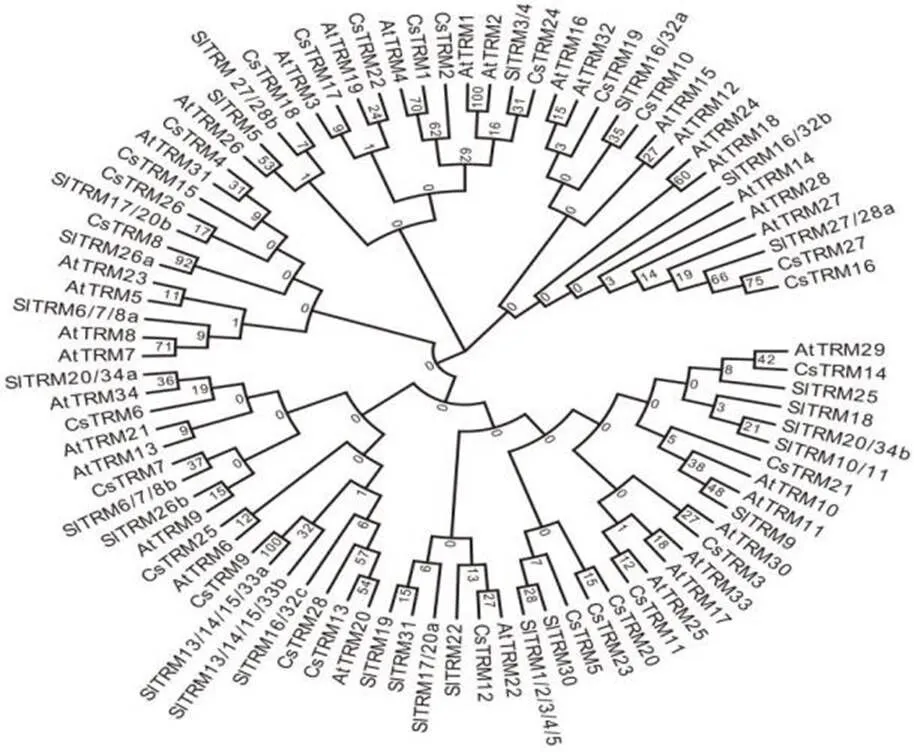
图1 拟南芥TRM、番茄TRM、黄瓜TRM进化关系分析
2.3 黄瓜TRM在染色体上的分布
本文使用Map Inspect分析了28个黄瓜在染色体上的位置(图2),28个基因中有10个位于3染色体上(,,,,,,,,,),5个位于5号染色体上(,,,,),4个位于1号染色体上(,,,),3个位于2号染色体上(,,),3个位于6号染色体上(,,),1个位于7号染色体上()。
图2 黄瓜染色体定位
Fig.2 Chromosome location
2.4 黄瓜TRM基因结构的分析
本研究通过在线工具GSDS分析了黄瓜的基因结构(图3),28个黄瓜中外显子数目在2到7个之间。28个基因中有两个外显子的基因有3个(,,),有3个外显子的基因有5个(,,,,),有4个外显子的基因有6个(,,,,,),有5个外显子的基因有11个(,,,,,,,,,,,),有6个外显子的基因有2个(,),有7个外显子的基因有1个()。另外我们还通过在线工具MEME分析了28个的保守motif基序,通过分析发现黄瓜中含有8个保守基序(M1,M2,M3,M4,M5,M6,M7,M8),其中M6基序的保守性最差,只有四个成员含有M6基序,而M2基序的保守性最强,所有的28个成员中都含有M2基序。另外8个基序中比较保守的基序还有M1、M3、M4、M5,分别有19、14、15、14个成员含有上述基序。目前关于这些据序功能的研究还比较少,Tang等发现在人类CPF350蛋白中存在中的M2基序,CPF350能够通过M2基序与FOP蛋白互作[9]。
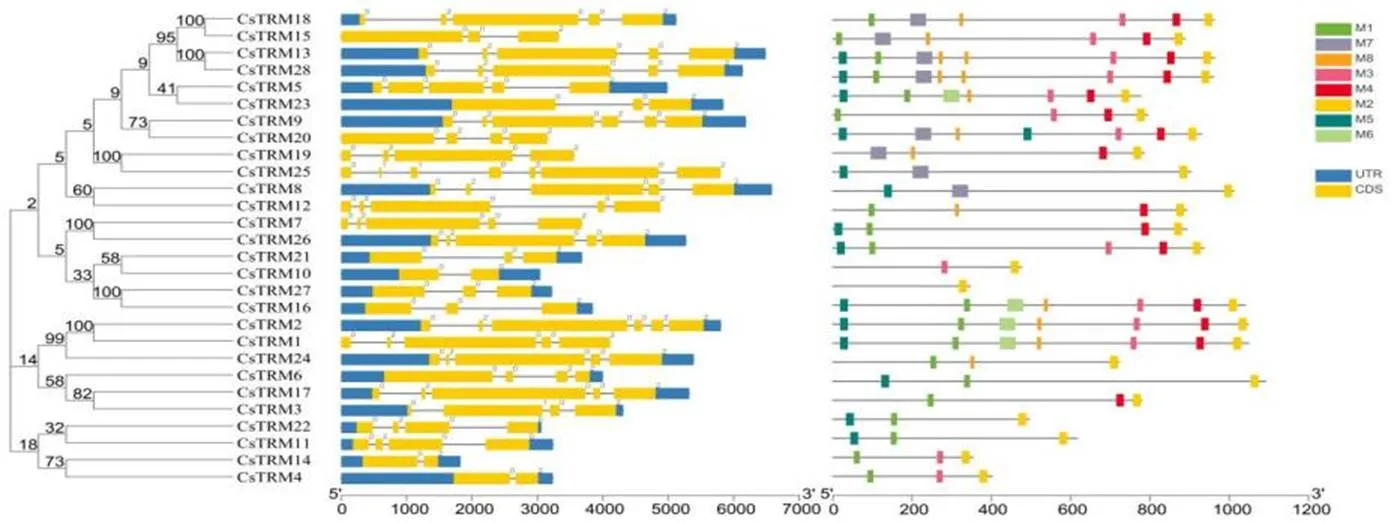
图3 黄瓜TRM基因结构分析
2.5 黄瓜TRM基因表达特异性的分析
本研究通过已发表的转录组数据(SRA046916)分析了黄瓜在根、茎、叶、雌花、雄花、子房、未受精子房、已受精子房和卷须等九个组织中的表达量情况,并通过TBtools软件做出了可视化的热图(图4)。通过分析我们发现,大部分在子房、未受精子房和已受精子房中表达量较高,少数基因在雌花和雄花中表达量较高,极少数基因在根,茎和卷须中表达量较高。因此黄瓜中的很有可能与黄瓜的生殖生长以及黄瓜果实的发育相关。
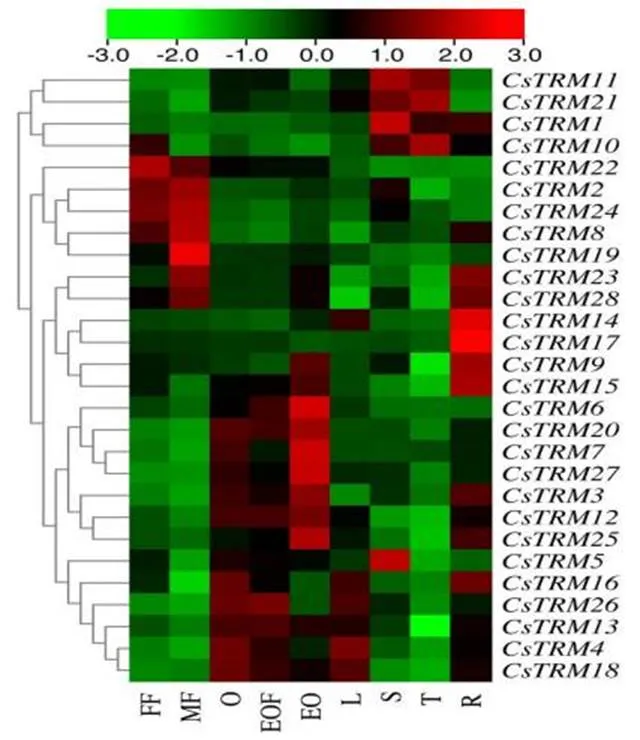
图4 黄瓜TRM基因在不同组织中的表达量分析
注:FF: 雌花; MF: 雄花; O: 子房; EOF: ex-o-fer, 受精子房; EO: ex-o-unfer, 未受精子房; L: 叶; S: 茎; T: 卷须R: 根。
Note: FF: Female flower; MF: Male flower; O: Ovary; EOF: ex-o-fer, Expanded ovary (fertilized); EO: ex-o-unfer, Expanded ovary (unfertilized); L: Leaf; S: Stem; T: tendril R: Root.
3 讨论
果实是黄瓜最重要的商品器官,果实的形状是影响黄瓜商品价值的重要因素之一。目前已经定位到数个控制黄瓜果实形状的基因,其中为其中之一。属于黄瓜家族的一个成员,但是目前还没有关于黄瓜家族系统全面的研究。本文首次鉴定到了黄瓜中的28个成员,并对其基因结构和蛋白质结构进行了分析,通过分析我们发现成员所包含外显子数目是相近的,就蛋白质结构方面,大部分成员所包含的motif基序也是相似的,某些重要的基序在中具有高度的保守性,比如M2基序。
近年来随着黄瓜基因组学的发展,让我们可以越来越方便的解析黄瓜中某些特定基因的功能[15]。本文基于已发表的RNA-seq数据(SRA046916)分析了在各个组织中的表达模式[13],经过我们的分析发现,黄瓜的28个家族成员中有23个基因在果实或雌花、雄花中高表达。这说明在黄瓜中很可能会影响黄瓜果实的发育,这与番茄中对的研究是一致的。在番茄中与互作,通过调控细胞的分裂来调节番茄果实的形状,是在番茄中的同源基因,而位于一个控制黄瓜果实形状的QTL中[3]。而根据Wang等的研究是一个调控黄瓜果实形状的主效QTL,它可以控制开花当天的果实长度、果实直径、果形指数,商品瓜时期的果实长度、果实直径、果形指数,以及成熟瓜时期的果实长度、果实直径、果形指数[16]。根据Pan等的研究结果我们知道,1、2、3号染色体上存在大量控制黄瓜果实形状的QTL,而黄瓜家族有68%的成员位于这三条染色体上,这也可能从侧面说明,可能有多个成员参与黄瓜果实发育的调控。
4 结论
家族是一个调控植物生长发育的重要家族,本文利用生物信息学技术对家族进行了分析。在黄瓜中存在28个,主要分布在1、2、3、5四条染色体上,通过表达特异性特异性分析发现,多数黄瓜在果实发育相关组织特异性表达。通过本研究我们发现参与调控黄瓜果实的发育。
[1] 乔军,刘富中,陈钰辉,等.园艺作物果形遗传研究进展[J].园艺学报,2011,38(7):1385-1396
[2] Pan Y, Liang X, Gao M,. Round fruit shape in WI7239 cucumber is controlled by two interacting quantitative trait loci with one putatively encoding a tomatohomolog [J]. Theoretical and Applied Genetics, 2017,130:1531-1548
[3] Wu S, Zhang BY, Keyhaninejad N,. A common genetic mechanism underlies morphological diversity in fruits and other plant organs [J]. Nature Communications, 2018,9(1):4734
[4] Xin T, Zhang Z, Li S,. Genetic regulation of ethylene dosage for cucumber fruit elongation [J]. The Plant Cell, 2019,31:1063-1076
[5] Zhao J, Jiang L, Che G,. A functional allele ofregulates fruit length through repressingand inhibiting auxin transport in cucumber [J]. The Plant Cell,2019,31(6):1289-1307
[6] Zhang Z, Wang B, Wang S,. Genome-wide Target mapping shows histone deacetylase complex 1 regulates cell proliferation in cucumber fruit [J]. Plant Physiology Preview, 2020,182(1):167-184
[7] Drevensek S, Goussot M, Duroc Y,. TheTRM1–TON1 Interaction Reveals a Recruitment Network Common to Plant Cortical Microtubule Arrays and Eukaryotic Centrosomes [J]. The Plant Cell, 2012,24:178-191
[8] Guo QQ, Ng PQ, Shi SS,.TRM5 encodes a nuclear-localised bifunctional tRNA guanine and inosine-N1- methyltransferase that is important for growth [J]. PLoS ONE, 2019,14(11):e0225064
[9] Tang J, Jia PF, Xin PY,. TheTRM61/TRM6 complex is atRNA N1-methyladenosine methyltransferase [J].Journal of Experimental Botany, 2020,100:3024-3036
[10] 葛倩,王祥飞,李豪,等.黄瓜IQD/SUN基因家族全基因组鉴定及分析[J].基因组学与应用生物学,2019,38(9):4110-4119
[11] Liu PJ, Wang SS, Wang XF,. Genome-wide characterization of two-component system (TCS) genes in melon (L.) [J]. Plant Physiology and Biochemistry, 2020,151:197-213
[12] Chen CJ, Xia R, Chen H,. TBtools, a Toolkit for Biologists integrating various HTS-data handling tools with a user-friendly interface [J].Molecular Plant. doi:10.1016/j.molp.2020.06.009
[13] Li Z, Zhang ZH, Yan PC,. RNA-Seq improves annotation of protein-coding genes in the cucumber genome [J]. Bmc Genomics, 2011,12:540
[14] 董晓静,韩妮,虎亚静,等.黄瓜VQ家族全基因组鉴定[J].分子植物育种,2020.https://kns.cnki.net/kcms/detail/46.1068.S.20200623.1455.008.htm
[15] Yang LM, Koo DH, Li YH,. Chromosome rearrangements during domestication of cucumber as revealed by high-density genetic mapping and draft genome assembly [J].The Plant Journal, 2012,71:895-906
[16] Wang XF, Li H, Gao ZH,. Localization of quantitative trait loci for cucumber fruit shape by a population of chromosome segment substitution lines [J]. Scientific Reports, 2020,10(1):11030
Identification and Analysis onFamily in Cucumber
LI Hao, HU Ya-jing, ZHANG Qing-xia, WANG Li-na*, REN Zhong-hai*
271018,
Cucumber is an extremely important economic crop in our country, fruit size is one of the most important traits of cucumber.is one of the few isolated genes which control cucumber fruit shape. However, little is known about the information of TRM (TONNEAU1 Recruiting Motif) family in cucumber. In this study, we used bioinformatics technology to study the cucumber TRM family genes. We compared and analyzed the similarity of amino acid sequence, evolutionary relationship of TRM among different species, functional domains and subcellular location. We found that there are 28 members in the cucumber TRM family, which are mainly distributed on the four chromosomes (1, 2, 3, and 5), and they all have the nucleus-localized signal. By isoelectric point analysis, we found that the half TRMs in cucumber are acidic and the other half are alkaline. Gene expression analysis in different tissues showed that most ofdisplay higher expression in fruit, which indicates thatmay play important roles in the process of fruit growth and development.
Cucumber;gene; bioinformatics analysis
S642.2
A
1000-2324(2021)03-0358-06
2021-03-22
2021-03-25
国家自然科学基金(31972419;31672170);山东“双一流”专项建设基金(SYL2017YSTD06);山东省泰山学者建设工程(ts20130932);山东省重点研发计划(2018GNC110014)
李豪(1993-),男,硕士研究生,研究方向:分子遗传育种. E-mail:18763829737@163.com
Author for correspondence. E-mail:zhren@sdau.edu.cn; lnwang@sdau.edu.cn
