铁皮石斛叶多糖的提取及其免疫活性测定
2021-07-29韩娟娟陈舜胜刘克海
韩娟娟,陈舜胜,刘克海
铁皮石斛叶多糖的提取及其免疫活性测定
韩娟娟,陈舜胜,刘克海*
上海海洋大学食品学院, 上海 201306
应用响应面法对铁皮石斛叶多糖的提取进行优化,并对多糖初步纯化。将铁皮石斛叶多糖作用于脂多糖(LPS)诱导的人体单核细胞(THP-1),测定对THP-1细胞活性及活性氧(ROS)形成的影响,以研究其免疫活性。结果表明:铁皮石斛叶多糖的最佳提取工艺为温度70.61 ℃、时间1.96 h、料液比20:1,此时多糖得率可达13.56%,与理论预测值基本吻合。利用透析袋除去多糖中小分子杂质,经凝胶柱Sephadex G-100初步纯化,获得一种纯化多糖,即命名为DLP。将DLP作用于THP-1,随着浓度增大(0.5~100 μg/mL),DLP能剂量依赖性地抵抗LPS诱导的细胞毒;5 μg/mL时,THP-1细胞活性基本完全接近对照组。此外,5 μg/mL铁皮石斛叶多糖可有效抑制LPS诱导的细胞内ROS产生。因此,采用响应面法提取并经凝胶柱纯化得到的铁皮石斛叶多糖具有良好免疫活性。
铁皮石斛; 多糖; 响应面; 流式细胞仪; 免疫活性
铁皮石斛(KimuraMigo)作为珍贵传统中药材,民间所谓的“枫斗”即为其茎卷曲后烘干制得,隶属于兰科石斛属,是多年生草本植物,主要分布于我国云南、贵州等地[1]。铁皮石斛味甘、性微寒,具有生津养胃、退热润肺、滋阴补益之功效[2],活性成分主要为多糖、石斛碱、氨基酸及多种挥发性成分[3],其中,多糖是其主要成分,具有抗氧化、抗炎和提高免疫等作用,是理想的药物和保健食品基料[4,5]。此外,铁皮石斛在东南亚还用作食物。
目前,国内外学者对铁皮石斛的研究主要集中在茎秆部分,而对其叶研究较少。有研究对铁皮石斛茎、叶多糖含量及结构进行比较,二者具有相同多糖成分,叶多糖含量约为茎的1/3[6],可见石斛茎和叶在功效上具有相似性。然而作为非药用部分的铁皮石斛叶尚未充分开发利用,近年来仅仅被用作茶饮,这是对珍贵石斛资源的浪费。因此,铁皮石斛叶的开发利用亟待解决,其多糖的有效提取是关键。目前石斛叶多糖的提取及优化方法报道较少,且大多采用正交试验设计,不能在整体范围内找到因素的最佳组合。本研究采用响应面法优化铁皮石斛叶多糖的提取[7],并进一步纯化,同时对其免疫活性进行评价[8]。
1 材料与方法
1.1 材料与试剂
铁皮石斛叶购买于浙江省温州市。THP-1细胞由中科院提供。
石油醚、苯酚和二甲基亚砜均为分析纯。96孔板及培养瓶均是无菌。
1.2 仪器与设备
旋转蒸发器(上海亚荣生化仪器厂);冷冻干燥机(LABCONCO);细胞培养箱(Thermo);酶标仪(CORONA);细胞房无菌操作台
1.3 试验方法
1.3.1 石斛叶多糖的提取(1)石斛叶多糖提取的工艺步骤[9]铁皮石斛叶干品→粉碎机粉碎→脱脂→温水浸提→真空抽滤→旋转蒸发→85%乙醇沉淀过夜→离心→冷冻干燥→铁皮石斛多糖。
(2)石斛叶多糖提取工艺优化研究表明,提取时间、温度、料液比和提取次数对铁皮石斛提取率会有显著影响[10],因此实验首先选择上述因素进行单因素实验分析,依据其结果,进而选择提取温度、提取时间和料液比三因素及三水平,以石斛叶多糖得率为指标,采用响应面法优化石斛叶多糖提取工艺,实验设计详见表1[11]。根据响应面分析结果,进行加标回收率试验。

表1 铁皮石斛叶多糖提取响应面分析的因素水平
1.3.2 石斛叶多糖的纯化透析袋剪成约10 cm的小段,煮沸处理后,一端用橡皮筋扎紧,将透析袋灌满水,即可加入多糖样品,放置过夜除去小分子杂质[12]。称取15 g左右的Sephadex G-100溶胀漂洗后湿法装柱,之后用0.1 mol/L NaCl溶液平衡24 h,平衡完毕后用0.1 mol/L NaCl溶液溶解干燥好的样品,制成50 mg/mL的石斛叶多糖浓度由上端进样,以0.3 mL/min的速度进行洗脱,15 min每管,苯酚-硫酸法隔管跟踪检测收集,直至无多糖检出为止,绘制洗脱曲线,合并各洗脱组分,蒸发浓缩,透析除去NaCl,冷冻干燥得到多糖[13]。
1.3.3 铁皮石斛叶多糖的含量测定(1)标准曲线的制备 准确称取干燥的D-葡萄糖标准品50 mg,蒸馏水定容至100 mL作为标准溶液,分别吸取标准D-葡萄糖溶液0.8、1.2、1.6、2.0、2.4、4、4.8 mL,移入带刻度的试管中,定容至4 mL,同时做空白对照。然后,分别加入1 mL 5%重蒸苯酚溶液,混合均匀后,快速加入95%硫酸溶液5 mL,室温放置20 min,在490 nm波长下进行比色。绘制标准曲线[14],得到线性回归方程为=1.3428+0.0005,相关系数2=0.9916,结果见图1。

图1 葡萄糖标准曲线
(2)铁皮石斛叶多糖的含量与提取率 采用改良的苯酚-硫酸法[15],在490 nm处测定铁皮石斛叶多糖含量。
多糖提取率/%=多糖干品质量/石斛叶质量×100%。
1.3.4 石斛叶多糖的免疫活性(1)细胞培养 人体单核细胞THP-1(中国农业科学院提供)培养于含10%胎牛血清(FBS)的RPMI-1640中,37 ℃、5% CO2培养箱中孵育。细胞长至80%~90%时传代,选择对数生长期状态进行实验。
(2)细胞活性测定(MTT法)通过MTT实验测定细胞活性[16]。即,调整THP-1细胞浓度为每毫升1×105个,接种于96孔板,孵化过夜后,添加1 μg/mL的LPS或DLP(终浓度10、30、50和100 μg/mL)处理细胞,设置阳性对照组。培养24 h后清洗细胞,并添加含有5 μg/mL MTT的无血清RPMI-1640。弃去培养基,二甲基亚砜溶解蓝色沉淀,于550 nm测定光密度。
(3)细胞内活性氧水平检测[17]培养细胞浓度为每毫升1×105个,转移至24孔板,然后每孔分别添加1 μg/mL LPS和5 μg/mL DLP,37 ℃培养过夜后,磷酸缓冲盐溶液清洗两次,装载H2DCFDA探针,孵化30 min后收集细胞于EP管。利用流式细胞仪测定各管中细胞样品的荧光值,反映胞内ROS的产生量。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对铁皮石斛叶多糖得率的影响选择80 ℃提取2次,每次1 h,考察料液比对多糖提取率的影响,分别设定为20:1、30:1、40:1、50:1、60:1,结果如图2。
由图2可知,对于铁皮石斛,随着料液比的增大,在20~30 mL/g时,多糖提取率显著升高,在40 mL/g时,有明显降低,之后随着料液比的增大,提取率有回升,但没有超过30 mL/g时的提取率。综合经济成本因素,初步选取20~30 mL/g作为提取时的料液比。
2.1.2 提取时间对石斛叶多糖提取率的影响选定30 mL/g的物料比,在80 ℃提取2次,考察时间对石斛叶多糖提取率的影响,分别设定为1、1.5、2、2.5、3、3.5 h,结果如图3。
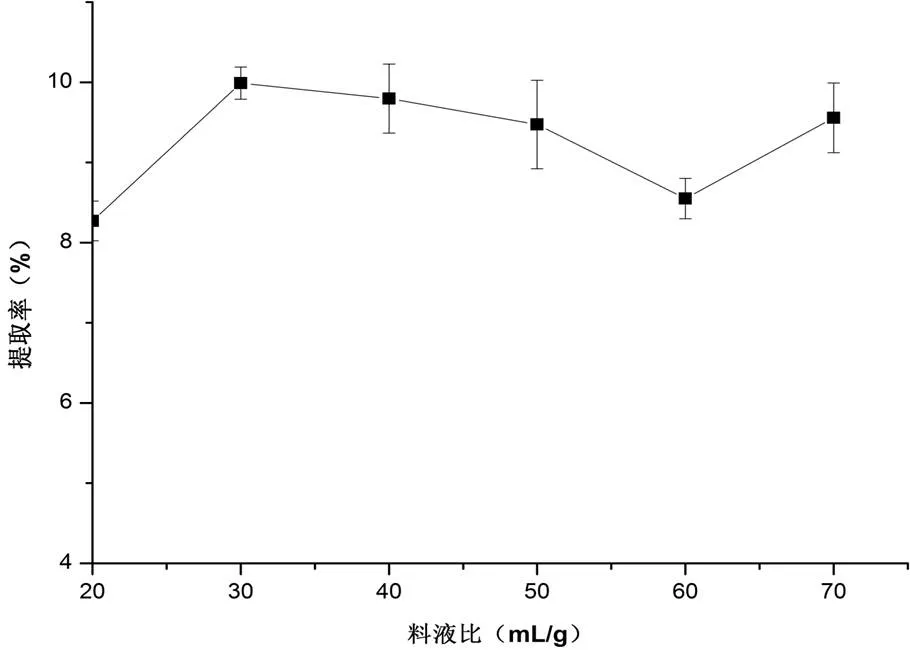
图2 料液比对多糖提取率的影响
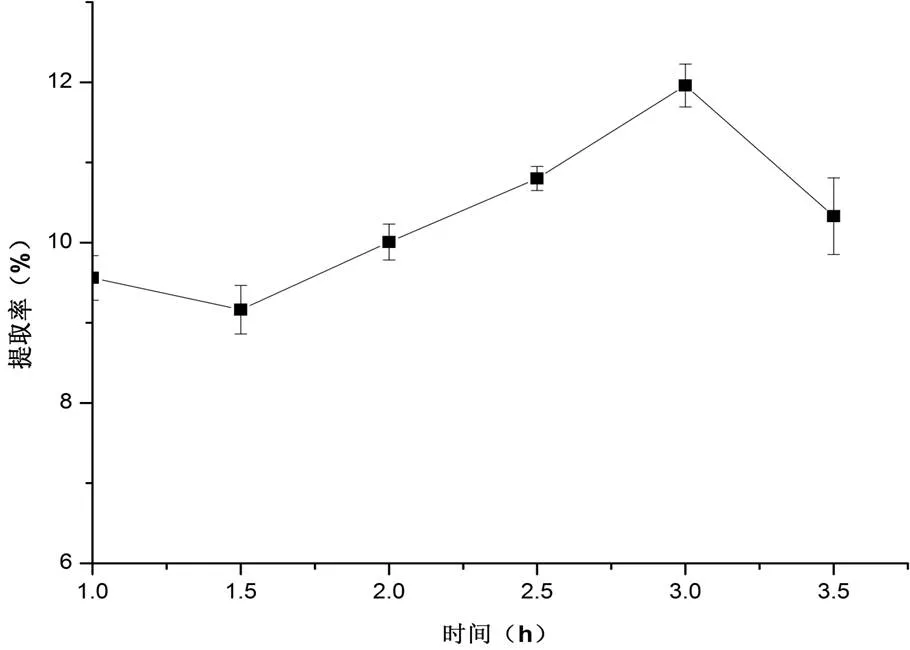
图3 时间对石斛叶多糖提取率的影响
由图3可看出,当提取次数固定时,在1.5~3 h内,当延长提取时间,多糖的提取率的增大是极显著的,而在1 h和3.5 h处均较低,考虑时间和机器运转成本,因此,初步选择1.5~2.5 h做为提取时间的设定。
2.1.3 提取次数对石斛叶多糖得率的影响选定30 mL/g的物料比,80 ℃提取2 h,考察提取次数对石斛叶多糖提取率的影响,分别为1、2、3、4、5次,结果如图4。
由图4可知,不断增加提取次数,多糖得率呈现逐渐增大的趋势,且达到2次时,多糖的提取速率增加最大,超过两小时,提取率增加变缓,故选定提取2次。
2.1.4 温度对石斛叶多糖提取率的影响选定30 mL/g的物料比,每次提取2 h,共2次,考察温度对石斛叶多糖提取率的影响,分别设定为40、50、60、70、80、90 ℃,结果如图5。

图4 提取次数对石斛叶多糖提取率的影响

图5 温度对石斛叶多糖得率的影响
由图5可知,40 ℃时多糖提取率最低,当温度不断升高,多糖提取率相应增加,达到80 ℃时,多糖得率有回落,因此,选取70 ℃左右来提取多糖。
2.2 铁皮石斛叶多糖提取工艺优化
2.2.1 响应面(BBD法)分析采用响应面分析,制定提取方案,并经由Design Expert8.0.6处理数据,如表2所示。

表2 RSM试验的因素与水平组合和响应值

表3 石斛叶多糖提取回归模型方差分析
注: *表示差异显著 (<0.05);**表示差异极显著(<0.01)
Note: *< 0.05; **< 0.01
对表2的数据建立多元回归拟合,得到石斛叶多糖提取的拟合方程为:
=12.76+0.63-0.18-0.93+1.24-0.07+0.40-1.762-0.652-0.12
对模型进行方差分析(表3),可以看出:模型=0.0054<0.05,,表明模型显著;失拟=0.4264,表明失拟不显著,因此所选用的提取回归模型是合适的;对多糖提前回归方程的系数进行显著性检验,得出模型一次项A(0.05)差异显著,表明温度对铁皮石斛叶多糖得率作用显著,而模型一次项C(<0.01)差异极显著,表明料液比对多糖得率的影响极显著,同时提取时间对多糖得率的影响不显著。因此,对石斛叶多糖得率影响大小顺序为料液比>提取温度>时间。
2.2.2 铁皮石斛叶多糖的响应面分析利用软件Design-Expert 8.0.6处理得到3D图和等高线图,可直观地反映出各两因素交互作用对多糖得率的影响。对表2中的数据进行二次多元回归拟合,所得到的二次回归方程的响应面如图6所示。

图6 各两因素相互作用对石斛叶多糖提取率的影响
从图6可知,各试验因素交互作用影响不显著。试验因素中料液比对铁皮石斛叶多糖提取率影响极显著,同时,提取温度对铁皮石斛叶多糖提取率有显著影响,对回归模型求解方程,得到最优提取操作为提取温度70.61 °C,提取时间1.96 h,料液比30:1,此时多糖理论得率为13.7195%。考虑到实验的可操作性与各因素对得率的影响大小,且过量的提取液将增加浓缩环节工作量,工艺参数拟定为70.61 ℃,时间1.96 h,料液比20:1,测定吸光值,多糖平均得率为13.56%。与理论预测值基本吻合。因此,利用响应面优化得到的铁皮石斛叶多糖提取工艺实用可靠。
2.2.3 加标回收率实验称取干燥的铁皮石斛叶10 g,设置4个处理组,依次加入一定量的葡萄糖对照品,按照最佳提取条件,制备铁皮石斛叶溶液,测定吸光值,并根据标准曲线计算出多糖得率及加标回收率。结果平均回收率为98.33%,RSD为0.79%。
2.3 铁皮石斛叶多糖纯化
如图7所示,铁皮石斛叶多糖经透析袋除去小分子杂质,Sephadex G-100凝胶柱洗脱后可以分得2个峰,分别简称为DLP-Ⅰ和DLP-Ⅱ,其中DLP-Ⅰ的含量较少不予收集,仅收集组分2,命名为DLP。

图7 铁皮石斛叶多糖在Sephadex G-100柱的洗脱曲线
2.4 铁皮石斛叶多糖免疫活性
2.4.1 铁皮石斛叶多糖对THP-1细胞活性的影响结果显示(图9),在0.5~100 μg/mL范围内,随着样品浓度增大,DLP对LPS诱导细胞毒的保护作用呈现剂量依赖性。当浓度为5 μg/mL时,细胞活性基本完全接近对照组,之后随着石斛叶多糖浓度的增大,增大作用趋近平行。因此,选取5 μg/mL的多糖浓度作为进一步的免疫活性实验。
2.4.2 DLP对 THP-1 细胞内ROS 产生的影响用荧光探针标记THP-1后,测定活细胞内荧光强度以反映ROS的产生量。图10显示,1 μg/mL的LPS处理组细胞内ROS荧光强度显著提高。与阳性对照组相比,5 μg/mL的DLP处理组细胞内ROS形成显著降低。因此,5 μg/mL铁皮石斛叶多糖可有效抑制LPS诱导的细胞内ROS产生。

图9 铁皮石斛叶多糖对细胞活性的影响

图10 铁皮石斛叶多糖对活性氧形成的影响
3 讨 论
试验过程中发现,虽然料液比对得率有极显著影响,最佳范围在20~30,继续加大料液比对提取率的提升不明显,可能是由于这样会加大药材在介质间的间隙,反而削弱了提取器对药材组织的搅拌、破碎作用,在保证达到提取温度的前提下,适当减小料液比也能获得较好的提取效果。提取温度对提取率具有显著的影响,但过高的提取温度可能会对多糖的良好活性具有一定的损害,因此,保证适宜的提取温度,适当减小料液比可有利于后续的浓缩操作。
通过上述工艺提取所得铁皮石斛叶多糖经过脱蛋白、透析除去小分子杂志,再经过葡聚糖凝胶柱Sephadex G-100,根据分子量大小的不同,在凝胶柱上受到阻滞作用不同,可将不同分子量阶段的多糖组分分离开来,主要成分显示一个尖锐、细长的对称峰,此时获得的纯多糖再进行细胞免疫活性分析,相对于粗多糖更具科学性。
铁皮石斛叶多糖的体外免疫活性实验结果表明,在0.5~100 μg/mL范围内,随着多糖浓度增大,DLP对LPS诱导的细胞毒的保护作用呈现剂量依赖性。当浓度为5 μg/mL时,细胞活性基本完全接近对照组,因此铁皮石斛叶多糖可抵抗脂多糖(LPS)引起的细胞毒。此外,铁皮石斛叶多糖可有效抑制LPS诱导的细胞内ROS产生。体外免疫活性实验表明铁皮石斛叶多糖具有较好的免疫活性,为今后铁皮石斛叶多糖相关产品的开发利用提供了一定的参考和依据。
[1] 郭丽宏. 铁皮石斛资源、化学成分及药理作用研究进展[J]. 亚太传统医药, 2014, 10(021):45-46.
[2] 胡贤春,郭永兵,向劲松.铁皮石斛多糖的研究进展[J].安徽农业科学,2015,43(15):78-80
[3] 陈晓梅,王春兰,杨峻山,等.铁皮石斛化学成分及其分析的研究进展[J].中国药学杂志,2013,48(19):1634-1639
[4] Huang KW, Li YR, Tao SC,. Purification, Characterization and Biological Activity of Polysaccharides from[J]. Molecules, 2016,21(6):701
[5] Luo QL, Tang ZH, Zhang XF,. Chemical properties and antioxidant activity of a water-soluble polysaccharide from[J]. International Journal of Biological Macromolecules, 2016,89:219-227
[6] 周桂芬,庞敏霞,陈素红,等.铁皮石斛茎、叶多糖含量及多糖部位柱前衍生化-高效液相色谱指纹图谱比较研究[J]. 中国中药杂志,2014,39(5):795-802
[7] 缪园欣,廖明星,孙爱红,等.铁皮石斛花多糖提取工艺及体外抗氧化性研究[J].食品研究与开发,2019,40(2):60-64
[8] Smiderle FR, Ruthes AC, Arkel JV,. Polysaccharides from Agaricus bisporus, and Agaricus brasiliensis, show similarities in their structures and their immunomodulatory effects on human monocytic THP-1 cells[J]. Bmc Complementary & Alternative Medicine, 2010,11(8):1-11
[9] 朱璇.铁皮石斛多糖提取工艺的研究[J].黑龙江科技信息,2016(19):107
[10] 蔡兴,王美娜,梁权辉,等.响应面法优化铁皮石斛叶闪式提取工艺[J].亚太传统医药,2016,12(7):48-52
[11] 吕佳妮,陈素红,徐娟华.铁皮石斛根中石斛多糖的响应面法提取优化研究[J].浙江中医杂志,2014,49(6):459-461
[12] 陶盛昌.铁皮石斛水溶性多糖分离纯化,结构特征及免疫活性研究[D].广州:广州中医药大学,2016
[13] 宾宇波,王亚芸,安欣,等.铁皮石斛多糖分离纯化及单糖组成测定[J].食品工业科技,2014,35(4):122-125
[14] 何慕雪,孟凡成,王春明,等.1种水溶性霸王花多糖的分离纯化及结构鉴定[J].食品科学,2017(18):113-119
[15] 范传颍,陶正明,吴志刚.苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J].浙江农业科学,2013(7):799-801
[16] Wu SJ, Liaw CC, Pan SZ,. Phellinus linteus, polysaccharides and their immunomodulatory properties in human monocytic cells [J]. Journal of Functional Foods, 2013,5(2):679-688
[17] Jin M, Zhao K, Huang Q,. Structural features and biological activities of the polysaccharides from[J]. International Journal of Biological Macromolecules, 2014,64(2):257-266
Extraction of Polysaccharide from the Leaves ofand Its Immunomodulatory Property
HAN Juan-juan, CHEN Shun-sheng, LIU Ke-hai*
201306,
Response surface methodology was utilized to optimize the extraction process of polysaccharide from, and the polysaccharide was preliminarily purified. The immunomodulatory property wasevaluated by investigating effects of the polysaccharide on the cell viability and reactive oxygen species (ROS) formation in lipopolysaccharide (LPS) induced- human monocytic cells (THP-1). The optimum condition for the extraction of polysaccharide was found to be at 70.61 ℃ for 1.96 h with a material/solvent ratio of 1:20 (g/mL). Under this condition, the measured values of polysaccharide yield was 13.56%, which was in agreement with the predicted value. The polysaccharide was purified by dialysis bag and Sephadex G-100, and the purified polysaccharide was named DLP. With DLP concentration increasing (0.5~100 μg/mL), DLP could protect against LPS-induced cell toxicity in dosage, as well as inhibit reactive oxygen species (ROS) formation of THP-1. At 5 μg/mL, the activity of THP-1 cells was almost completely close to the control group. These findings suggest that DLP extracted using Response surface method and purified by Sephadex G-100 had good immunomodulatory property.
; polysaccharides; response surface methodology; flow cytometry; immunomodulatory property
S567.239
A
1000-2324(2021)03-0436-07
2016-12-14
2016-12-23
上海市教育委员会重点学科建设项目(J50704)
韩娟娟(1990-),女,硕士,研究方向:功能性食品. E-mail:jjhan1409@163.com
Author for correspondence. E-mail:khliu@shou.edu.cn
