基于网络药理学、分子对接及分子动力学探讨 秦艽-桑枝治疗类风湿关节炎的机制
2021-07-28肖剑伟蔡旭郭粉莲黄新民尹志华汪荣盛
肖剑伟 蔡旭 郭粉莲 黄新民 尹志华 汪荣盛

〔摘要〕 目的 通過网络药理学及分子对接、分子动力学探讨秦艽-桑枝治疗类风湿关节炎(RA)的活性成分、作用靶点及作用机制。方法 通过中药系统药理学技术平台(TCMSP)检索秦艽、桑枝的成分及作用靶点基因;将药对的作用靶点与GeneCards数据库检索所得的疾病靶基因取交集;根据交集结果进行GO功能富集和KEGG通路分析;通过Cytoscape得出核心基因;并选择PTGS2、CASP3、RELA等靶基因与秦艽、桑枝的活性成分山奈酚、β-谷甾醇、龙胆苦苷运用AutoDock Vina进行分子对接;通过Gromacs软件进行分子动力学模拟。结果 共筛选出秦艽-桑枝与RA共同靶基因90个。GO功能富集分析主要集中于对肿瘤坏死因子的反应、细胞调亡的调节、类固醇激素受体活性、肿瘤坏死因子受体超家族结合等。KEGG分析显示主要富集于TNF信号通路、调亡通路、IL-17信号通路、破骨细胞分化、类风湿关节炎等信号通路。分子对接及分子动力学结果显示药对的活性成分山奈酚、β-谷甾醇、龙胆苦苷能够与PTGS2、CASP3、RELA等靶基因紧密对接,形成稳定作用。结论 秦艽、桑枝的有效成分山奈酚、β-谷甾醇、龙胆苦苷可能通过作用于PTGS2、CASP3等靶基因,影响炎症因子释放及RA滑膜成纤维细胞的凋亡而发挥治疗RA的作用。
〔关键词〕 类风湿关节炎;分子对接;秦艽;桑枝;分子动力学;信号通路
〔中图分类号〕R255.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.06.008
Mechanisms for the Treatment of Rheumatoid Arthritis with Qinjiao (Gentianae Macrophyllae Radix)-Sangzhi (Mori Ramulus) Based on Network Pharmacology, Molecular Docking
and Molecular Dynamics
XIAO Jianwei1, CAI Xu1, GUO Fenlian1, HUANG Xinmin1, YIN Zhihua1, WANG Rongsheng2*
(1. Shenzhen Futian Hospital for Rheumatic Diseases, Shenzhen, Guangdong 518000, China;
2. Shanghai Guanghua Hospital of Integrated Traditional and Western Medicin, Shanghai 200052, China)
〔Abstract〕 Objective To investigate the ingredients, target and mechanism of rheumatoid arthritis (RA) treated with Qinjiao (Gentianae Macrophyllae Radix)-Sangzhi (Mori Ramulus) by network pharmacology, molecular docking and molecular dynamics. Methods The ingredients and target genes of Qinjiao (Gentianae Macrophyllae Radix) and Sangzhi (Mori Ramulus) were searched through the Chinese medicine system pharmacology technology platform (TCMSP) and PharmMapper website, the intersection of the target of the drug pair and the disease target gene retrieved from the GeneCards database was taken, then gene ontology (GO) enrichment and KEGG pathway analysis based on the intersection results were performed. The Hub gene was obtained through Cytoscape. PTGS2, CASP3 and RELA with the active ingredients of Qinjiao (Gentianae Macrophyllae Radix)-Sangzhi (Mori Ramulus) including kaempferol, β-sitosterol and gentiopicroside were selected for molecular docking by AutoDock Vina. Molecular dynamics simulation was carried out by Gromacs software. Results A total of 90 crossed target genes of Qinjiao (Gentianae Macrophyllae Radix)-Sangzhi (Mori Ramulus) and RA were identified. GO functional enrichment analysis mainly focused on the response to tumor necrosis factor, regulation of cell death, steroid hormone receptor activity, tumor necrosis factor receptor superfamily binding, etc. KEGG analysis showed that it was mainly enriched in TNF signaling pathway, apoptosis, IL-17 signaling pathway, osteoclast differentiation, rheumatoid arthritis, etc. The results of molecular docking and molecular dynamics showed that the active ingredients kaempferol, β-sitosterol and gentiopicroside of the drug pair can be closely docked with PTGS2, CASP3 and RELA, and to form a stable effect. Conclusion The effective ingredients kaempferol, β-sitosterol and gentiopicroside of Qinjiao (Gentianae Macrophyllae Radix)-Sangzhi (Mori Ramulus) may play a therapeutic role to affect the release of inflammatory factors and apoptosis of RA synovial fibroblasts by acting on the target genes such as PTGS2 and CASP3.
〔Keywords〕 rheumatoid arthritis; molecular docking; AutoDock Vina; Qinjiao-Sangzhi; R software; molecular dynamics
类风湿关节炎(rheumatoid arthritis, RA)是一种以慢性炎症和骨损伤为特征的自身炎症性疾病,其患病率约为0.5%~1%,其中,女性的发病率是男性的2~3倍[1]。其反复的滑膜炎症,最终导致关节软骨和骨损伤,从而出现功能限制、工作障碍和生活质量低下。
从中医学角度分析,RA患者大多属于中医学“尪痹”范畴,通过对李其忠教授主编的《丁甘仁学术经验集》病案分析[2],在丁甘仁21例痹症类医案中,使用频率较高的单个药物为秦艽、桑枝、当归,药对为秦艽-桑枝、桑枝-当归、桑枝-丹参,其中,使用频率最高的药对为秦艽-桑枝。在实际应用中,时常与羌活、桂枝等合用以祛风除湿,如蠲痹汤。国医大师刘祖贻治疗RA亦时常选用秦艽、桑枝[3]。临床研究[4-5]显示,以秦艽、桑枝为主要成分的蠲痹汤、祛风除痹胶囊等药方对RA均有明显的疗效。提示该药对在治疗RA中可能具有重要的作用。
分子对接技术是预测小分子配体与受体相互作用机制的模拟化手段,网络药理学是融合生物信息学和系统药理学为一体的学科[6],因为网络药理学及分子对接提供了对网络理论和系统生物学的更完整的理解,被认为是药物发现的下一个范例[7]。分子动力学是一门综合了物理、数学和化学技术的分子模拟方法[8]。本课题组利用网络药理学、分子对接、分子动力学等多种生物信息分析方法,通过筛选秦艽-桑枝成分类药性、预测作用靶点等,从药对中筛选出与RA靶基因有相互作用的有效成分,对筛选后的有效成分与靶基因进行分子对接及水溶液中动力学模拟,预测药物小分子有效成分与靶基因的结合位点,为探索秦艽-桑枝对RA的作用机制提供理论依据。
1 资料与方法
1.1 药对有效成分筛选及作用靶点预测
采用中药系统药理学技术平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)[9]检索桑枝、秦艽的化学成分,以口服生物利用度(oral bioavailability, OB)≥30%和类药性(drug likeness, DL)≥0.18作为活性化合物的筛选条件筛选出有效小分子成分。而在TCMSP未查询到作用靶点的小分子成分,通过PharmMapper网站(www.lilab-ecust.cn/pharmmapper/)查询得到其排名前40的预测作用靶点[10]。将TCMSP、PharmMapper搜索得到活性成分对应的相关靶点蛋白名,通过Uniprot数据库(https://www.uniprot.org/)查找物种为人类的对应官方基因名,删除重复项的潜在作用靶点,通过Cytoscape 3.7.1软件绘制药物-化合物-靶基因网络图。
1.2 RA靶点搜集
以“Rheumatoid Arthritis”为关键词检索GeneCards数据库(http://www.genecards.org/)与RA相关的疾病靶点。
1.3 治疗靶点获取及韦恩图绘制
通过FunRich 3.1.3软件对“1.1”及“1.2”步骤获得的靶基因取交集,并绘制韦恩图,得到秦艽-桑枝治疗RA的潜在作用靶点。
1.4 靶点生物学功能、通路及蛋白相互作用网络分析
使用R软件的org.Hs.eg.db、clusterProfiler等R包,以P<0.05为筛选條件,对差异基因行GO功能富集分析及KEGG信号通路分析。采用STRING在线数据库[11]进行蛋白相互作用网络分析,并通过Cytoscape 3.71软件的CytoHub插件筛选核心基因(Hub基因)。使用KEGG 数据库将凋亡相关蛋白映射到KEGG凋亡的通路(hsa04210)中。
1.5 分子对接
从RCSB PDB数据库(https://www.rcsb.org/)中获取基因靶点的晶体结构,使用PyMOL 2.4.1软件除去晶体水,导入AutoDock Tools 1.5.6软件并予加氢、加电荷处理,结果输出为pdbqt格式。药物小分子从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取并导入ChemBio3D Ultra 14.0软件,其能量最小化,导入AutoDock Tools 1.5.6 软件保存为pdbqt 格式。对接使用AutoDock Vina 1.1.2程序进行,使用半柔性对接方法,根据评分函数计算出的结合亲和能,筛选出10个打分最高的构象模型,并选取结合能最小的配体作为最佳配体。将复合物导入Discovery Studio 2016软件,计算两者结合的氢键的距离及Pi键数量。
1.6 分子动力学模拟
使用Gromacs 2019.5软件进行动力学模拟。首先使用ATB网站(http://atb.uq.edu.au/)[12],将活性小分子转换为分子结构文件(Gro格式),Gromacs内置命令将蛋白转换为分子结构文件及生成拓扑文件。使用Gromos54a7_atb力场及SPC模型水分子,蛋白中的原子距离水盒子边缘最小距离为10 ?。根据对接结果使用钠离子或氯离子中和系统电荷。模拟温度为300 K,模拟前采用最速下降法对体系进行50 000步的分子力学优化。接着对优化后的体系分别进行步长为2 fs,总时间长为100 ps的NVT和NPT系综平衡,在平衡过程中对体系位置进行限制,最后在300 K的温度下进行20 ns的分子动力学模拟,模拟时间间隔为2 fs。所产生的结果去除周期性边界后使用GROMACS内置工具对生成的轨迹提取20 ns时最终结构,与模拟前复合物初始结构对齐后,对比其蛋白与小分子间的作用力;评估蛋白与小分子复合物的均方根偏差(root mean square deviation, RMSD),蛋白回旋半径、溶剂可及表面(solvent accessible surface area, SASA)。使用MM-PBSA计算受体与配体的结合自由能。通过Pymol 2.4.1、VMD 1.9.3和Origin 2019软件进行可视化。
2 结果
2.1 秦艽-桑枝活性成分及作用靶基因
TCMSP筛选后得到OB≥30%和DL≥0.18的桑枝、秦艽的有效成分较少。根据文献检索结果显示,桑枝的成分桑辛素、桑黄酮以及秦艽的成分齐墩果酸、苦味素、葡糖苷、龙胆苦苷、龙胆素、栎樱酸、香树精虽然OB小于30%,但是其具有活性作用,故纳入本研究[13-19]。结果显示桑枝有效活性成分5个,秦艽8个。共同得到桑枝、秦艽有效小分子化合物的作用靶点133个。通过Cytoscape软件将药物、化合物和靶基因相连,绘制出药物-化合物-靶基因相互作用网络图。分析该互作网络拓扑结构,此网络包含了148个节点和222条边。见表1、图1。
2.2 共同靶基因及韦恩图
通过GeneCards数据库检索到RA相关靶点3 437个,与桑枝-秦艽潜在作用靶基因取交集,得到共同靶基因90个。见图2。
2.3 GO及KEGG分析结果
对“2.2”步骤得到的差异基因行GO富集分析,显示其生物过程(biological process, BP)主要富集于对白细胞介素6生产的正调控、细胞调亡的调节、细胞内受体信号通路、免疫系统过程等;分子功能(molecular function, MF)富集于類固醇激素受体活性、药物结合、TNF受体超家族结合、蛋白质丝氨酸/苏氨酸激酶活性等;细胞成分(cellular component, CC)显示主要定位于质膜、内质网等。KEGG分析显示主要富集于TNF信号通路、P53信号通路、自噬通路、IL-17信号通路、破骨细胞分化、RA等信号通路。主要调控的靶点有AKT1、JUN、RELA及凋亡相关蛋白CASP3等。见图3。
2.4 蛋白互作网络及Hub基因
将STRING网站分析得到的90个靶点的蛋白互作关系数据导入Cytoscape软件,绘制PPI网络图。此网络共有83个节点、650条边。通过Cytoscape的CytoHub插件筛选得到该网络中度值排名前10 的靶蛋白(AKT1、JUN、MAPK8、CASP3、MAPK1、PTGS2、MAPK14、RELA、EGFR、ESR1)。见图4。
2.5 分子对接结果
根据“2.1”结果,筛选得到两味中药的有效小分子化合物山奈酚、β-谷甾醇、龙胆苦苷共同作用的靶点CASP3;β-谷甾醇作用靶点PTGS2、JUN;山奈酚作用靶点PTGS2、RELA、AKT1和JUN;龙胆苦苷作用靶点MAPK1。将小分子及靶蛋白分别通过AutoDock Vina程序对分子对接的结果进行打分。结果显示山奈酚、β-谷甾醇、龙胆苦苷通过氢键、疏水键与靶点结合,具有较强的结合能力,可能通过抑制其活性中心而改变其生物活性,从而达到治疗RA的目的。见表2、图5。
2.6 分子动力学模拟结果
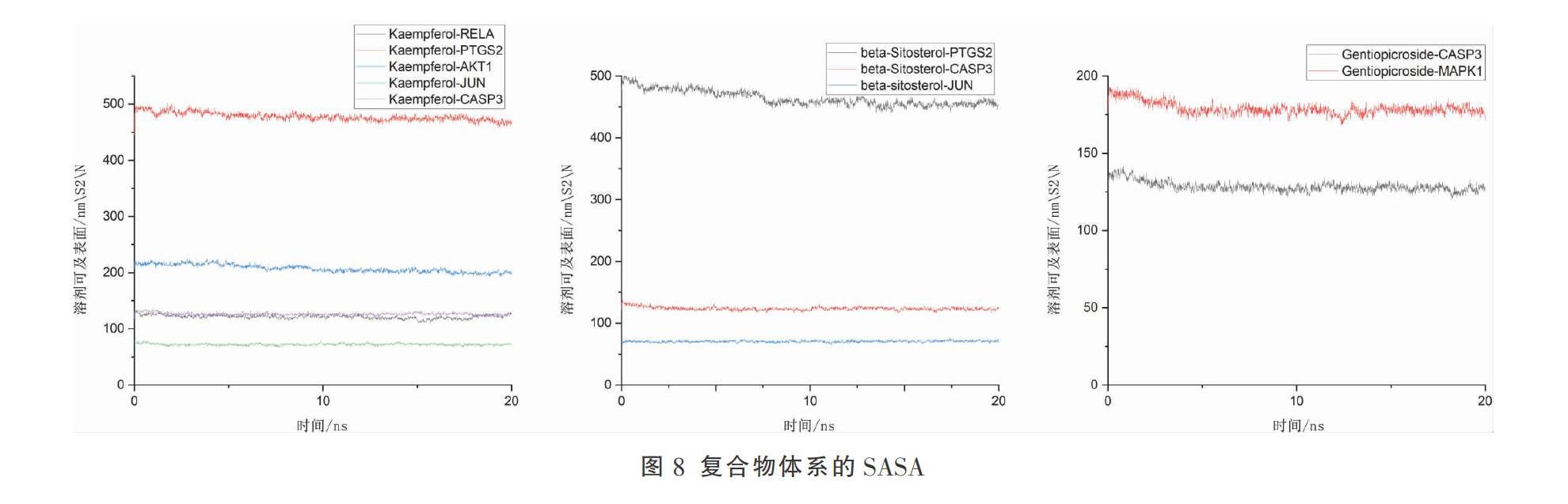
所有复合体在整个运行过程中均稳定。10个复合物体系的RMSD在10~15 ns左右时均达到平衡状态。所有体系的RMSD波动值均小于0.2 nm。计算复合物体系的蛋白回旋半径,结果均显示其半径随着模拟的进行逐渐缩小,提示蛋白与小分子结合后结构稳定。SASA结果显示,复合物体系SASA逐渐缩小,提示整个体系在模拟过程中逐渐趋于稳定。见图6-8。
与模拟前对比,通过20 ns的动力学模拟,β-谷甾醇、山奈酚、龙胆苦苷依然能通过氢键、疏水键及Pi键与靶蛋白在活性口袋紧密结合。其中,β-谷甾醇与PTGS2、CASP3,龙胆苦苷与CASP3结合后,与模拟前对比,其在蛋白质结构内部移动幅度较大,这种相互作用可能会导致蛋白质的孔隙发生变化,从而抑制蛋白质的功能。并且其SASA变化较山奈酚复合物体系明显,基于蛋白质结构的较大变化,β-谷甾醇、龙胆苦苷可能对PTGS2、CASP3有更强的作用。
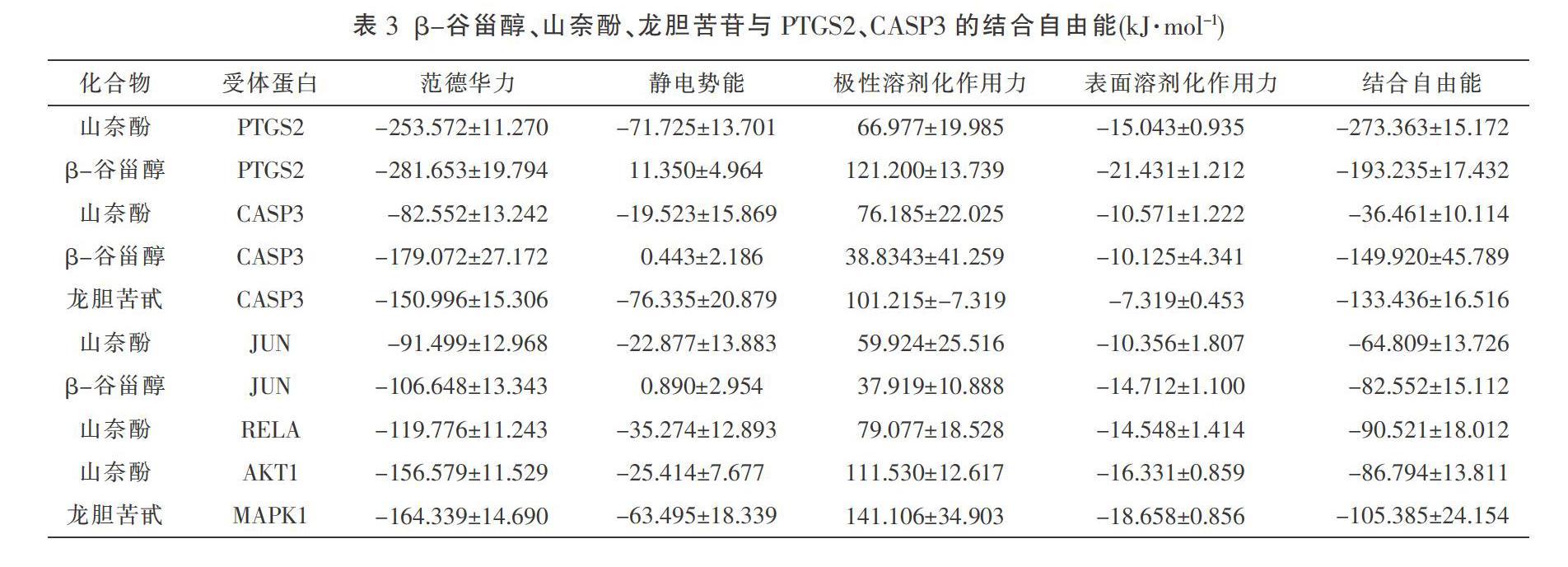
山奈酚与PTGS2,龙胆苦苷与CASP3、MAPK1的结合主要通过范德华力和静电势能,而极性溶剂化作用则对结合起抑制作用。山奈酚与CASP3、RELA、AKT1、JUN,β-谷甾醇与PTGS2、JUN及CASP3的结合主要通过范德华力,而极性溶剂化作用则对结合起抑制作用。见表3。
3 讨论
RA作为常见的风湿免疫疾病,长期困扰患者的生活,如治疗不充分,RA会导致关节损伤和不可逆转的残疾。本研究以网络药理学、分子对接、分子动力学为基础,构建了“秦艽-桑枝”药对的药物-成分-靶标网络,并对多个靶点与山奈酚、β-谷甾醇、龙胆苦苷进行了分子对接和动力学模拟,为该药治疗RA的多成分、多靶点的作用机制提供了参考。
从中医学角度分析,RA患者正气不足,风寒湿邪气乘虚入里,痹阻关节筋脉是其主要的病机。桑枝具有祛风湿、行水、利关节之功效;而秦艽具有祛风湿、通经络、清虚热、利尿退黄等功效。两者俱为祛风湿药,联合使用具有通络止痛、缓解症状的作用。现代药理研究[20]显示,桑枝的有效成分山奈酚能够抑制RA滑膜成纤维样细胞(fibroblast-like synoviocytes, FLS)的增殖,诱导细胞凋亡,并减轻炎症。Pan等[21]研究显示山奈酚可通过阻断MAPK通路的激活而不影响肿瘤坏死因子(TNF-α)受体的表达来抑制RA中FLS的迁移和侵袭,同时还可以显著抑制TNF-α诱导的MAPK活化,减轻胶原诱导小鼠的关节炎严重程度。研究[22]显示,桑辛素和桑黄酮对PTGS2活性有抑制作用。β-谷甾醇可明显降低佐剂型关节炎大鼠血清和组织中的TNF-α、C-反应蛋白、IL-2的含量[23],还能显著抑制M1巨噬细胞极化并增强M2巨噬细胞极化,从而减轻佐剂型关节炎小鼠的症状[24]。齐墩果酸能够通过下调丝氨酸/苏氨酸激酶,丝裂原激活的蛋白激酶和核因子-κB(NF-κB)来降低RA中FLS炎性介质的表达和产生[25]。龙胆苦苷能够通过抑制FLS中的ROS-NF-κB-NLRP3轴来抑制炎症因子白介素6(interleukin 6, IL-6)的产生,从而缓解RA的症状[21]。以上研究结果与本研究GO富集分析及KEGG分析结果是相吻合的。
分子对接及分子动力学结果显示,山奈酚、β-谷甾醇、龙胆苦苷均能够紧密对接各个靶点,且很快达到稳态。其中,范德华力在多个复合物体系的结合中起着重要作用。PTGS2又称为COX-2,在受到各种刺激时表达上调,参与多种病理过程,与炎症、肿瘤的发生、发展均存在密切关系。PTGS2能诱导产生前列腺素E2(prostaglandin E2, PGE2),从而在RA中导致炎症和疼痛。FLS释放PGE2是由促炎性细胞因子触发的[26]。PGE2还能诱导PI3K信号通路的激活,协同诱导组胺和IL-6释放。组胺刺激血管通透性,IL-6促进中性粒细胞募集,从而加重炎症,通过抑制PTGS2就能减少PGE2的释放从而控制炎症反应。研究[27]显示,RA关节的损害与滑膜细胞过度增生及凋亡不足是密切相关的。FLS的异常激活,导致了各种炎症因子的释放、血管翳的形成,继而出现骨质破坏,进一步加重了RA患者的临床症状。CASP3为半胱氨酸蛋白酶家族成员,通过裂解多种关键的细胞蛋白在凋亡途径中发挥关键作用。正常情况下,CASP3在细胞胞质中以无活性的酶原形式存在,通过级联反应使CASP3被活化,将凋亡的级联反应进行下去导致细胞发生凋亡[28]。例如周文旭等[29]发现,甲氨蝶呤可诱导RA滑膜细胞CASP3活化,促进滑膜细胞的凋亡,从而抑制關节滑膜细胞的增殖,减轻滑膜增厚而发挥治疗作用。RELA又称为NF-κB p65,在RA患者中,NF-κB活性均高于对照组,且和凋亡相关蛋白呈正相关,提示其在凋亡通路里面扮演了重要的角色[30]。AKT1是P13K/AKT 通路的重要组成部分,活化的AKT通过上调细胞周期蛋白,以多种途径调节凋亡[31]。研究[32]证明,JUN可以通过上调抗凋亡蛋白B细胞淋巴瘤/白血病-3,进而阻止T细胞凋亡。MAPK1又称为ERK2,可被炎症因子等激活,对细胞的生长、增殖等发挥重要作用[33]。RA滑膜中ERK的异常活化可促进滑膜细胞炎症反应,并参与滑膜细胞过度增殖及凋亡抑制,同时可增加基质降解酶的产生,在关节破坏方面发挥重要作用[34]。以上结果提示,山奈酚、β-谷甾醇、龙胆苦苷可能通过调控多个与炎症、凋亡密切相关的信号通路,促进RA滑膜成纤维细胞的凋亡,减少炎症因子的释放,是RA的潜在治疗靶点。
综上所述,本研究通过网络药理学、分子对接及分子动力学方法研究秦艽-桑枝有效活性成分山奈酚、β-谷甾醇、龙胆苦苷治疗RA的机制,为进一步从秦艽-桑枝中提取有效活性成分治疗RA提供了理论依据。然而,本研究仅是基于分子对接机制的预测,课题组后期将开展相关的验证,通过实验验证其作用机制。
参考文献
[1] AMMARI M, PRESUMEY J, PONSOLLES C, et al. Delivery of miR-146a to Ly6 Chigh monocytes inhibits pathogenic bone erosion in inflammatory arthritis[J]. Theranostics, 2018, 8(21): 5972-5985.
[2] 李其忠.海派中医内科丁甘仁流派系列丛书:丁甘仁学术经验集[M].北京:人民卫生出版社,2017.
[3] 马 珂,周胜强,邱四君,等.基于数据挖掘的国医大师刘祖贻治疗类风湿关节炎用药规律研究[J].湖南中医药大学学报,2019,39(1): 11-15.
[4] 庞学丰,蒙宇华.祛风除痹胶囊治疗类风湿关节炎86例[J].陕西中医,2002,23(12):1073-1075.
[5] 赵伟刚.蠲痹汤联合甲氨蝶呤和双氯芬酸钠治疗类风湿关节炎36例[J].风湿病与关节炎,2013,2(6):15-16,30.
[6] 邓芳芳.药物分子的计算机辅助理论模拟及分子设计[D].兰州: 兰州大学,2014.
[7] AL MAHMUD R, NAJNIN R A, POLASH A H. A survey of web-based chemogenomic data resources[J]. Methods in Molecular Biology, 2018, 1825: 3-62.
[8] KARPLUS M, ANDREW MCCAMMON J. Molecular dynamics simulations of biomolecules[J]. Nature Structural Biology, 2002, 9(9): 646-652.
[9] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13.
[10] WANG X, SHEN Y H, WANG S W, et al. PharmMapper 2017 update: A web server for potential drug target identification with a comprehensive target pharmacophore database[J]. Nucleic Acids Research, 2017, 45(W1): W356-W360.
[11] SNEL B, LEHMANN G, BORK P, et al. STRING: a web-server to retrieve and display the repeatedly occurring neighbourhood of a gene[J]. Nucleic Acids Research, 2000, 28(18): 3442-3444.
[12] MALDE A K, ZUO L, BREEZE M, et al. An automated force field topology builder (ATB) and repository: Version 1.0[J]. Journal of Chemical Theory and Computation, 2011, 7(12): 4026-4037.
[13] JIA Y W, HE W, ZHANG H X, et al. Morusin ameliorates IL-1β-induced chondrocyte inflammation and osteoarthritis via NF-κB signal pathway[J]. Drug Design, Development and Therapy, 2020, 14: 1227-1240.
[14] CHEON B S, KIM Y H, SON K S, et al. Effects of prenylated flavonoids and biflavonoids on lipopolysaccharide-induced nitric oxide production from the mouse macrophage cell line RAW 264.7[J]. Planta Medica, 2000, 66(7): 596-600.
[15] DING Y J, ZHAO Q, WANG L F. Pro-apoptotic and anti-inflammatory effects of araloside A on human rheumatoid arthritis fibroblast-like synoviocytes[J]. Chemico-Biological Interactions, 2019, 306: 131-137.
[16] SARAVANAN S, ISLAM V I, THIRUGNANASAMBANTHAM K, et al. Swertiamarin ameliorates inflammation and osteoclastogenesis intermediates in IL-1β induced rat fibroblast-like synoviocytes[J]. Inflammation Research, 2014, 63(6): 451-462.
[17] WANG M L, LI H Y, WANG Y F, et al. Anti-rheumatic properties of gentiopicroside are associated with suppression of ROS-NF-κB-NLRP3 axis in fibroblast-like synoviocytes and NF-κB pathway in adjuvant-induced arthritis[J]. Frontiers in Pharmacology, 2020, 11: 515.
[18] CHEN Y F, JI N, PAN S L, et al. Roburic acid suppresses NO and IL-6 production via targeting NF-κB and MAPK pathway in RAW264.7 cells[J]. Inflammation, 2017, 40(6): 1959-1966.
[19] SEO D G, KIM S, LEE D K, et al. Inhibitory effect of α-amyrin acetate isolated from Fraxinus rhynchophylla on Th17 polarization[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2019, 63: 153056.
[20] WANG J, ZHAO Q. Kaempferitrin inhibits proliferation, induces apoptosis, and ameliorates inflammation in human rheumatoid arthritis fibroblast-like synoviocytes[J]. Phytotherapy Research, 2019, 33(6): 1726-1735.
[21] PAN D M, LI N, LIU Y Y, et al. Kaempferol inhibits the migration and invasion of rheumatoid arthritis fibroblast-like synoviocytes by blocking activation of the MAPK pathway[J]. International Immunopharmacology, 2018, 55: 174-182.
[22] CHI Y S, JONG H G, SON K H, et al. Effects of naturally occurring prenylated flavonoids on enzymes metabolizing arachidonic acid: Cyclooxygenases and lipoxygenases[J]. Biochemical Pharmacology, 2001, 62(9): 1185-1191.
[23] KRIPA K G, CHAMUNDEESWARI D, THANKA J, et al. Modulation of inflammatory markers by the ethanolic extract of Leucas aspera in adjuvant arthritis[J]. Journal of Ethnopharmacology, 2011, 134(3): 1024-1027.
[24] LIU R, HAO D L, XU W Y, et al. Β-Sitosterol modulates macrop?
hage polarization and attenuates rheumatoid inflammation in mice[J]. Pharmaceutical Biology, 2019, 57(1): 161-168.
[25] CHOI J K, KIM S W, KIM D S, et al. Oleanolic acid acetate inhibits rheumatoid arthritis by modulating T cell immune responses and matrix-degrading enzymes[J]. Toxicology and Applied Pharmacology, 2016, 290: 1-9.
[26] LEE Y S, LEE S Y, PARK S Y, et al. Cilostazol add-on therapy for celecoxib synergistically inhibits proinflammatory cytokines by activating IL-10 and SOCS3 in the synovial fibroblasts of patients with rheumatoid arthritis[J]. Inflammopharmacology, 2019, 27(6): 1205-1216.
[27] SECA S, KIRCH S, CABRITA A S, et al. Evaluation of the effect of acupuncture on hand pain, functional deficits and health-related quality of life in patients with rheumatoid arthritis: A study protocol for a multicenter, double-blind, randomized clinical trial[J]. Journal of Integrative Medicine, 2016, 14(3): 219-227.
[28] HOLLOMON M G, PATTERSON L, SANTIAGO-O' FARRILL J, et al. Knock down of fas-associated protein with death domain (FADD) sensitizes osteosarcoma to TNFα-induced cell death[J]. Journal of Cancer, 2020, 11(7): 1657-1667.
[29] 周文旭,谭湘淑,佘 君,等.类风湿关节炎大鼠滑膜细胞凋亡基因调控的实验研究[J].医学信息,2020,33(5):71-73.
[30] WRIGHT H L, CHIKURA B, BUCKNALL R C, et al. Changes in expression of membrane TNF, NF-{kappa}B activation and neutrophil apoptosis during active and resolved inflammation[J]. Annals of the Rheumatic Diseases, 2011, 70(3): 537-543.
[31] 江建锋,白 强,宋祯彦,等.从凋亡网络的调控研究地黄饮子治疗阿尔兹海默病的分子机制[J].中草药,2020,51(21):5548-5558.
[32] REBOLLO A, DUMOUTIER L, RENAULD J C, et al. Bcl-3 expression promotes cell survival following interleukin-4 deprivation and is controlled by AP1 and AP1-like transcription factors[J]. Molecular and Cellular Biology, 2000, 20(10): 3407-3416.
[33] MELOCHE S, POUYSSéGUR J. The ERK1/2 mitogen-activated protein kinase pathway as a master regulator of the G1-to S-phase transition[J]. Oncogene, 2007, 26(22): 3227-3239.
[34] HASHIRAMOTO A, SAKAI, YOSHIDA K, et al. Angiopoietin 1 directly induces destruction of the rheumatoid joint by cooperative, but independent, signaling via ERK/MAPK and phosphatidylinositol 3-kinase/Akt[J]. Arthritis and Rheumatism, 2007, 56(7): 2170-2179.
