Omega-3多不饱和脂肪酸对痤疮模型金黄地鼠 皮脂腺增生及PI3K/AKT通路的影响
2021-07-28吴欣桐朱明芳吴淑辉张曦张娟娟
吴欣桐 朱明芳 吴淑辉 张曦 张娟娟
〔摘要〕 目的 研究Omega-3多不饱和脂肪酸对痤疮动物模型金黄地鼠皮脂腺斑的影响及相关机制。方法 24只金黄地鼠随机分为4组,每组6只:空白组、低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组,连续灌胃4周,观察金黄地鼠皮脂腺斑大小、组织病理结构、磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase, PI3K)以及蛋白激酶B(protein kinase B, AKT)蛋白表达水平。结果 干预后,与空白组相比,低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组皮脂腺斑面积均减小,差异具有统计学意义(P<0.05);低剂量鱼油组、高剂量鱼油组和异维A酸阳性对照组皮脂腺斑组织大小减小、重叠腺叶数减少、排列较空白组疏松;低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组AKT及PI3K表达水平均比空白组低,差异具有统计学意义(P<0.05)。结论 Omega-3多不饱和脂肪酸通过PI3K/AKT通路改善皮脂腺增生、调节皮脂分泌。
〔关键词〕 痤疮;金黄地鼠;皮脂腺;Omega-3;PI3K;AKT
〔中图分类号〕R275 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.06.006
Effects of Omega-3 Polyunsaturated Fatty Acids on Sebaceous Gland Hyperplasia and PI3K/Akt Pathway in Acne-induced Golden Hamster
WU Xintong, ZHU Mingfang*, WU Shuhui, ZHANG Xi, ZHANG Juanjuan
(The Second Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China)
〔Abstract〕 Objective To study the effect of Omega-3 polyunsaturated fatty acids on the sebaceous spots in golden hamster with acne and its related mechanism. Methods 24 golden hamsters were randomly divided into 4 groups, with 6 in each group: blank group, low-dose fish oil group, high-dose fish oil group, isotretinoin positive control group. The expression levels of PI3K and Akt, pathological structure and sebaceous plaque size of golden hamsters were observed by continuous intragastry for 4 weeks. Results After intervention, compared with blank group, the area of sebaceous glands in low-dose fish oil group, high-dose fish oil group and isotretinoin positive control group were smaller, the difference was statistically significant (P<0.05); the size of sebaceous plaque tissue in low-dose fish oil group, high-dose fish oil group and isotretinoin positive control group decreased and the number of overlapping gland lobes decreased, and the arrangement was looser than that in blank group. The expression levels of AKT and PI3K in low-dose fish oil group, high-dose fish oil group and isotretinoin positive control group were lower than those in blank group, and the differences were statistically significant (P<0.05). Conclusion Omega-3 polyunsaturated fatty acids can improve sebaceous gland hyperplasia and regulate sebum secretion through PI3K/AKT pathway.
〔Keywords〕 acne; golden hamsters; sebaceous glands; Omega-3; PI3K; AKT
隨着环境、社会压力等的变化,痤疮的发病率逐年升高,在青少年中的发病率高达到80%以上[1]。痤疮的发病机制复杂,目前认为痤疮的发生、发展主要与雄激素作用下皮脂大量分泌、皮脂成分改变、毛囊皮脂腺导管角化异常、痤疮丙酸杆菌定植、炎症反应与免疫等因素有关[2]。研究[3-4]表明,胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)可导致细胞内激酶活化,包括磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase, PI3K),进而结合下游蛋白激酶B(protein kinase B, AKT),促进皮脂腺细胞增殖分化,皮脂分泌增多,从而诱发加重痤疮。因此,PI3K/AKT信号通路是痤疮皮脂代谢发生的关键环节。随着对痤疮研究的不断深入,饮食与痤疮的关系逐渐受到重视。饮食和痤疮之间的关系一直备受争议,但近年来越来越多的研究[5-6]表明饮食对寻常痤疮发病的潜在影响,使得皮肤科医生开始重新思考饮食和痤疮之间的潜在联系。研究[7-8]表明,高血糖负荷饮食和乳制品的摄入会加剧痤疮,而富含Omega-3多不饱和脂肪酸的鱼类和健康油脂、膳食纤维、锌的作用有利于改善痤疮皮损,降低痤疮发生率,这些饮食因素在体内都能够通过干预皮脂脂质代谢而影响痤疮的发生发展。
Omega-3多不饱和脂肪酸在各个学科领域受到了广泛的关注,在改善动脉粥样硬化、脂肪肝、高脂血症、胰岛素抵抗等方面发挥着作用[9]。Omega-3多不饱和脂肪酸是一类人体不能自身合成的必需多不饱和脂肪酸(polyunsaturated fatty acid, PUFA),Omega-3多不饱和脂肪酸包括α-亚麻酸(α-linolenic
acid, ALA)、二十碳五烯酸(ei-cosapentaenoic acid,
EPA)、二十二碳六烯酸(docosahexaenoic acid, DHA);ALA为植物性的脂肪酸,主要来源于亚麻籽油、核桃仁油、菜籽油、大豆油等植物种子;DHA和EPA主要来自于深海鱼油、虾类、藻类等海洋生物,其中深海鱼油是Omega-3脂肪酸最主要的来源[10]。有关Omega-3多不饱和脂肪酸用于痤疮治疗的探讨最早源于一项针对1 000多名来自美国北卡罗来纳州的青少年的流行病学调查,显示在食用大量富含Omega-3多不饱和脂肪酸的鱼和海鲜的人群中,痤疮的发生率显著降低。在一项针对韩国人的随机双盲前瞻性实验中显示每天服用2颗鱼油(每颗鱼油含有500 mg EPA和500 mg DHA),10周后,痤疮患者炎性和非炎性痤疮病灶均明显减少,痤疮严重程度等级基线降低[11]。用超快速液相色谱和串联质谱结合的方法对痤疮患者的血清进行脂肪酸水平测定,结果显示痤疮患者血清EPA水平明显降低,这首次报道了痤疮患者血清EPA水平的改变,并支持使用Omega-3多不饱和脂肪酸作为痤疮患者的辅助治疗[12]。然Omega-3脂肪酸抗痤疮机制尚未完全明晰,基于此,本实验以皮脂腺分泌旺盛的金黄地鼠皮脂腺斑为痤疮模型,观察Omega-3多不饱和脂肪酸对金黄地鼠皮脂腺斑的影响,进一步研究Omega-3多不饱和脂肪酸调节痤疮皮脂代谢紊乱的机制,旨在为痤疮的治疗带来新的突破。
1 材料与方法
1.1 实验动物
健康雄性金黄地鼠24只,体质量110~130 g,分笼圈养于中南大学湘雅医学院动物中心实验室(SPF级)。动物许可证号:SCXK(京)2016-0011。全价营养颗粒饲料饲养,自由饮水,12 h光照及12 h黑夜,饲养温度(22±2) ℃,湿度59%~65%。
1.2 主要药品、试剂及设备
Omega-3多不饱和脂肪酸鱼油(批号:27602 B3587507G,规格:每颗含Omega-3 1 200 mg,美国NATURES BOUNTY公司);异维A酸(国药准字:H10930210,上海信谊延安药业有限公司);AKT抗体(批号:10176-2-AP)、PI3K抗体(批号:20584-1-AP)均购于美国Proteintech公司。游标卡尺(上海量具刀具厂);轮转石蜡切片机(上海徕卡贸易有限公司,型号:RM2235);正置荧光显微镜(中国麦克奥迪实业有限公司,型号:Motic BA410)。
1.3 动物造模与分组给药
选取金黄地鼠作为痤疮模型[13],适应性喂养1周后,将24只金黄地鼠随机分为以下4组:空白组、低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组,每组6只。根据人与动物体表面积折算法[14],低剂量鱼油组金黄地鼠用240 mg/kg剂量鱼油灌胃,高剂量鱼油组金黄地鼠用1 200 mg/kg剂量鱼油灌胃;异维A酸组金黄地鼠用5 mg/kg剂量异维A酸灌胃。每日1次,连续灌胃4周。空白组不施加任何干预。
1.4 检测指标
1.4.1 测量皮脂腺斑面积 在干预的第0、28天用剃毛器将金黄地鼠双侧背部的毛剃除,使皮肤表面的皮脂腺斑清晰地露出。在自然光下,用游标卡尺精确测量皮脂腺斑块的最大横径(transverse diameter, DT)和最大纵径(longitudinal diameter, DL),以DT×DL计算金黄地鼠皮脂腺斑的面积。
1.4.2 HE染色法观察皮脂腺斑组织病理结构 干预28 d后处死金黄地鼠,将皮脂腺組织切下,用甲醛固定,乙醇脱水,石蜡切片包埋,苏木-伊红常规染色,显微镜下观察皮脂腺大小、厚度及松散程度。
1.4.3 免疫组化法检测皮脂腺斑PI3K、AKT蛋白表达 将石蜡切片脱蜡水化,灭活内源性过氧化物酶,进行抗原热修复,加入5% BSA封闭液封闭非特异性抗原。用血清稀释液按适量比例稀释特异性一抗,PBS缓冲液冲洗3次;加入二抗山羊抗兔IgG抗体,37 ℃孵育30 min,PBS缓冲液冲洗3次;加入二氨基联苯胺(DAB)显色液,苏木素复染,待细胞着色而背底颜色较淡时马上吸去显色液,用蒸馏水迅速冲3次后加入PBS终止反应;脱水之后,封片,拍照。镜下观察,每张片子随机选取5个高倍视野(×200),细胞核呈棕黄染色为阳性细胞,计算每一视野中阳性细胞的平均光密度值。
1.5 统计学处理
所有数据均输入计算机,用IBM SPSS Statistics 21.0软件进行处理。各检测指标统计数据均以“x±s”表示,各组间计量资料比较用单因素方差分析,各组间计数资料比较用χ2检验。检验结果以P<0.05为差异有统计学意义。
2 结果
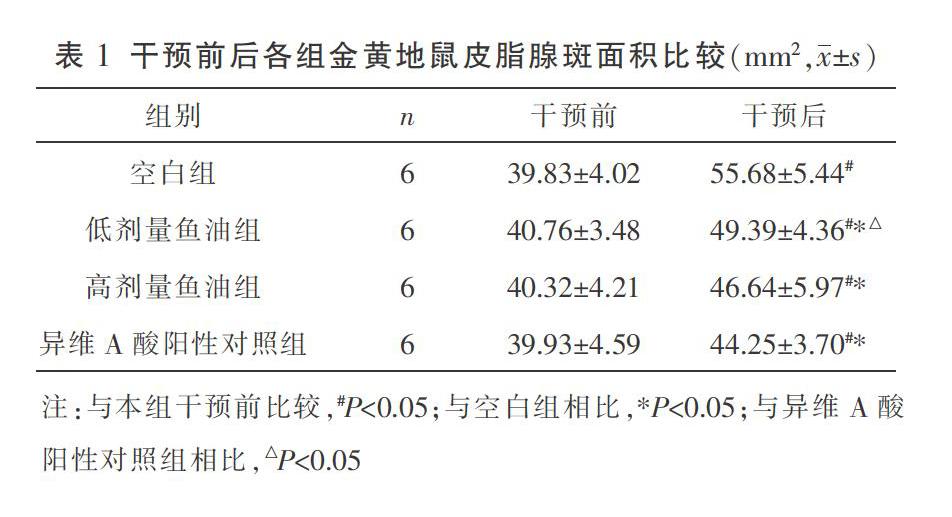
2.1 干预前后各组金黄地鼠皮脂腺斑面积变化情况
干预前各组金黄地鼠皮脂腺斑大小差异无统计学意义(P>0.05),具有可比性。与本组干预前相比,干预后各组金黄地鼠皮脂腺斑面积增加,差异具有统计学意义(P<0.05)。干预后,低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组金黄地鼠皮脂腺斑面积均比空白组小,差异具有统计学意义(P<0.05);与异维A酸阳性对照组相比,低剂量鱼油组金黄地鼠皮脂腺班面积较大,差异具有统计学意义(P<0.05),异维A酸阳性对照组与高剂量鱼油组金黄地鼠皮脂腺斑面积无差异(P>0.05)。见表1。
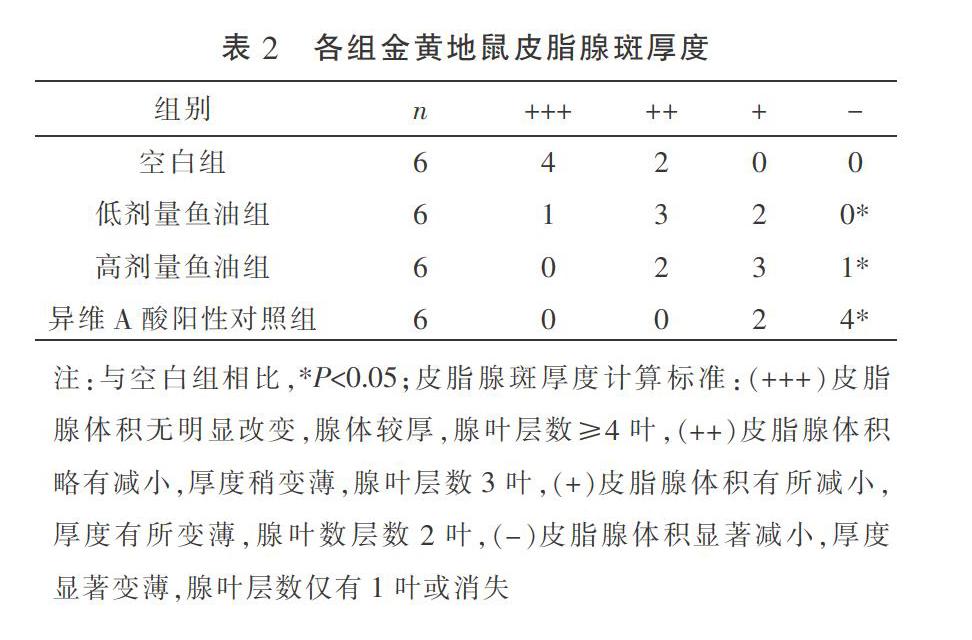
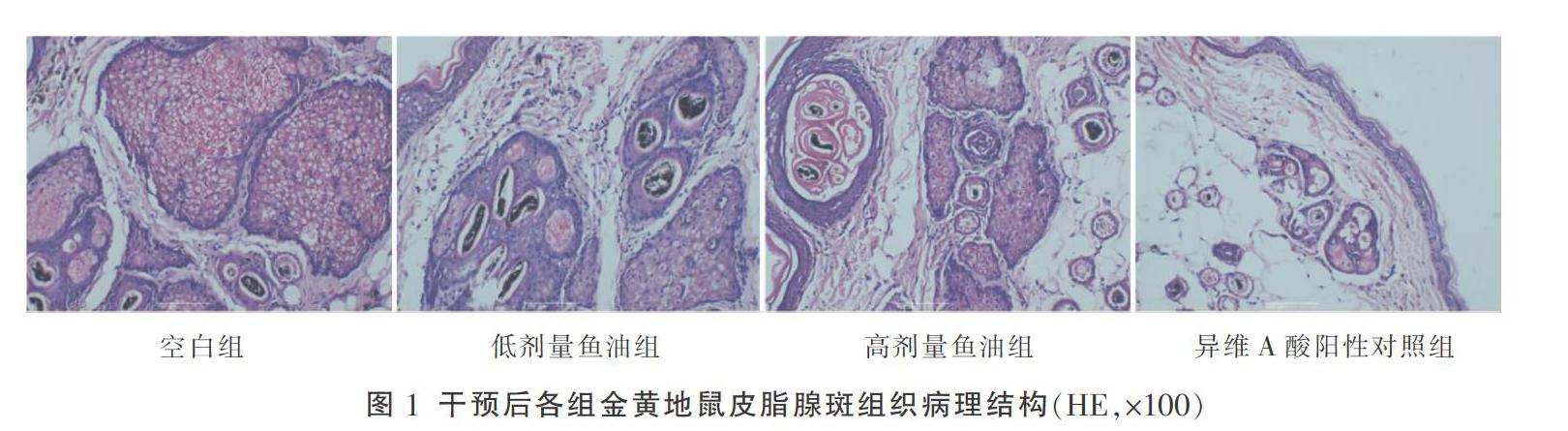
2.2 干预后各组金黄地鼠皮脂腺斑组织病理结构比较
空白组金黄地鼠皮脂腺体积大而饱满,呈分叶状,排列较紧密较厚,腺叶数多,且腺叶较大;与空白组相比,低剂量鱼油组、高剂量鱼油组及异维A酸阳性对照组皮脂腺体积缩小,排列明显疏松,重叠叶数稀少,皮脂腺厚度明显变薄,差异具有统计学意义(P<0.05)。见表2和图1。
2.3 干预后各组金黄地鼠皮脂腺斑PI3K、AKT蛋白表达水平比较
干预后,各组金黄地鼠皮脂腺斑组织细胞核及细胞浆被PI3K、AKT抗体染色成深浅不一的棕黄色,即阳性细胞,其中空白组阳性细胞数量最多,且颜色最深,面积最大;低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组阳性细胞数量均比空白组少,颜色较空白组浅。见图2。
与空白组相比,低剂量鱼油组、高剂量鱼油组、异维A酸阳性对照组PI3K蛋白、AKT蛋白表达量降低,差异具有统计学意义(P<0.05);与异维A酸阳性对照组相比,高剂量鱼油组AKT蛋白表达降低,差异具有统计学意义(P<0.05)。见表3。
3 讨论
Melnik等教授[15]认为痤疮是一种由“西方饮食”介导的“皮脂腺代谢性疾病”,典型的西方饮食有以下3个特点:(1)高糖和高碳水化合物;(2)大量乳制品摄入;(3)脂肪酸摄入比例不平衡,如过少Omega-3多不饱和脂肪酸和大量Omega-6多不饱和脂肪酸摄入。饮食因素能够导致皮脂代谢紊乱。脂质代谢紊乱围绕着痤疮发生发展的各个环节。总的来说,皮脂成分定量和定性改变显著促进了毛囊皮脂腺炎症反应和角化过度,改变皮肤微生态环境,诱导痤疮发生[16]。痤疮脂质代谢存在很多基因调控位点,其中,PI3K/AKT信号通路是脂质代谢的关键环节,参与了细胞增殖、分化、凋亡、自噬等多种生命活动[17-18]。丁畅等[19]发现荷叶碱可以通过抑制PI3K/AKT/mTOR通路来增加细胞自噬活性,从而减少细胞内脂质的沉积及细胞内总胆固醇含量,改善动脉粥样硬化。目前,研究证实,PI3K/AKT信号通路与痤疮皮脂代谢相关,微小RNA-338-3p(miR-338-3p)能够减少人皮脂细胞中的脂肪生成(包括胆固醇、甘油三酯和游离脂肪酸),其机制是抑制皮脂腺细胞中PI3K/AKT信号通路的传导[20]。
研究[21-22]表明Omega-3多不饱和脂肪酸能够以浓度依赖的方式减低AKT和PI3K活性,阻断其信号通路,这与本实验结果一致。Tang等[23]发现Omega-3多不饱和脂肪酸能够抑制转录因子叉头框架蛋白O1(forkhead box protein O1, FoxO1)和固醇调节元件结合蛋白-1(sterol regulatory element binding protein, SREBP-1)在脂肪细胞中的表达,抑制脂肪生成。FoxO1是PI3K/AKT通路的下游因子,在SZ95皮脂腺细胞中活化的PI3K/Akt通过增加FoxO1的核输出,降低其表达[24]。FoxO1不仅通过拮抗SREBP-1的表达来抑制皮脂脂肪生成,还可以负调控雷帕霉素复合物1,促进皮脂细胞自噬,改善皮脂代谢,从而抑制痤疮的发生发展[2,25]。由此可见,干预皮脂腺细胞中PI3K/AKT通路及其相关因子是减少皮脂产生和改善痤疮的可能机制。
本实验以皮脂腺分泌旺盛的金黄地鼠为痤疮模型,观察Omega-3多不饱和脂肪酸干预后其皮脂腺斑面积、HE染色组织病理图片及免疫组化改变,结果显示Omega-3多不饱和脂肪酸能够缩小金黄地鼠皮脂腺斑面积,使皮脂腺腺叶减少、腺体变薄、排列疏松,并且降低了金黄地鼠皮脂腺斑组织中PI3K、AKT蛋白表达水平(P<0.05),表明Omega-3多不饱和脂肪酸能够通过PI3K/AKT通路抑制皮脂腺增生,调节皮脂脂质代谢,从而达到防治痤疮的效果。本实验结果表明虽然Omega-3多不饱和脂肪酸改善皮脂腺斑增生作用不及异维A酸,但其对于痤疮的有利作用应当引起我们对饮食与痤疮的进一步思考。在临床诊断中,医生可关注患者的饮食结构,为患者提供饮食建议与管理,例如应当加强食物Omega-3多不饱和脂肪酸的来源,建议增加深海鱼、虾类的食物,以补充食物源性的Omega-3多不飽和脂肪酸,以达到预防和辅助治疗痤疮的目的。本实验对于Omega-3多不饱和脂肪酸改善痤疮皮脂分泌进行了创新性的探讨,但是接下来仍需要进一步优化实验方案,进行体外实验、临床观察、回顾性研究等,从多方面、多角度,充分证实Omega-3多不饱和脂肪酸对痤疮预防和治疗的积极作用。
参考文献
[1] VOS T, FLAXMAN A D, NAGHAVI M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: A systematic analysis for the Global Burden of Disease Study 2010[J]. The Lancet, 2012, 380(9859): 2163-2196.
[2] CONG T X, HAO D, WEN X, et al. From pathogenesis of acne vulgaris to anti-acne agents[J]. Archives of Dermatological Research, 2019, 311(5): 337-349.
[3] 王 鸿,邓永琼,熊 霞.痤疮再认识[J].临床皮肤科杂志,2019,48(12):774-777.
[4] MELNIK B. Linking diet to acne metabolomics, inflammation, and comedogenesis: An update[J]. Clinical, Cosmetic and Investigational Dermatology, 2015, 8(5): 371-388.
[5] CLATICI V G, VOICU C, BARINOVA E, et al. Butterfly effect and acne-The role of diet[J]. Dermatologic Therapy, 2020, 33(6): e13832.
[6] BALDWIN H, TAN J. Effects of diet on acne and its response to treatment[J]. American Journal of Clinical Dermatology, 2021, 22(1): 55-65.
[7] BALI['][C] A, VLA[ˇ][S]I['][C] D, [ˇ][Z]U[ˇ][Z]UL K, MARINOVI['][C] B, BUKVI['][C] MOKOS Z. Omega-3 Versus Omega-6 Polyunsaturated Fatty Acids in the Prevention and Treatment of Inflammatory Skin Diseases[J]. International Journal of Molecular Sciences, 2020, 21(3): 741-766.
[8] KUCHARSKA A, SZMUR?O A, SI['][N]SKA B. Significance of diet in treated and untreated acne vulgaris[J]. Postepy Dermatologii i Alergologii, 2016, 33(2): 81-86.
[9] KAUR N, CHUGH V, GUPTA A K. Essential fatty acids as functional components of foods-a review[J]. Journal of Food Science and Technology, 2014, 51(10): 2289-2303.
[10] SEN D, KAHVECI D. The global research progress of enzymatic processing of oils with Omega 3 polyunsaturated fatty acids[J]. 糧油食品科技, 2020, 28(4): 93-99.
[11] JUNG J Y, KWON H H, HONG J S, et al. Effect of dietary supplementation with Omega-3 fatty acid and gamma-linolenic acid on acne vulgaris: A randomised, double-blind, controlled trial[J]. Acta Dermato Venereologica, 2014, 94(5): 521-525.
[12] ASLAN [I][·], ?ZCAN F, KARAARSLAN T, et al. Decreased eicosapentaenoic acid levels in acne vulgaris reveals the presence of a proinflammatory state[J]. Prostaglandins & Other Lipid Mediators, 2017, 128(1): 1-7.
[13] 苗明三,付珍娜,田 硕.痤疮动物模型制备规范(草案)[J].中华中医药杂志,2018,33(1):197-200.
[14] 徐叔云.药理实验方法学[M].3版.北京:人民卫生出版社,2002:345-362.
[15] MELNIK B C. Western diet-induced imbalances of FoxO1 and mTORC1 signalling promote the sebofollicular inflammasomopathy acne vulgaris[J]. Experimental Dermatology, 2016, 25(2): 103-104.
[16] OTTAVIANI M, FLORI E, MASTROFRANCESCO A, et al. Sebocyte differentiation as a new target for acne therapy: An in vivo experience[J]. Journal of the European Academy of Dermatology and Venereology, 2020, 34(8): 1803-1814.
[17] MU D, LI D Y, LI J H, et al. Long non-codingRNA HULCprotects against atherosclerosis via inhibition of PI3K/AKT signaling pathway[J]. IUBMB Life, 2021, 73(1): 202-212.
[18] HUANG X J, LIU G H, GUO J, et al. The PI3K/AKT pathway in obesity and type 2 diabetes[J]. International Journal of Biological Sciences, 2018, 14(11): 1483-1496.
[19] 丁 畅,银萍,赵 奇,等.荷叶碱通过抑制PI3K/Akt/mTOR通路促进自噬减少巨噬细胞泡沫化的机制研究[J].中国病理生理杂志,2020,36(7):1230-1236.
[20] 劉 佳.miR-338-3p通过调控AKT信号通路抑制皮肤炎症及肺癌发展的研究[D].哈尔滨:东北林业大学,2018.
[21] HUANG Z, LIU C N, CAI P Z, et al. Omega-3PUFA attenuates MNU-induced colorectal cancer in rats by blocking PI3K/AKT/bcl-2 signaling[J]. OncoTargets and Therapy, 2020, 13: 1953-1965.
[22] YIN Y Q, SUI C G, MENG F D, et al. The Omega-3 polyunsaturated fatty acid docosahexaenoic acid inhibits proliferation and progression of non-small cell lung cancer cells through the reactive oxygen species-mediated inactivation of the PI3K/Akt pathway[J]. Lipids in Health and Disease, 2017, 16(1): 87.
[23] TANG M M, FLOYD S, CAI H L, et al. The status of ω-3 PUFAs influence chronic unpredicted mild stress-induced metabolic side effects in rats through INSIG/SREBP pathway[J]. Food & Function, 2019, 10(8): 4649-4660.
[24] MIRDAMADI Y, THIELITZ A, WIEDE A, et al. Insulin and insulin-like growth factor-1 can modulate the phosphoinositide-3-kinase/Akt/FoxO1 pathway in SZ95 sebocytes in vitro[J]. Molecular and Cellular Endocrinology, 2015, 415: 32-44.
[25] AKTAC KARABAY E, SALT1K Z A, UNAY DEMIREL ?. Evaluation of serum FoxO1, mTORC1, IGF-1, IGFBP-3 levels, and metabolic syndrome components in patients with acne vulgaris: A prospective case-control study[J]. Dermatologic Therapy, 2020, 33(6): e13887.
