芦荟大黄素对胃癌SGC-7901细胞Cav-1/PTEN/PI3K/PKB信号通路及侵袭、转移的影响
2021-07-28刘豪杰陈雪蕾
刘豪杰 陈雪蕾

〔摘要〕 目的 探讨芦荟大黄素对胃癌SGC-7901细胞Cav-1/PTEN/PI3K/PKB信号通路及侵袭、转移的影响。方法 将复苏后胃癌SGC-7901细胞分为空白组、对照组和实验组,空白组给予灭活胎牛血清的MEM培养基正常培养,对照组及实验组在空白组基础上分别加入姜黄素40 μmol/L和芦荟大黄素50 μmol/L培养,3组细胞均培养24 h。采用划痕实验检测细胞迁移闭合率,采用Transwell小室检测侵袭细胞个数,采用Western blot检测上皮间质化(EMT)相关蛋白E钙黏蛋白(E-cad)、N钙黏蛋白(N-cad)、波形蛋白(Vim)以及基质金属蛋白-9(MMP-9)、小窝蛋白-1(Cav-1)、PTEN磷脂酰肌醇-3激酶(PI3K)、蛋白激酶B(PKB)信号通路的表达。结果 与空白组比较,对照组及实验组细胞划痕闭合率及侵袭细胞数均降低(P<0.05),Vim、N-cad、PI3K、PKB、MMP-9蛋白表达降低(P<0.05),E-cad、Cav-1、PTEN蛋白表达升高(P<0.05);与对照组比较,实验组细胞划痕闭合率、侵袭细胞数及上述蛋白表达均无明显差异(P>0.05)。结论 蘆荟大黄素可抑制胃癌SGC-7901细胞迁移及侵袭能力,其机制可能与抑制EMT及改善Cav-1/PTEN/PI3K/PKB信号通路表达有关。
〔关键词〕 芦荟大黄素;胃癌细胞;SGC-7901;小窝蛋白-1;PTEN磷脂酰肌醇-3激酶;蛋白激酶B;迁移;侵袭
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.06.002
Effects of Aloe Emodin on Cav-1/PTEN/PI3K/PKB Signaling Pathway, Invasion and
Metastasis of Gastric Cancer SGC-7901 Cells
LIU Haojie, CHEN Xuelei
(Department of Gastroenterology, Ezhou Central Hospital, Ezhou, Hubei 436000, China)
〔Abstract〕 Objective To investigate the effects of aloe emodin on Cav-1/PTEN/PI3K/PKB signaling pathway, invasion and
metastasis of gastric cancer SGC-7901 cells. Methods After resuscitation, SGC-7901 cells were divided into blank group, control group and experimental group, the blank group was treated with MEM medium containing inactivated fetal bovine serum, on the basis of the blank group, the control group and experimental group were cultured with curcumin 40 μmol/L and aloe emodin 50 μmol/L, respectively. The three groups of cells were cultured for 24 hours. The migration and closure rate of cells was detected by scratch test, the number of invasive cells was detected by Transwell chamber, and the expression levels of epithelial mesenchymal transition (EMT) related proteins E-cadherin (E-cad), N-cadherin (N-cad), vimentin (Vim), matrix metalloproteinase-9 (MMP-9), caveolin-1 (Cav-1), PTEN phosphatidylinositol-3 kinase (PI3K) and protein kinase B (PKB) signaling pathways were detected by Western blot. Results Compared with the blank group, the wound closure rate and the number of invasive cells in the control group and experimental group were decreased (P<0.05), and the expression levels of Vim, N-cad, PI3K, PKB and MMP-9 protein were decreased (P<0.05), while the expression levels of E-cad, Cav-1 and PTEN protein were increased (P<0.05). Compared with the control group, there were no significant differences in wound closure rate, number of invasive cells and expression of the above proteins in the experimental group (P>0.05). Conclusion Aloe emodin can inhibit the migration and invasion of gastric cancer SGC-7901 cells, and its mechanism may be related to the inhibition of EMT and the improvement of Cav-1/PTEN/PI3K/PKB signal pathway expression.
〔Keywords〕 aloe emodin; gastric cancer cell; SGC-7901; caveolin-1; PTEN phosphatidylinositol-3 kinase; protein kinase B; migration; invasion
胃癌由于其发病隐匿,发现时多为中、晚期,已延误最佳治疗时机,据报道,我国每年新发胃癌病例50万,居恶性肿瘤发病率第3位[1]。因此,寻找多靶点、高效抗胃癌药物是目前亟待解决的问题。芦荟大黄素可从大黄和芦荟中提取,已被证实有明显的抗肿瘤作用,并且抗肿瘤靶点广泛[2-4]。本团队在前期研究[5-6]中证实,芦荟大黄素能诱导胃癌细胞自噬及凋亡,并且使癌细胞生物学行为能力降低,虽然已对芦荟大黄素抑制胃癌细胞增殖的部分机制进行了探索,但该药抑制胃癌细胞迁移及侵袭能力的机制尚不完全清晰。本研究基于前期研究结果,探索芦荟大黄素抑制胃癌SGC-7901细胞迁移、增殖的深层机制,并采用姜黄素作为阳性对照药物,现报道如下。
1 材料與方法
1.1 实验细胞、试剂及仪器
胃癌细胞SGC-7901由广西中医药大学陈文礼教授团队赠送。RPMI 1640培养基二甲基亚砜(沈阳万类生物科技有限公司,货号:s368d62、Z65482);Transwell小室(北京沃凯生物科技有限公司,货号:LM628Z727,批号2020305);E钙黏蛋白(E-cadherin, E-cad)、小窝蛋白-1(caveolin-1, Cav-1)、N钙黏蛋白(N-cadherin, N-cad)一抗(英国Abcam公司,货号:ab76319、ab2910、ab18203);磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B(protein kinase B, PKB)、波形蛋白(vimentin, Vim)一抗(南京建成生物工程研究所,货号:KF275、H233-3、KF685);人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome ten, PTEN)一抗(武汉艾美捷科技公司,货号:PAB4118);基质金属蛋白酶-9(matrix metalloprotein, MMP-9)一抗(美国BioVision公司,货号:3969-30T)。muLISKAN-MK3酶标仪(美国赛默飞世尔公司);Mini-Protean型小垂直板电泳和转印系统(美国伯乐公司)。
1.2 细胞培养及分组
取SGC-7901细胞进行复苏并接种于6孔板,细胞密度为4×103个/孔,培养至对数期。将细胞分为空白组、对照组及实验组,空白组细胞给予灭活胎牛血清的MEM培养基正常培养,对照组在空白组基础上加入姜黄素40 μmol/L培养[7],实验组细胞在空白组基础上加入芦荟大黄素50 μmol/L培养[5-6]。
1.3 划痕实验检测细胞迁移能力
取处于对数生长期SGC-7901细胞,接种并平铺于6孔板中,注意调整细胞分布密度,每孔约接种5×105个细胞,用手轻摇6孔板,细胞分布均匀后平置于实验台5 min,分组方法及加入药物剂量同“1.2”项,放入细胞恒温培养箱中进行培养,定期观察细胞生长情况,待细胞长满后用移液器枪头纵向划线,加入PBS溶液清洗划痕位置3次,继续孵育24 h,取出后于光学显微镜下拍照,并应用Image J软件分析划痕实验结果。
划痕闭合率=(划痕宽度0 h-划痕宽度24 h)/划痕宽度0 h×100%
1.4 Transwell小室检测细胞侵袭能力
取处于对数生长期的SGC-7901细胞,用无菌血清将SGC-7901细胞调成细胞混悬液接种于6孔板中,分组方法及加入药物同“1.2”项。再用无菌血清将Matrigel基质胶稀释为初始浓度的12.5%,取出Transwell小室,将稀释后的基质胶向每个小室注入30 μL,均匀铺于底部,待30 min后基质胶凝固,向每孔注入密度为1×104个/孔SGC-7901细胞,种于上层小室,下层小室沿壁缓慢注入500 μL含10% FBS的培养基,在37 ℃条件下,放入细胞恒温培养箱中24 h,取出小室后用PBS溶液冲洗掉上层细胞,用4% Paraformaldehyde固定30 min,再用PBS溶液进行清洗,加入结晶紫染色液,固定15 min后PBS溶液清漂去多余染色液,显微镜下拍照并计算细胞透膜数量(即为侵袭细胞数)。
1.5 Western blot法检测蛋白表达水平
取“1.2”项各组细胞,培养24 h后细胞进行裂解并制备成电泳上样液,BCA法检测上样液浓度后计算具体上样量,配制10% SDS-PAGE进行电泳,切胶后用PVDF膜进行转膜,经封闭、洗膜后,孵育Vim、N-cad、E-cad、Cav-1、PTEN、PI3K、PKB及MMP-9一抗(均1∶1 000稀释)过夜,次日经洗膜后常温下孵育二抗,时间为90 min,洗膜3次后用吸水纸吸干膜上多余液体,放入暗室内进行化学发光反应,应用Image J软件进行分析。实验独立重复3次。
目标蛋白表达=目的蛋白灰度值/β-actin灰度值
1.6 统计学处理
本研究数据采用SPSS 22.0软件进行分析,计数资料以“x±s”表示,满足正态分布及方差齐性时,使用单因素方差分析及LSD检验,不满足正态分布及方差齐性时使用秩和检验,P<0.05为差异有统计学意义。
2 结果
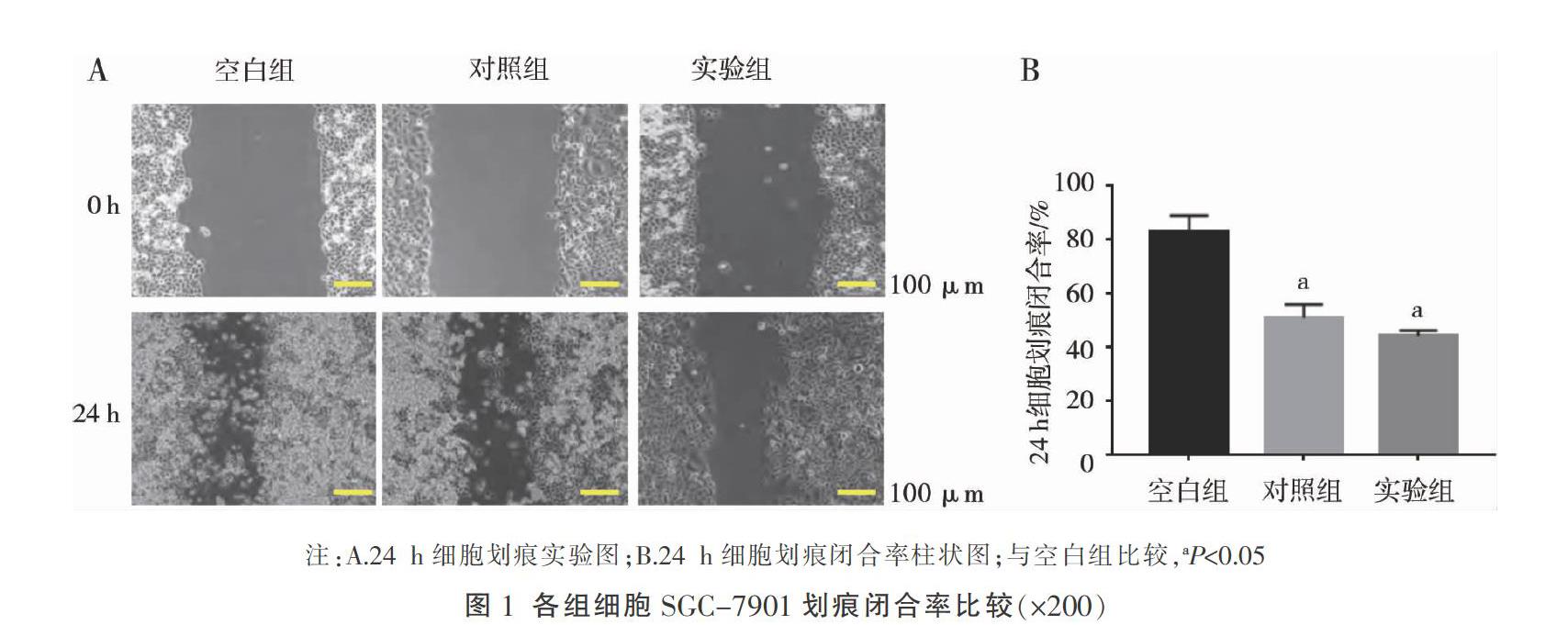
2.1 芦荟大黄素对SGC-7901细胞迁移能力的影响
对照组[(51.23±5.33)%]及实验组[(42.37±3.68)%]划痕闭合率均低于空白组[(83.61±6.29)%],差异均有统计学意义(P<0.05);与对照组比较,实验组划痕闭合率差异无统计学意义(P>0.05)。见图1。
2.2 芦荟大黄素对SGC-7901细胞侵袭能力的影响
对照组[(88.25±10.42)个]及实验组[(72.38±8.26)个]每视野下侵袭细胞数均低于空白组[(236.84±19.62)个],差异均有统计学意义(P<0.05);与对照组比较,实验组侵袭细胞数差异无统计学意义(P>0.05)。见图2。
2.3 芦荟大黄素对SGC-7901细胞EMT相关蛋白表达的影响
与空白组比较,对照组及实验组Vim、N-cad表达降低,E-cad表达升高,差异均有统计学意义(P<0.05);与对照组比较,实验组Vim、N-cad、E-cad蛋白表达差异无统计学意义(P>0.05)。见图3、表1。
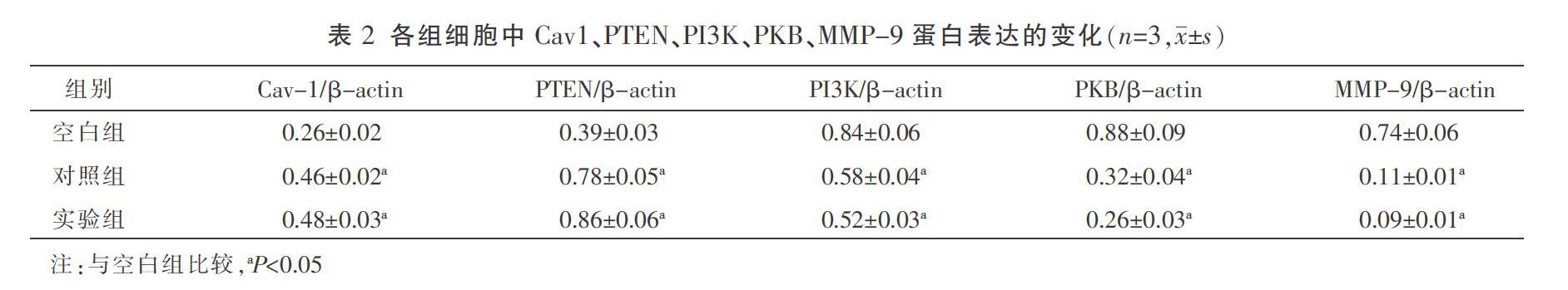
2.4 芦荟大黄素对SGC-7901细胞Cav-1、PTEN、PI3K、PKB、MMP-9蛋白表达的影响
与空白组比较,对照组及实验组Cav-1、PTEN蛋白表达升高,PI3K、PKB、MMP-9蛋白表达降低,差异均有统计学意义(P<0.05);与对照组比较,实验组Cav-1、PTEN、PI3K、PKB、MMP-9蛋白表达无统计学差异(P>0.05)。见图4、表2。
3 讨论
人体胃部血供丰富,给胃癌细胞的生长、增殖提供了便利环境,导致胃癌发展迅速,且易转移[8]。据统计,胃癌患者的死因主要源于肿瘤细胞的远端转移及淋巴结转移[9]。已有研究[10]证实,肿瘤组织的大小及浸润程度是肿瘤发生转移的重要因素,并且其对周围组织浸润深度的增加与是否发生淋巴结转移存在明显相关性。因此,抑制胃癌细胞转移及侵袭能力有可能成为降低患者死亡率的有效方法。
中药及中药单体的抗肿瘤作用已成为目前的研究热点之一,已有研究[11]显示,姜黄素、白三草酮、黄芩素及白藜芦醇均可抑制肿瘤细胞EMT的发生,并可通过多靶点及信号通路,降低肿瘤细胞的迁移能力。其中,姜黄素已被证实可通过抑制β-catenin/EMT,抑制肿瘤细胞迁移能力[12],同时抑制JAK/STAT3信号通路,以降低肿瘤细胞的侵袭能力[13],其抗肿瘤靶点与本研究主要内容相似,故而将姜黄素作为本研究的阳性对照药物。本团队在前期研究[6]中已证实,芦荟大黄素浓度为50 μmol/L时是抑制胃癌SGC-7901细胞生物学行为的最佳浓度,故而在本研究中继续沿用。本研究中细胞划痕实验及Transwell小室证实,芦荟大黄素可有效降低胃癌SGC-7901细胞划痕闭合率及侵袭细胞数,说明其对SGC-7901细胞迁移能力和侵袭能力均具有较好的抑制作用。EMT是肿瘤细胞移行“种植”的第一步,当EMT发生时,肿瘤细胞去除自己原有并未“发育”完全的上皮细胞特性,转化为与“种植”处组织或器官相关的间充表型特征,获得侵袭和迁移能力,随着血液循环或体液循环,侵袭其他组织、器官,定植增殖,实现远端或近端转移[14]。因此,EMT相关蛋白Vim、N-cad、E-cad也被视为肿瘤细胞发生迁移及侵袭的分子学水平标记物。本团队通过Western blot检测证实,芦荟大黄素可有效降低SGC-7901细胞中Vim、N-cad表达,提高E-cad表达水平,从蛋白层面说明芦荟大黄素对SGC-7901细胞侵袭及迁移能力具有抑制作用,这与细胞划痕实验及Transwell小室实验结果趋势相同。
小窝蛋白与脂类共同形成细胞质膜小窝,对细胞间信号传导及信号调节起关键作用[15]。细胞质膜小窝中Cav-1是主要支架蛋白,可横跨细胞质膜,同时对细胞外微环境刺激具有抵抗作用[16]。已有研究[17]证实,Cav-1是人体细胞中重要的抗癌蛋白之一,对肿瘤相关成纤维细胞增殖、细胞外基质及肿瘤新生血管均有抑制作用。此外,Cav-1被证实与PTEN存在结合序列,是细胞质膜PTEN表达水平的决定因素,二者共同发挥抑制肿瘤细胞迁移的作用[18]。临床研究[19]证实,PTEN在胃癌肿瘤组织中呈低表达,与肿瘤分期明显呈负相关,从临床角度说明PTEN的缺失可能是胃癌进展的关键因素。PI3K/PKB是PTEN下游的经典信号通路,当PTEN表达升高时,可使磷脂酰肌醇-3去磷酸化,从而使PI3K及PKB活性降低,抑制下游MMPs表达,实现抑制肿瘤细胞迁移及侵袭的目的;另外,PTEN/PI3K/PKB信号通路与胃癌细胞增殖、凋亡及细胞周期的调控均明显相关,对于抑制胃癌细胞生长具有重要意义[20]。本研究通过Western blot检测Cav-1/PTEN/PI3K/PKB信号通路及下游MMP-9蛋白表达,结果表明蘆荟大黄素可使SGC-7901细胞中Cav-1、PTEN表达升高,PI3K、PKB、MMP-9表达降低,说明Cav-1是芦荟大黄素抑制胃癌细胞迁移的作用靶点之一,其可能通过提高Cav-1、PTEN表达,抑制PI3K/PKB通路蛋白及下游MMP-9蛋白表达,从而抑制细胞基质的形成,改善肿瘤细胞微环境,抑制SGC-7901细胞迁移能力及侵袭能力。本研究亦有不足之处,由于技术条件及经费的限制,并未对Cav-1其他下游信号通路采用相应阻断剂进行干扰,结论的严谨性欠佳,本研究的不足之处,将在下一步研究中加以完善。
综上所述,芦荟大黄素可抑制胃癌SGC-7901细胞迁移及侵袭能力,其机制可能与抑制肿瘤细胞EMT及改善Cav-1/PTEN/PI3K/PKB信号通路表达有关。
参考文献
[1] 曹毛毛,李 贺,孙殿钦,等.2000—2019年中国胃癌流行病学趋势分析[J].中华消化外科杂志,2021(1):102-109.
[2] 王晓辉,王伊林,靳小石.芦荟大黄素对肝癌HepG2细胞生长、迁移及纤维状肌动蛋白的影响[J].中国实验方剂学杂志,2018,24(11): 111-116.
[3] CHENG C S, DONG W G. Aloe-emodin induces endoplasmic Reticulum stress-dependent apoptosis in colorectal cancer cells[J]. Medical Science Monitor, 2018, 24: 6331-6339.
[4] GAO R, WU X W, HUANG Z, et al. Anti-tumor effect of Aloe-emodin on cervical cancer cells was associated with human papillomavirus E6/E7 and glucose metabolism[J]. OncoTargets and Therapy, 2019, 12: 3713-3721.
[5] 刘豪杰,陈文礼,陈雪蕾.芦荟大黄素调控notch-1/Akt/NF-κb信号通路对胃癌SGC-7901细胞生物学行为的影响[J].中医学报,2020,
35(4):831-836.
[6] 刘豪杰,陈文礼,陈雪蕾.芦荟大黄素对胃癌SGC-7901细胞凋亡、自噬及p53/AMPK/mTOR信号通路的影响[J].中国药师,2019,
22(10):1829-1834.
[7] 李淑兰,贺倩倩,宫凯凯,等.姜黄素通过PI3K/p53信号通路调控人胃癌细胞SGC-7901的增殖、凋亡和周期[J].安徽医科大学学报,2021,56(1):43-48.
[8] 国家卫生计生委合理用药专家委员会.消化道恶性肿瘤合理用药指南[J].中国合理用药探索,2017,14(9):5-54.
[9] KUNISAKI C, SHIMADA H, NOMURA M, et al. Distribution of lymph node metastasis in gastric carcinoma[J]. Hepato-gastroenterology, 2006, 53(69): 468-472.
[10] 李丹丹.早期胃癌临床病理特征与淋巴结转移的相关分析[J].中国现代医生,2017,55(11):94-96.
[11] 蒋寒冰,刘 佳,张淑君,等.中药单体逆转胃癌上皮间质转化的研究进展[J].现代肿瘤医学,2020,28(23):4196-4199.
[12] 刘文虎,袁江北,张 帆,等.姜黄素通过Wnt3a/β-catenin/EMT信号通路抑制胃癌细胞的增殖、迁移及侵袭[J].中国中药杂志,2019,
44(14):3107-3115.
[13] 李 磊,陈志武.姜黄素对胃癌细胞增殖、迁移及Hsp90/JAK/STAT3通路的影响[J].安徽医科大学学报,2019,54(3):448-451,457.
[14] PASTUSHENKO I, BLANPAIN C. EMT transition states during tumor progression and metastasis[J]. Trends in Cell Biology, 2019, 29(3): 212-226.
[15] COHEN A W, HNASKO R, SCHUBERT W, et al. Role of caveolae and caveolins in health and disease[J]. Physiological Reviews, 2004, 84(4): 1341-1379.
[16] 刘进月,马志强,刘 冬.小窝蛋白-1与肿瘤微环境的研究进展[J]. 中华实验外科杂志,2017,34(12):2296-2298.
[17] 李庆伟,周 莹,逄 越.Caveolin-1结构、功能及其与肿瘤的关系[J].辽宁师范大学学报(自然科学版),2017,40(2):232-238.
[18] XIA H, KHALIL W, KAHM J, et al. Pathologic caveolin-1 regulation of PTEN in idiopathic pulmonary fibrosis[J]. The American Journal of Pathology, 2010, 176(6): 2626-2637.
[19] 帕爾哈提·沙依木,艾克热木·玉苏甫,肉斯旦·图尔迪,等.胃癌中Survivin、PTEN蛋白的表达及临床相关性分析[J].实用癌症杂志,2020,35(8):1253-1257.
[20] 刘红兵,张皓渝,林兆博,等.PTEN/PI3K/AKT信号通路系统与胃癌研究进展[J].中国现代普通外科进展,2020,23(3):244-247.
