高寒地区不同海拔梯度西北小檗生境土壤微生物群落结构及多样性分析
2021-07-28向前胜张登山
向前胜,张登山,孙 奎,王 宁
(1 青海大学 农林科学院,西宁 810016;2 韶关学院,广东韶关 512005)
土壤微生物参与生态系统中的物质循环和能量流动,对土壤中的有机质矿质化和腐殖质化具有重要的作用,是土壤养分转化和循环的主要驱动力[1-4]。土壤微生物群落结构的多样性及稳定性反映土壤的营养条件[5-6],进而影响植物的生长发育和对环境的适应能力[7]。土壤微生物在生命过程中产生的物质(如赤霉素和抗菌素)可以促进植物生长,具有增强植物抗病性的作用[8]。土壤细菌是构建土壤微生物的主要群体,细菌的多样性和群落周转易受环境因素的影响,亦能有效反映环境变量的状况[9];部分真菌共生体可提高植物抗氧化保护酶活性和抗氧化剂含量,同时也能诱导信号物质和次生代谢物质产生,诱导植物相关保护基因的表达,以促进植物对非生物逆境的抗性,降低逆境胁迫对植物造成的伤害。对植物生境土壤微生物的空间分布模式的研究可探究其与植物适应逆境胁迫的协同作用机理。
海拔梯度的变化会导致温度、光照、水分等多种环境因子的改变,引起山地区域小气候、土壤理化特征等梯度效应,进而影响土壤微生物生物量、活性及群落结构的变化[10-11]。土壤微生物群落及功能多样性随海拔的变化趋势有多种模式:先上升后下降、单调递减、单调递增、无规律等[10,12-16],主要因研究区域、研究对象的不同而有差异。海拔梯度对土壤微生物群落组成及多样性的影响主要是通过影响土壤温度、养分、理化性质等间接产生的。土壤中的各类微生物都有适应生长的温度生态幅和最适生长温度,温度是不同海拔梯度微生物群落变化最重要的环境影响因素[17]。同时,海拔也会影响土壤养分的含量,其数量和质量可以影响微生物生长,通常被认为是决定土壤微生物生存、物种组成和代谢的关键因素之一[18-19]。土壤pH的变化是土壤中优势真菌和细菌的主要驱动力[20-21],土壤中硝态氮的含量与可溶性有机氮含量具有显著正相关性,而可溶性有机氮作为微生物较易利用的溶解性有机质,能促进微生物的生长,影响着微生物的群落结构和多样性[22-24]。在高海拔地区,温度和氮的有效性是微生物活动和分解的主要制约因素[25-26]。以上研究表明,微生物群落结构及多样性特征会因海拔梯度的变化趋势不同而有差异,产生这些差异的原因可能与不同地区不同海拔位置的植被状况、气候条件和土壤环境存在密切关系,因此有必要加强不同地区不同海拔梯度同一植物生境条件下土壤微生物群落结构及多样性变化格局和影响机制的研究。
西北小檗(B.vernae)为小檗科小檗属的植物,为刺状灌木,具有抗旱、耐寒、耐盐碱、耐风蚀,适应性强等特性,是一种抗逆性良好的生态植物。西北小檗体内含有丰富的次生代谢物——小檗碱(又名黄连素),具有能抑制多种癌细胞和治疗心血管系统疾病等作用,有较高的药用价值和经济价值,最新研究表明,小檗碱可用作为新型冠状肺炎治疗的潜在候选药物[27]。除此之外,西北小檗的花、果和叶均有较高的观赏价值,可用作庭院绿化的观赏树种,果实可用作保健饮料开发、天然色素提取和制作饲料的原料[28]。青海高原是西北小檗的重要分布区之一[29],主要分布在海拔2 300~4 100 m左右,且长势良好。关于西北小檗的研究主要集中在其体内盐酸小檗碱含量的变化上,结果表明西北小檗各部位盐酸小檗碱的含量随海拔降低而呈现减少的趋势[30-33]。目前,尚未有对青海高原不同海拔分布的西北小檗生境中土壤微生物群落组成与多样性进行系统性的研究。基于此,本研究以自然分布在青海高原不同海拔梯度的西北小檗生境中的土壤样本为研究对象,采用高通量测序技术分析土壤微生物群落组成及多样性分布特征,探究西北小檗根系与土壤微生物的相互关系,为将西北小檗用作高海拔城镇绿化树种的研究提供理论参考。
1 材料和方法
1.1 样品采集
2019年秋季,在青海高原按海拔梯度分别在海东市乐都区上北山林场底(hdld1)、海东市乐都区上北山林场中部(hdld2)、西宁市大通县新庄村佛沟(xndt)、黄南州泽库县麦秀林场(hnzk)、玉树州勒巴沟景区(yslbg)和玉树州玉树县下拉秀乡(ysxlx)共6处西北小檗的自然分布生境地取样。以西北小檗主茎为圆心,半径为25 cm的位置取土样,分别采集样点处0~20 cm、20~40 cm、40~60 cm的土层,各土层分别采集4次(东、南、西、北方位),重复取样3次,各层土样均匀混合后装入两种自封袋并标记,一类土样保存在-20 ℃冰箱用于微生物测序分析(保存时间为72 h),另一类风干保存以用作土壤理化性质测定。采样基本信息见表1。

表1 样点基本信息
1.2 试验方法
1.2.1 土壤微生物群落结构测定DNA 提取及16s扩增子测序在北京奥维森基因科技有限公司完成,使用DNA Kit (Omega Bio-tek, Norcross, GA,U.S.)对6个采样点共18份样品提取DNA,获得的DNA用1%琼脂糖凝胶电泳检测抽提的基因组DNA,并用分光光度法(260 nm/280 nm 光密度比)进行质量检测,再将样品于-20 ℃保存以备后续实验使用。细菌16SrDNAV3-V4扩增引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′),真菌ITS1片段扩增采用特异引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR扩增程序为:94 ℃ 2 min;94 ℃ 30 s,56 ℃(细菌)/56 ℃(真菌)30 s,72 ℃ 30 s,共25(细菌)//33(真菌)个循环;72 ℃ 5 min,10 ℃保温。将产物进行胶回收后作为模板进行第二步PCR扩增,采用40 μL反应体系:5×Buffer 8 μL,dNTP(10 mmol/L)1 μL,Phusion超保真DNA聚合酶0.8U,F/R特异引物(10 μmol/L)各1 μL,DNA模板5 μL,ddH2O补至40 μL。PCR扩增程序为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共8个循环;72 ℃ 5 min,10 ℃保温。
1.2.2 土壤理化性质测定土壤理化性质测定方法参考鲍士旦的《土壤农化分析》[34]进行,对18个土壤样品进行理化性质测定,每个样品重复3次。土壤pH值采用pH仪(上海雷磁PHS 3C)测定《NY/T1121.2-2006土壤检测》;土壤有机质含量测定采用《LY/T 1237-1999重铬酸钾容量法-外加热法》;土壤碱解氮含量测定采用碱解扩散法《LY/T1229-1999碱解扩散法》;土壤硝态氮含量测定采用紫外分光光度计法《GB/T 32737-2016紫外分光光度法》;土壤铵态氮含量测定采用《LY/T 1231-1999靛酚蓝比色法》;土壤速效磷含量测定采用钼锑抗比色法《HJ704-2014碳酸氢钠提取-钼锑抗比色法》;土壤速效钾含量测定采用火焰光度计法《NY/T889-2004乙酸铵提取-火焰光度法》。
1.3 数据分析
通过 Illumina MiSeq 平台进行 Paired-end 测序,测序原始序列上传至 NCBI的SRA数据库。下机数据经QIIME(v1.8.0)软件过滤、拼接、去除嵌合体,去除打分低于20、碱基模糊、引物错配或测序长度小于150 bp 的序列。根据barcodes归类各处理组序列信息,聚类为用于物种分类的 OTU(operational taxonomic units),OTU相似性设置为97%。通过RDP Classifier (http://rdp.cme.msu.edu/classifier/classifier.jsp)算法基于细菌数据库(Silva 128)对 OTU 代表序列进行比对分析,并在界(Domain)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)水平注释群落的物种信息。使用R中ggplot2[35]包绘制物种在门水平和属水平上的丰度直方图。利用Mothur软件进行α多样性分析(包括 Shannon指数、 Chao1指数), 并利用SPSS 22.0进行Duncan多重比较,分析各样点土层各指数间差异显著性。基于 Unweighted Unifrace 距离,使用R(V3.6.0)软件的vegan(V2.5-6)和pheatmap(V1.0.12)进行聚类分析,在OTU水平上计算18个样品之间的Bray-cutis距离,pheatmap程序包进行作图[35],分析6处土壤样品间微生物群落差异性。利用SPSS 22.0进行Duncan多重比较,分析6处取样点各项土壤理化指标间差异显著性。利用Canoco for Windows 4.5对18个样品的OTU相对丰度矩阵做去趋势对应分析(detrended correspondence analysis, DCA),根据结果中梯度长度在第一轴上的值,选择冗余分析(redundancy analysis, RDA),分析土壤理化指标对细菌、真菌群落多样性的影响,土壤理化指标解释量显著性检验利用Monte Carlo置换检验方法,置换次数为999。并利用CanoDraw for windows进行作图[36]。
2 结果与分析
2.1 土壤微生物样品测序结果
在97%的序列相似度水平上,通过对序列进行质控和过滤,共获得细菌、真菌OTU数分别为35393个、10719个,细菌种数大于真菌。
由图1可知,绝大多数样品的稀疏曲线趋于平缓,如ysxlx-2细菌、hdld1-3真菌样品,即再增大测序深度也不会增加新的OTU数量,说明该样品的OTU覆盖度已达到饱和,能够反映西北小檗生境中各样点土壤微生物群落结构组成。而hdld1-1细菌、hnzk-1真菌样品等的稀疏曲线仍有上升趋势,尚未达到饱和状态,说明随着测序深度的增加可能会发现新的细菌和真菌类群。所有样点中,hdld1样点的细菌OTU数量最多,hnzk样点的真菌OTU数量最多;除hdld2和yslbg样点外,其他采样点土层0~20 cm的细菌、真菌OTU数量均较20~40 cm和40~60 cm的多。

图例中“编号-1”、“编号-2”、“ 编号-3”分别表示各样点0~20 cm、20~40 cm、40~60 cm的土层,下图均同。图1 西北小檗生境各样点土壤细菌(A)和真菌(B)样品在97%水平下的稀疏曲线“No.-1”, “No.-2” and “No.-3” in the legend represent the soil layers of 0-20 cm, 20-40 cm and 40-60 cm at each sample point, respectively and the same with the following figuresFig.1 Rarefaction curves of soil bacterial (A) and fungal (B) samples in various points of B. vernae habitat at cut off level of 97%
2.2 土壤微生物群落多样性指数分析
由表2可知,样点hdld1的0~20 cm土层细菌OTU数值(2 540±347)最高。土壤细菌丰富度与多样性指数均与OTU数目变化基本一致,其中hdld1样点0~20 cm土层的细菌群落的平均Chao1指数和Shannon指数最高,分别为3 842.60±265.15和9.87±0.10。
0~20 cm土层:OTU数值中,ysxlx样点的最低,且与xndt、hdld2和hdld1样点的差异显著;hdld1样点的最高,说明hdld1样点0~20 cm土层的细菌物种的数量最多,与该点中、深层土壤存在显著差异。Chao1指数中,ysxlx样点数值最低,细菌群落丰富度最低;hdld1样点数值最高,与hdld2、hnzk、yslbg和ysxlx样点存在显著差异,且与该点中、深层土壤存在显著差异。Shannon指数中,各样点间差异不显著,hdld1样点的数值最高,说明该点表层土壤细菌群落多样性最高,且高于该点中、深层。
20~40 cm土层:OTU数值中,ysxlx样点的最低,与另5处样点均存在显著差异;xndt样点数值最高,说明该样点该土层的细菌物种的数量最多。Chao1指数中,ysxlx样点数值最低,细菌群落丰富度最低,且与其他5个样点均存在显著差异;hdld2样点数值最高,与其他样点差异不显著,但与该点40~60 cm土层差异显著。Shannon指数中,ysxlx样点数值最低,除与xndt样点存在显著差异外,与另4个样点无显著差异;xndt样点数值最高,该点各土层间无显著差异。
40~60 cm土层:OTU数值中,hdld2样点的最低,除与xndt样点存在差异不显著外,与其他样点均存在显著差异,hdld1样点该土层的细菌物种数量最多。Chao1指数中,xndt样点数值最低,细菌群落丰富度最低,除与yslbg样点存在差异显著外,与其他样点差异不显著;yslbg样点的数值最高,细菌群落丰富度最高,该点各土层间差异不显著。Shannon指数中,hdld2样点数值最低,细菌群落多样性最低,与其他样点间差异不显著;hdld1样点数值最高,细菌群落多样性最高,且该点各土层间差异不显著。
土壤真菌丰富度及多样性比较结果见表2,hnzk样点0~20 cm土层的OTU数及Chao1指数数值(3 410.34±456.30)最高,xndt样点0~20 cm土层的Shannon指数数值(6.86±0.26)最高。

表2 土壤样品微生物丰富度和群落多样性指数
0~20 cm土层:OTU数值中,yslbg样点的最低,除与ysxlx样点的差异不显著外,与另4处样点的差异显著;hnzk样点最高,说明hnzk样点0~20 cm土层的真菌物种的数量最多,与该点中、深层土壤存在显著差异。Chao1指数中,各样点间存在显著差异,yslbg样点数值最低,真菌群落丰富度最低;hnzk样点数值最高,且该点各土层间土壤存在显著差异。Shannon指数中,ysxlx样点数值最低,说明该点表层土壤真菌群落多样性最低,与其他5处样点存在显著差异,且该点各土层间存在显著差异;xndt样点数值最高,说明该样点表层土壤真菌群落多样性最高,除与ysxlx样点差异显著外,与另外4处样点间差异不显著。
20~40 cm土层:OTU数值中,ysxlx样点的最低,除与yslbg样点差异不显著外,与另4处样点均存在显著差异;xndt样点数值最高,说明该样点该土层的真菌物种的数量最多。Chao1指数中,yslbg样点数值最低,真菌群落丰富度最低,且与其他5个样点均存在显著差异;hnzk样点数值最高,除与xndt样点差异不显著外,与其他4处样点差异显著。Shannon指数中,hnzk样点数值最低,除与xndt样点存在显著差异外,与另4个样点无显著差异;xndt样点数值最高,真菌群落多样性最高,该点各土层间无显著差异。
40~60 cm土层:OTU数值中,hdld1样点的最低,除与ysxlx样点存在差异不显著外,与其他4处样点均存在显著差异;hdld2样点该土层的真菌物种数量最多。Chao1指数中,hdld1样点数值最低,真菌群落丰富度最低,与其他样点均存在显著差异;hdld2样点的数值最高,说明该点该土层真菌群落丰富度最高。Shannon指数中,ysxlx样点数值最低,真菌群落多样性最低,与其他5处样点存在显著差异;hdld2样点数值最高,说明其真菌群落多样性最高,除与xndt样点存在差异不显著外,与其他4处样点均存在显著差异。
2.3 土壤微生物群落结构组成分析
2.3.1 细菌群落结构组成依据18个土壤样品细菌门水平分布柱状图(图2,A),共得到10个细菌类群(相对丰度≥0.1%细菌门),相对丰度最高的为放线菌门(Actinobacteria),在不同位置采样点的平均值分别为47.54%(ysxlx)、23.38%(yslbg)、42.35%(hnzk)、36.22%(xndt)、30.42%(hdld1)和21.93%(hdld2),其中ysxlx处数值最高,而各土层中hnzk-1的相对丰度高达52.23%。其余前几个细菌门的相对丰度由高至低依次为变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)等。
在细菌属分类水平上共得到21个类群(相对丰度≥0.1%细菌属)(图2,B),尚未鉴定出来的未分类细菌属相对丰度最高,除hnzk样点相对较低外,其余样点所处的生境类型条件下相对丰度均高于63.71%,各土层中,xndt样点40~60 cm中相对丰度高达75.64%。hnzk样点中除放线菌门的未分类细菌属之外,Gaiella、RB41、硝化螺旋菌属(Nitrospira)、土微菌属(Pedomicrobium)、Iamia、和土壤红杆菌属(Solirubrobacter)分别占总量的2.43%、1.79%、1.11%、1.23%、1.02%和1.64%。
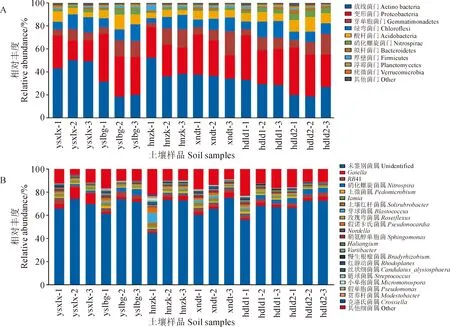
图2 西北小檗生境0~60 cm土层土壤细菌门(A)和细菌属(B)群落结构组成Fig.2 The structure composition of soil bacterial phylum and genus community in 0-60 cm soil layers with B. vernae habitat
2.3.2 真菌群落结构组成根据真菌门水平分布柱状图(图3,A),共得到8个真菌类群(相对丰度≥0.1%真菌门),其中子囊菌门(Ascomycota)相对丰度最高,在hnzk、hdld1和hdld2中相对丰度均高于60%,各样点中相对丰度最高的为hnzk(70.34%),各土层中hnzk样点20~40 cm的相对丰度最高,达77.95%。其次为担子菌门(Basidiomycota),ysxlx和yslbg中的相对丰度均大于44%,ysxlx样点40~60 cm土层中高达70.92%。除此之外,xndt和hdld1样点的球囊菌门(Mortierellomycota)相对丰度分别为24.59%和22.18%,高于其他样点。其余真菌类群相对丰度较低,同时具有未分类真菌门存在。
在真菌属水平柱状图上可以看出(图3,B),共得到59个真菌类群(相对丰度≥0.1%真菌属),以子囊菌门的未分类真菌属相对丰度最高,集中表现在样点ysxlx和hdld2中,均超过49%,其中ysxlx样点土层40~60 cm相对丰度最大,为79.30%。被孢霉属(Mortierella)在样点xndt的相对丰度最高,为23.58%,在土层xndt-1、xndt-2、hdld1-1和hdld1-2中的相对丰度较高,分别为23.64%、31.16%、34.63%和25.95%;子囊菌门古根菌属(Archaeorhizomyces)在样点hnzk相对丰度最高,为33.77%,在该处土层20~40 cm和40~60 cm中的相对丰度较高,分别为60.90%、39.81%;珊瑚菌属(Clavaria)在样点yslbg的相对丰度最高,为24.33%,在该处土层20~40 cm和40~60 cm中的相对丰度较高,分别为20.46%、52.49%;丝盖伞属(Inocybe)在样点yslbg的相对丰度最高,为9.91%,在该处土层20~40 cm中的相对丰度较高,为16.42%;青霉菌属(Penicillium)在样点hnzk的相对丰度最高为5.98%,在该处土层0~20 cm中相对丰度较高,为17.55%;腐质霉属(Humicola)在样点hdld2的相对丰度最高为7.41%,在该处土层0~20 cm中相对丰度较高,为14.70%。但这6个属在其余样品中比例不高。

图3 西北小檗生境0~60 cm土层土壤真菌门(A)和真菌属(B)群落结构组成Fig.3 The structure composition of soil fungi phylum and genus community in 0-60 cm soil layers with B. vernae habitat
2.4 土壤微生物群落多样性差异分析
基于Bray-cutis距离,在OTU水平上利用物种有无及其相对丰度信息进行各采样点土壤样品微生物群落多样性相似性分析,红色越深表示差异性越大,相似性越小,而蓝色越深代表差异性越小,相似性越大。如图4,A中,ysxlx与yslbg、hnzk、xndt、hdld1和hdld2采样点的土壤细菌群落多样性具有差异(d>0.50),hnzk-1与yslbg-2、yslbg-3的差异较大(d>0.69)。而相比之下,yslbg与hdld2最近(d=0.46),可以看出,不同采样点土壤细菌群落多样性具有一定的差异。在同一采样点,不同土层的细菌群落的多样性具有相似性,特别是在hdld1样点中最为显著(hdld1-2与hdld1-3最早被分出,d =0.24)。
如图4,B,同一样点不同采样土层真菌群落多样性相似性较大,各采样点间的相似性不同。ysxlx-1与ysxlx-2最先被分出,因此具有较高的相似性(d=0.28),说明两者在物种组成及相对丰度上与其他采样点存在较大差异。 ysxlx与yslbg、hnzk、xndt、hdld1和hdld2具有差异性(d>0.87),yslbg-2、yslbg-3与ysxlx-1、ysxlx-2、ysxlx-3的差异性较大(d>0.90)。相比之下,xndt与hdld1关系最近,但两者相似度并不高(d=0.78)。因此,不同采样点和采样土层的差异会影响真菌群落多样性。
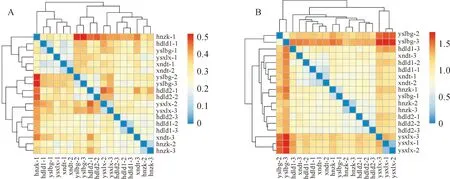
图4 西北小檗生境土壤样品细菌(A)和真菌(B)群落多样性分析Fig.4 Analysis of the diversity of bacterial(A) and fungal(B)communities in soil samples with B. vernae habitat
2.5 土壤环境因子及其对微生物群落多样性的影响分析
2.5.1 土壤理化指标测定结果从表3分析可知,西北小檗各采样点土壤均呈弱碱性,且随着土壤深度增加,pH值增大,随海拔梯度变化的趋势不明显。xndt样点40~60 cm土层的pH最高,为8.54。

表3 西北小檗生境土壤理化性质表
各样点的有机质(OM)、速效钾(AK)、速效磷(OP)、硝态氮(N)、碱解氮(AN)和铵态氮(A)值随海拔梯度变化的趋势不明显,但部分指标随土层深度变化呈现一定的变化规律。其中,土壤的速效钾、速效磷和硝态氮值表现出随土层深度增加而递减的趋势,有机质、碱解氮值表现出土壤0~20 cm土层均高于20~40 cm、40~60 cm土层,而铵态氮值在ysxlx和hdld2样点表现出随土层深度增加而增加的趋势,其他样点则表现出随深度增加而递减的趋势。hdld2样点的0~20 cm土层的有机质、速效钾、速效磷和碱解氮数值最高,分别为32.46 g/kg、354.89 mg/kg、11.25 mg/kg和369.54 mg/kg;xndt样点0~20 cm土层的硝态氮数值最高,为17.25 mg/kg;hdld2样点的40~60 cm土层的铵态氮数值最高,为6.92 mg/kg。
2.5.2 土壤理化指标与微生物群落多样性关系分析进行DCA分析计算,结果lengths of gradient<3,即土壤理化性质就细菌、真菌类群分布产生的影响应该利用RDA进行分析, 用RDA分析各采样点土壤环境因子与细菌、真菌群落之间的关系(图5)。
细菌RDA 冗余分析结果(图5,A)显示,土壤理化性质对细菌群落在第一主坐标轴的解释度为47.10%,在第二主坐标轴的解释度为12.21%。N、AK、OM、OP和pH线段长度较长,说明其对细菌群落组成影响较大,而A的线段长度较短,说明对细菌群落组成影响较小。Gaiella、Nordella、玫瑰弯菌属(Roseiflexus)与pH正相关,与其他指标呈负相关;RB41、AKYG587、芽单胞菌属(Gemmatimonas)、侏囊菌亚目的Haliangium与OM、AK、A、AN、OP和N均呈正相关,与pH呈负相关;硝化螺旋菌(Nitrospira)与A、pH和OM正相关,与其他指标呈负相关;土微菌属(Pedomicrobium)、Pseudonocardia与N、OP、AN、AK正相关,与OM不相关,与A、pH呈负相关;Iamia与文中各指标均呈负相关;红色杆菌亚目的Solirubrobacter、芽球菌属(Blastococcus)、Candidatus_Alysiosphaera、德沃斯氏菌属(Devosia)、鞘脂单胞菌属(Sphin-gomonas)、Bradyrhizobium与A、pH呈负相关,与其他指标正相关;中慢生根瘤菌属(Mesorhizobium)与N、OP、AN呈正相关,与AK不相关,与其他指标负相关;分枝杆菌属(Mycobacterium)与N、OP、AN、AK呈正相关,与其他指标负相关;Variibacter与N、OP、AN、AK、OM正相关,与A不相关,与其他指标负相关;生丝微菌科的Rhodoplanes、类诺卡氏菌属(Nocardioides)与N、OP、AN、AK、OM正相关,与其他指标负相关。综上,与pH、N、OP、AN、AK呈正相关的细菌属较多,与A呈正相关的细菌属较少。
真菌RDA冗余分析结果(图5,B)显示,土壤理化性质对真菌群落在第一主坐标轴的解释度为19.34%,在第二坐标轴的解释度为14.14%。OP、N、AK和pH的线段长度较长,说明其对真菌群落组成影响较大,而A、OM、AN的线段长度较短,说明对真菌群落组成影响较小。被孢霉菌属(Mortierella)、外瓶柄霉属(Exophiala)、青霉属(Penicillium)、腐质霉属(Humicola)、木层孔菌属(Phellinus)和Gibberella与OP、AK、N正相关,橘黄刺杯菌属(Cookeina)、古根菌属(Archaeorhizomyces)、Hygrocybe与AK、N正相关,Tetracladium与AK、OP正相关,Dactylonectria、Podospora、Ilyonectria与OP正相关,珊瑚菌属(Clavaria)与N正相关,Oidiodendron、珊瑚菌属与AK不相关,橘黄刺杯菌属与OP不相关。角担菌属(Ceratobasidium)、Halegrapha、Inocybe、Cadophora与AN、pH、A、OM呈正相关,古根菌属、Hygrocybe和Clavaria与AN、pH、A呈正相关,木层孔菌属、赤霉属(Gibberella)、橘黄刺杯菌属与AN呈正相关,Tetracladium、树粉孢属(Oidiodendron)、Ilyonectria、Podospora、Dactylonectria和Pseudeurotium与OM呈正相关。综上,与N、AK、OP呈正相关的真菌属最多。

a1.Gaiella; b1.RB41; c1.硝化螺旋菌属; d1.土微菌属; e1.Iamia; f1.土壤红杆菌属; g1.芽球菌属; h1.玫瑰弯菌属; i1.假诺卡氏菌属; j1.Nordella; k1.鞘氨醇单胞菌; l1.Haliangium; m1.Variibacter; n1.慢生根瘤菌属; o1.红游动菌属; p1. Mycobacterium; q1.丝状细菌属; r1.Mesorhizobium; s1.Gemmatimonas; t1. Nocardioides; A1.被孢霉属; B1.子囊菌门古根菌属; C1.珊瑚菌属; D1.丝盖伞属; E1.青霉菌属; F1.腐质霉属; G1.外瓶柄霉属; H1.Pseudeurotium; I1.Tetracladium; J1.Dactylonectria; K1.角担菌属; L1.土赤壳属; M1.赤霉属; N1.湿伞属; O1.树粉孢属; P1.Halegrapha; Q1.Cadophora; R1.针层孔菌属; S1.Cookeina; T1.柄孢壳菌属图5 西北小檗生境土壤理化指标和细菌(A)、真菌(B)群落多样性的RDA分析a1. Gaiella; b1. RB41; c1. Nitrospira; d1. Pedomicrobium; e1. Iamia; f1. Solirubrobacter; g1. Blastococcus; h1. Roseiflexus; i1. Pseudonocardia; j1. Nordella; k1. Sphingomonas; l1. Haliangium; m1. Variibacter; n1. Bradyrhizobium; o1. Rhodoplanes; p1. Mycobacterium; q1. Candidatus_Alysiosphaera; r1. Mesorhizobium; s1. Gemmatimonas; t1. Nocardioides; A1. Mortierella; B1. Archaeorhizomyces; C1. Clavaria; D1. Inocybe; E1. Penicillium; F1. Humicola; G1. Exophiala; H1. Pseudeurotium; I1. Tetracladium; J1. Dactylonectria; K1. Ceratobasidium; L1. Ilyonectria; M1. Gibberella; N1. Hygrocybe; O1. Oidiodendron; P1. Halegrapha; Q1. Cadophora; R1. Phellinus; S1. Cookeina; T1. PodosporaFig.5 RDA of soil physical and chemical indexes and diversity of bacterial (A) and fungal (B) communities with B. vernae habitat
3 讨 论
3.1 西北小檗生境中土壤微生物的特征
从西北小檗生境中各采样点来看:土壤均呈弱碱性,土壤微生物中细菌OTU数目多于真菌,说明在本研究区域细菌的繁殖能力要强于真菌。各样点不同土层的细菌、真菌OTU数量不同。整体来看,各样点0~20 cm土层的细菌OTU数目较20~40 cm或40~60 cm的多,其中海东乐都1号样点的0~20 cm、40~60 cm土层及西宁大通样点的20~40 cm土层最多,玉树下拉秀样点0~20 cm、20~40 cm土层及海东乐都2样点40~60 cm土层最少。真菌OTU数目在各土层表现规律性不明显,黄南泽库样点的0~20 cm、40~60 cm土层及西宁大通20~40 cm土层最多,玉树勒巴沟样点0~20 cm土层、玉树下拉秀样点20~40 cm和海东乐都1号样点40~60 cm土层最少。海东乐都1号样点所处海拔位置低,年均温等生境条件均优于其他样点;玉树下拉秀样点所处海拔较高,多高寒草甸植被覆盖,生境条件较其他样点差。
西北小檗生境中土壤细菌组成包括放线菌门、变形菌门、芽单胞菌门、绿弯菌门、酸杆菌门、硝化螺旋菌门、拟杆菌门、厚壁菌门等,8个细菌门相对丰度较大,其相对丰度之和在所有土壤样品中占到土壤细菌总量的96.92%以上,说明其为优势细菌群。本研究区域6个采样点中,放线菌门、变形菌门的相对丰度较大,其中玉树下拉秀样点各土层的放线菌门相对丰度较大,海东乐都2号样点各土层的相对丰度最小;玉树勒巴沟样点各土层变形菌门相对丰度较大,玉树下拉秀样点的相对丰度最小。放线菌门作为土壤中一类重要的微生物菌群,对自然界的碳、氮物质循环有重要影响[37],相对丰度大则更能适应各种极端(如低温、厌氧及营养贫乏等)的生态环境[37];而变形菌门则具有较强的适应能力,包含多种代谢功能的种类,能适应玉树勒巴沟高寒碱性土壤的环境[35]。其他门类细菌在各采样点均有分布,只是比例有差异,说明在西北小檗生境土壤细菌特有性程度低。在属水平上,Gaiella和Iamia在玉树下拉秀样点的相对丰度最高,RB41和土微菌属在玉树勒巴沟样点相对丰度最高。可能由于西宁大通样点土壤中的硝态氮、铵态氮和碱解氮的含量均高于其他样点,而硝化螺旋菌属亦可作为硝化细菌,能将土壤中的亚硝酸盐氧化成硝酸盐,因此,硝化螺旋菌属和土壤红杆菌属在西宁大通样点的相对丰度较高。
本研究中土壤真菌在门水平上整体相对丰度最高的为子囊菌门,在属水平上存在未分类类群,说明在青海高原西北小檗生境土壤中具有发掘真菌新种的潜力。子囊菌门真菌在玉树下拉秀和玉树勒巴沟样点的相对丰度较其他4个样点的低,而担子菌门真菌则在各样点的相对丰度呈现出相反的趋势,且均表现出随着土层加深,其相对丰度逐渐增大。其原因可能是由于玉树下拉秀乡和玉树勒巴沟样点所处位置海拔高、温度低、土壤表层的有机质丰富,子囊菌门真菌的腐生菌对动植物残体进行的分解活动减慢,繁殖速度降低,因而导致该真菌相对丰度较低;而担子菌门的一些大型真菌对枯枝落叶和有机质具有较强的降解作用,由于高海拔样点土壤有机质含量较高,因而担子菌门的相对丰度较大。而在其他低海拔样点,由于环境条件、土壤理化性质及野生动物活动的差异,可能会影响土壤不同土层子囊菌门真菌的相对丰度,这与其他区域植物物种多样性、土壤肥力与真菌群落物种多样性正相关的研究结论具有相似性[39-41]。
在属水平上,古根菌属真菌的分布范围较广,其主要生长于土壤中植物根部的附近,在黄南泽库样点西北小檗生境中的20~40 cm和40~60 cm土层中相对丰度值较大,主要原因可能是因为该区域西北小檗的根系主要分布在深于20 cm的位置处,该属真菌可能与西北小檗植物根系存在某一种共生关系所致。两者的关系将成为本课题组今后继续研究的方向之一。珊瑚菌属真菌主要分布在林地土壤中,少数腐生于树木或其他植物残体上[42],在玉树勒巴沟样点20~40 cm和40~60 cm土层土壤中相对丰度较高的原因可能是与该区域处于自然保护区内林地有关,林木自然更新后,土壤中的枯枝落叶为该属真菌的繁殖提供了适宜的条件。被孢霉属真菌是一种森林树种的菌根真菌,对甾族化合物有生物转化作用,相关研究发现被孢霉属菌根真菌能有效促进铁皮石斛对矿质元素的吸收,并能与铁皮石斛形成良好的共生关系[43]。在西宁大通和海东乐都1号样点中0~20 cm、20~40 cm的土层中相对丰度较高,可能说明该属真菌在较低海拔范围内受到土壤理化性质的影响较大,并可能与部分生物物种有稳定的共生关系。西北小檗生境中真菌种类主要为子囊菌门和担子菌门类真菌,具体类别会因生境差异和土层不同而有差异,其相对丰度与周围的环境条件也可能存在一定的关系。
土壤微生物群落多样性除受生物性因素影响外,通常还受土壤理化因子、海拔等环境因素的驱动,真菌和细菌对不同环境因素的敏感性不同[44]。尤其是海拔、土壤化学性质对土壤表层(0~20 cm)微生物种类及数量影响程度较为显著[45-46]。海东乐都2号样点位置的海拔较玉树下拉秀样点低,海东乐都2号样点0~20 cm、20~40 cm土层和海东乐都1号样点0~20 cm、20~40 cm、40~60 cm土层的细菌群落多样性均高于玉树下拉秀样点相对应土层。
真菌和细菌代谢底物有所不同,真菌抵抗环境胁迫的能力比细菌强[47],其群落多样性也受到海拔和土壤理化性质的影响,但表现出的特性与细菌不同。本研究区域中,较高海拔位置的玉树下拉秀和玉树勒巴沟样点各土层的真菌多样性要低于其他低海拔位置的样点,这与Wang等[46]在林芝色季拉山对真菌、细菌和古菌丰度和多样性与海拔的关系的研究结论相似,说明西北小檗生境土壤中真菌群落的多样性会受到海拔因素的影响。西宁大通样点所处的生境条件较好,0~20 cm土层的速效磷、硝态氮等含量较高,而其0~20 cm、20~40 cm土层真菌群落的多样性均较其他样点相应土层高,可以说明土壤理化性质也能影响真菌群落的多样性。
3.2 海拔对西北小檗生境土壤理化性质的影响
在不同海拔位置的西北小檗生境采样点间,随着海拔的升高,生境中的各种生态环境条件也发生相应的变化(如:年均温逐渐降低,年均降水量及植被分布产生变化),土壤理化性质各指标数值也会发生变化,但随海拔变化的规律不明显。其中,玉树勒巴沟样点的土壤pH值较其他样点高,各样点间的差异不显著;海东乐都2号样点各土层的土壤有机质、速效钾、速效磷、碱解氮、铵态氮和硝态氮的数值均较其他样点高。各样点的不同土层间,随着土层深度增加,土壤pH逐渐增大,土壤有机质、速效钾、速效磷和硝态氮则成逐渐降低的趋势,铵态氮、碱解氮随土层深度变化的趋势不明显。由此还可以说明,土壤深度对土壤化学性质的影响程度明显要强于海拔因素的影响。海东乐都1号样点位于河滩地,为沙质土,因此与其他5个样点的土壤化学指标的数值差异较明显。
在不同土层中,由于受生物和非生物(如淋溶)因素的共同作用,土壤中氮、磷、钾等物质以不同的形式在不断进行交换,最终会导致土层间理化及生物学性质存在差异[48]。对于海拔对土壤理化性质影响的相关研究,目前在不同研究领域的结论均存在差异,不同土壤的理化性质会因研究区域、海拔范围、植被类型等因素之间的差异而呈现不同的规律[49]。
3.3 海拔对西北小檗生境中不同土层土壤微生物群落结构及多样性的影响
西北小檗生境不同土层土壤微生物细菌群落丰富度和多样性随海拔变化的趋势不一致。随着海拔升高,0~20 cm、40~60 cm土层的细菌群落丰富度及多样性呈现出先降低再升高再降低的趋势,20~40 cm土层的细菌群落丰富度及多样性则呈现出先升高后降低的趋势。说明随着海拔升高,年均温度降低[50],植被多样性发生变化,导致细菌群落的数量下降,温度降低有可能是导致细菌群落种类呈现递减变化的重要原因[51-52]。对于植物多样性与土壤微生物多样性的相关研究表明,植被是土壤微生物赖以生存的营养物质和能量来源,食物供应(植物)是决定生物多样性海拔分布趋势的关键因子[53],所以植被种类多样性与土壤微生物多样性呈显著正相关关系[54]。由于水比热容较大,临近水源可缩小不同海拔土壤间的温度差异,从而影响微生物的生态分布[55]。本研究中,在海拔升高的同时,植被种类的多样性和生物量会逐渐减少,但在不同研究区域的植被分布存在差异,在西宁大通和玉树勒巴沟样点出现拐点的原因可能是由于局部小环境的影响所致。
西北小檗生境中0~20 cm、20~40 cm土层土壤微生物真菌群落丰富度随着海拔的升高呈现出先升高再降低再升高的趋势,40~60 cm土层的变化趋势不明显;生境中0~20 cm、40~60 cm土层真菌群落多样性随海拔升高呈现先升高再降低的趋势,20~40 cm土层的变化趋势不明显。整体来看,玉树下拉秀和玉树勒巴沟样点所处的海拔位置较高,受温度、土壤理化性质等因素的共同影响,所以各土层真菌群落的丰富度和多样性较低;黄南泽库样点的土壤pH值较低,硝态氮含量较高,所以该样点各土层真菌群落的丰富性较高;西宁大通样点所处海拔位置较低,温度、土壤pH和养分情况有助于真菌群落繁衍,以表现出较高的真菌群落多样性。
综上,我们可以发现西北小檗生境中土壤微生物群落的多样性会受到地理距离和土壤属性的共同影响,这与以往对土壤微生物驱动因子的研究结果具有相似性[55-57]。
3.4 海拔对西北小檗次生代谢物含量和生境中土壤微生物影响
在高海拔地区,生态环境较为恶劣,植物体内次生代谢过程所对应的个体自我保护机制得以启动,对逆境的响应基因得以较大程度表达,以减少逆境对植物个体的伤害。部分土壤微生物如丛枝菌根真菌能够通过提高土壤蛋白酶、多酚氧化酶和脲酶的活性来改善土壤理化性质[58],通过促进植物水分和养分吸收利用,来提高寄主植物对温度胁迫的耐受性[59,60],同时还能够通过诱导植物防卫基因的表达,来提高植物对非生物逆境的抗性[19]。很显然,两者的协同作用有助于高海拔地区植物对非生物逆境的适应,以减少外界不利条件对植物体的伤害。
以往研究发现西北小檗各部位的次生代谢物盐酸小檗碱的含量随海拔升高呈现增加的趋势[3-4],而本研究发现土壤中湿伞属真菌的相对丰度值随海拔的变化呈现出与植物体内次生代谢物含量变化趋势一致的现象,因此,对于西北小檗植株内次生代谢物与生境中土壤微生物两者之间的具体关系研究将作为今后探究的方向。
4 结 论
西北小檗生境土壤中,细菌群落组成包括放线菌门、变形菌门、芽单胞菌门、绿弯菌门、酸杆菌门、硝化螺旋菌门、拟杆菌门、厚壁菌门等,真菌群落由子囊菌门、担子菌门等组成。
在其6个样点中,低海拔位置的海东乐都1号样点(hdld1)0~20 cm土层的细菌群落丰富性及多样性均最高,黄南泽库样点(hnzk)0~20 cm土层的真菌群落丰富性最高,西宁大通样点(xndt)0~20 cm土层的真菌群落多样性最高。随着海拔升高,西北小檗生境土壤0~20 cm、40~60 cm土层的细菌群落丰富度及多样性呈现出先降低再升高再降低的趋势,20~40 cm土层的细菌群落丰富度及多样性则呈现出先升高后降低的趋势;0~20 cm、20~40 cm土层土壤微生物真菌群落丰富度随着海拔的升高呈现出先升高再降低再升高的趋势,生境中0~20 cm、40~60 cm土层真菌群落多样性随海拔升高呈现先升高再降低的趋势,40~60 cm土层的真菌丰富度及20~40 cm土层的真菌多样性的变化趋势不明显。在同一样点不同土层,表层土壤的细菌群落丰富性和多样性均高于中、深层,真菌群落的丰富性和多样性渐变趋势则不明显;在不同样点其细菌、真菌的相似程度均较低。硝态氮、速效磷和速效钾对土壤微生物群落的影响较明显。同时还发现,土壤深度比海拔因素对土壤化学性质的影响程度要更明显。
本研究揭示了青海高原乡土树种西北小檗在不同海拔的生境中土壤微生物的群落结构及多样性的差异,为今后土壤微生物对西北小檗存活的维持机制的研究以及将乡土树种用作高海拔城镇绿化的先锋树种生态适应性研究提供理论指导,同时也可为三江源区高海拔城镇生态修复工作的顺利开展奠定一定的理论基础。
