基于ISSR与RAPD标记分析内蒙古赤芍的遗传多样性
2021-07-28杜亚楠孙淑英陈贵林
杜亚楠,张 敏,孙淑英*,陈贵林
(1 内蒙古大学 生命科学学院,呼和浩特 010070;2 内蒙古自治区中蒙药材规范化生产工程技术研究中心,呼和浩特 010070;3 牧草与特色作物生物学教育部重点实验室,呼和浩特 010070)
遗传多样性是揭示物种适应环境的指标,也是物种与生俱来的特性[1]。了解植物种群的遗传结构和变异程度,对于开展野生资源的保护和育种计划具有重要意义[2]。在用于遗传分析的分子工具中,随机扩增多态性DNA(RAPD)[3]和简单序列重复(ISSR)[4]标记与简单序列重复(SSR)、序列相关扩增多态性(SRAP)和目标起始密码子多态性(SCoT)等标记相比,具有节约成本、不需要序列信息、无需特定引物、操作简便快速等优点,被广泛应用于植物遗传多样性研究中[5-7]。单一分子标记会使各项遗传参数产生偏差,检测多态性信息少,不能全面揭示物种的遗传多样性[8]。ISSR可以扩增基因组的内含子区域[9],RAPD可以同时扩增大量位点[10],这两种分子标记的组合允许更高程度的基因组覆盖。目前,ISSR和RAPD两种分子标记结合广泛用于荔枝[11]、竹子[12]、红景天[13]、茴芹[14]、叶子花[15]及獐牙菜属[16]等植物的遗传变异、亲缘关系和遗传多样性研究中。
赤芍是中国常用的大宗药材,为毛茛科植物芍药 (PaeoniaelactifloraPall.) 或川赤芍 (PaeoniaveitchiiLynch) 的干燥根,具有清热凉血,散瘀止痛之功效[17]。中国赤芍广泛分布于内蒙古、黑龙江和河北等省(区),其中内蒙古赤芍产量占据国内外供应市场近三分之一的份额,为重要的主产区[18]。随着赤芍药材需求日益增加,野生赤芍资源经过半个世纪的无序采挖,特别是进入21世纪之后,已日趋枯竭,市场主要以栽培赤芍为主。但目前生产中赤芍种质混杂,来源不清,各地间盲目引种更加重了混杂程度,根本无法保证药材质量。为此,本研究从赤芍种群的遗传多样性角度解析其种群结构特征及亲缘关系,为赤芍的引种选育、优良种质挖掘和分子辅助育种提供理论依据。
1 材料和方法
1.1 实验材料
供试赤芍样本于2017年9月25日-10月8日分别采自内蒙古自治区、黑龙江省和吉林省等地,共计28个赤芍种群,包括12个野生种群和16个栽培种群。每个种群采集8株健康赤芍的根部组织,迅速装入密封袋中,用硅胶干燥,带回实验室用去离子水清洗干净并编号,放入-80 ℃冰箱储存。实验材料经内蒙古大学生命科学学院陈贵林教授鉴定为赤芍,样品采集地信息详见表1。
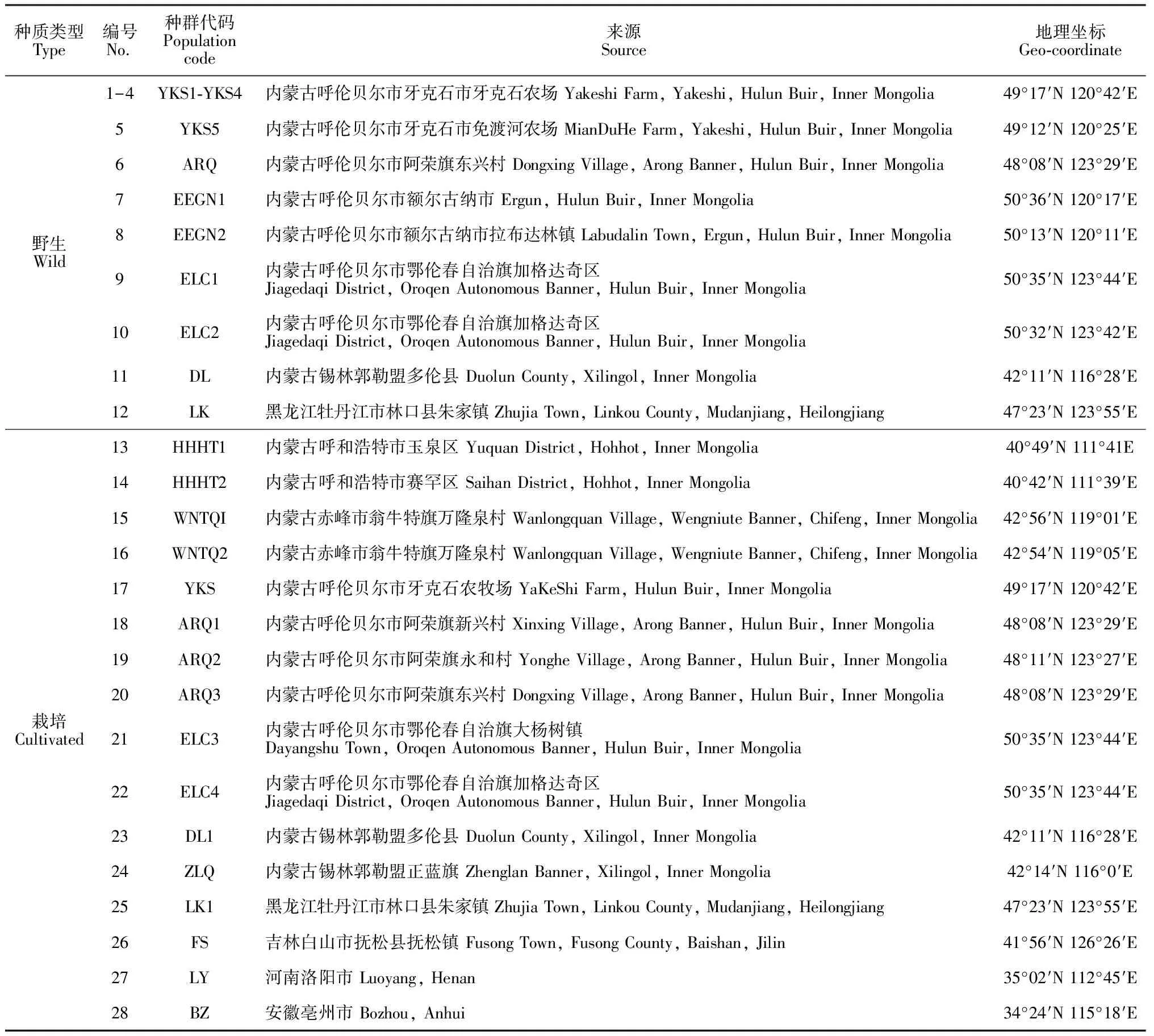
表1 赤芍种群采样点地理信息
1.2 方 法
1.2.1 基因组DNA提取与质量检测以单株赤芍的根组织样本为单位,使用植物基因组DNA提取试剂盒(Tiangen)提取28个种群224株赤芍样本的DNA。经1.3%的琼脂糖凝胶电泳和NanoDrop核酸蛋白测定仪检测DNA质量与浓度后,存于-20 ℃备用。
1.2.2 引物筛选与其检测本研究初步筛选的60条ISSR引物参照Zietkeiwitcz等[4]公布的序列,由上海生物工程技术公司合成。40条RAPD分子标记引物[19-20],由华大基因合成。用2个赤芍基因组DNA进行引物筛选,最后选取稳定、清晰和多态性条带丰富的14条ISSR引物和14条RAPD引物,并确定了其最佳退火温度,用于本实验研究。
ISSR分子标记扩增的方法是按照Liu等[21]方法进行,并做了一些小的修改。反应体系的总体积为25 μL,包含2 μL (20 ng/μL)DNA模板、1.5 μL(10 μmol/L)引物、9 μL ddH2O和12.5 μL 2×EsTaq Master Mix酶(TaKaRa)。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,退火复性45 s,72 ℃延伸1.5 min,循环35次;72 ℃延伸10 min,4 ℃保存。
RAPD分子标记PCR反应体系与循环参数参照来明达等[19]报道的方法进行。反应体系总体积为25 μL,包含2 μL DNA模板(20 ng/μL)、1.5 μL(10 μmol/L)引物、10 μL ddH2O和11.5 μL 2×EsTaq Master Mix酶(TaKaRa)。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,退火复性45 s,72 ℃延伸1.5 min,循环33次;72 ℃延伸7 min,4 ℃保存。1.3%琼脂糖凝胶观察扩增的PCR产物,通过凝胶成像系统拍照,记录结果。
1.3 数据统计与分析
将扩增产物进行拍照,人工读带统计,在凝胶的相同迁移位置上将有条带记为“0”,无条带记为“1”,输入到Excel中建立矩阵。利用PopGene32软件对由野生和栽培的种质组成的两组矩阵数据进行分组分析,计算多态性位点数(NPL)、多态性位点百分率(PPL)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(He)、Shannon’s多样性信息指数(I)、遗传分化系数(Gst)和基因流(Nm)等遗传系数;利用软件NTsys Version 2.1进行UPGMA聚类分析。
2 结果与分析
2.1 扩增结果多态性分析
14条ISSR引物共扩增得到257条清晰可重复条带,平均每条引物扩增出18.4条条带,多态性条带为251条,平均每条引物扩增的多态性条带为17.9条,平均多态性比率为97.8%。其中ISSR UBC835引物扩增的条带最多为25条,ISSR UBC860引物扩增的条带最少为14条。
14条RAPD引物共扩增出215条条带,平均每条引物扩增出15.4条带,多态性条带为209条,平均每条引物扩增的多态性条带为14.9条,平均多态性比率为97.2%。其中RAPD S43、RAPD S1089和RAPD S1110引物扩增的条带数最多为18条,RAPD S75和RAPD S1114引物扩增的条带最少为13条(表2)。两种标记扩增效率即多态带百分率数值相近,证明筛选的引物扩增条带清晰度和多态性较好,可用于本研究材料的遗传多样性分析。

表2 引物序列及扩增条带数
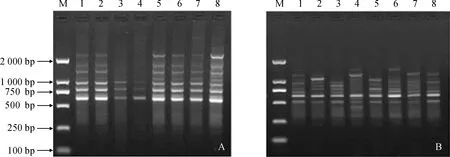
M.DL2000;1-8. 多伦(DL)种群8株植株编号图1 引物ISSR UBC807(A)和RAPD S428(B)对多伦(DL)种群的扩增M.DL2000;1-8. No. of DL population’s 8 samplesFig.1 Effect of primers ISSR UBC807 and RAPD S428 for amplification of Duolun (DL) population of Paeoniae Radix Rubra
ISSR引物UBC807和RAPD引物S428对DL种群的扩增结果如图1,扩增出的谱带稳定、清晰和多态性丰富,扩增片段长度约在 450~2 000 bp之间。由扩增结果发现,ISSR扩增出的条带清晰且多于RAPD,对赤芍具有更强的检测能力。
2.2 遗传多样性分析
根据ISSR、RAPD 两种分子标记得到的0/1矩阵,通过 PopGene32软件,假定遗传平衡分别得到28个种群的遗传多样性参数,具体数据见表3。在28个种群中,DL(内蒙古自治区锡林郭勒盟多伦县)种群各遗传参数最高,ELC3(内蒙古自治区呼伦贝尔市鄂伦春自治旗大杨树镇)种群最低。在野生种群中,DL种群遗传多样性水平仍然最高,对其生存的环境适应能力最强;而LK(黑龙江牡丹江市林口县朱家镇)种群的遗传多样性水平最低,对环境适应能力最弱。而在栽培种群中,YKS种群(内蒙古呼伦贝尔牙克石市农牧场)遗传多样性最高,ELC3种群最低。同时ISSR分子标记得出的多态性位点数、多态性条带百分率、Na、Ne、He、I等值均高于RAPD分子标记,在一定程度上表明样品数相同、引物数相同时,ISSR检测遗传多样性的能力较高,改进的ISSR可能是一种比RAPD更有效的研究赤芍植物系统发育的方法。
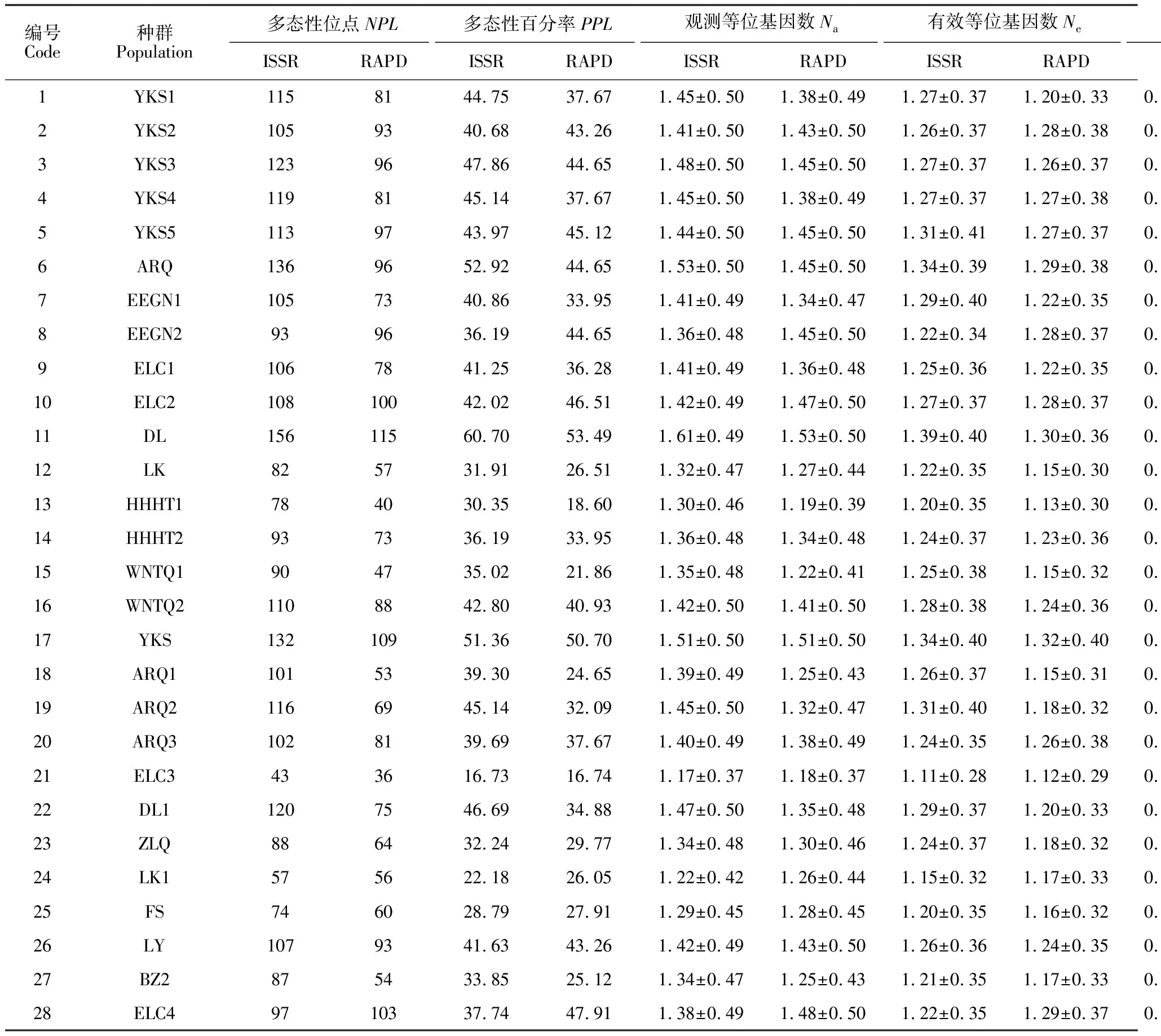
表3 28个赤芍种群的ISSR与RAPD遗传多样性参数分析
基于两种标记对赤芍群体遗传多样性结果的比较(表4),28个种群的多态性位点平均百分比分别为 39.57%和35.95%;Na平均值分别为1.40和0.36;He平均值分别为0.15和0.13;I平均值分别为 0.22和0.19,由此可见赤芍种群存在较高的遗传多样性。根据反映研究对象遗传多样性水平高低指标的I和He,野生种群各遗传多样性指数平均值均高于栽培种群,即野生赤芍种群的遗传多样性水平高于栽培赤芍种群。

表4 赤芍群体ISSR和RAPD遗传多样性结果比较
2.3 遗传分化分析
由表5可知,ISSR和RAPD得到28个赤芍种群的总遗传多样度(Ht)分别为0.32、0.27,种群内基因遗传样性(Hs)结果为0.15、0.12,那么群体之间的遗传多样性(Dst)大小为0.17、0.14。即遗传多样性在种群内占46%、47%,在种群间则为54%、53%,比较显示赤芍种群间的多样性水平大于种群内的。遗传分化系数是反映种群分化程度的指标,Gst值在0至0.05之间,表示分化程度较弱;Gst值在0.05至0.15之间代表中等分化程度;Gst值在0.15至0.25之间表示较大的分化程度;大于0.25表示分化程度极大[22],两种分子标记显示赤芍种群间的遗传分化程度较大, 且栽培赤芍种群间的遗传分化程度大于野生种群。基因流(Nm)指生物个体在迁移过程中致使基因从一个种群到另一个种群的过程,Nm在0.44~0.47<1,说明种间产生了明显的遗传分化,28个赤芍种群之间的基因流较为丰富。同时观察到野生种群比栽培种群Nm值高,且野生赤芍种群的遗传分化主要发生在种群内,这可能是由遗传漂变引起;而栽培赤芍种群之间的遗传分化较为明显,种群间的基因交流较少导致Nm值低。
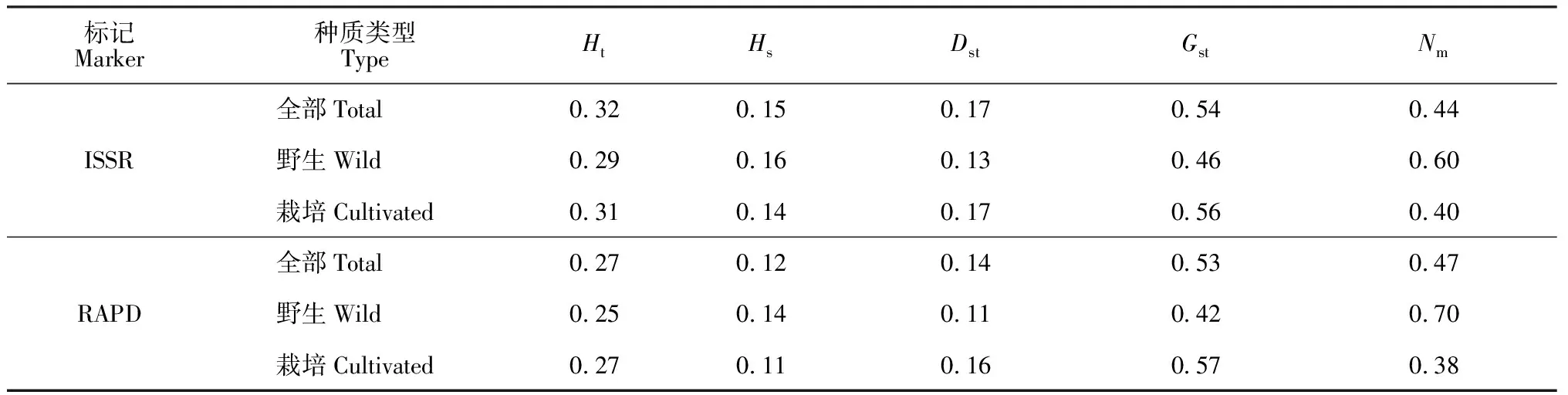
表5 基于ISSR和RAPD的赤芍种群的遗传分化分析
2.4 聚类分析
根据ISSR的扩增结果得出0/1矩阵,经过NTSYS2.10软件计算的遗传距离构建聚类分析图,遗传距离变化范围为0.115 1~0.343 8(图2,A),28个赤芍种群可约在遗传距离0.234处被分为5大类。第一类包括除了LK野生种群外的其余11个野生种群,还有YKS、ARQ1、ARQ2、WNTQ2和ZLQ 5个栽培种群组成;第二类包括LK、LK1和FS种群,这3个种群分别来自黑龙江省和吉林省;第三类只包括ELC3种群;第四类包括WNTQI、DL1、BZ、ELC4、LY、HHHT1、HHHT2种群;第五类只包括ARQ3种群。

种群编号同表1图2 基于ISSR (A)和RAPD (B)的UPGMA 聚类结果图The population codes are same as Table 1Fig.2 UPGMA dendrogram based on ISSR (A) and RAPD (B) markers
基于RAPD分子标记与ISSR方法得到的结果相似,遗传距离变化范围为0.095 5~0.286 2,在遗传距离0.179处同样将28个赤芍种群分为5类(图2,B)。第一类包括23个种群,其中包括了全部12个野生赤芍种群和大部分栽培赤芍种群,野生赤芍种群和栽培赤芍种群没有完全分开;第二类由ELC3种群单独聚为一类;第三类只有LK1种群;第四类HHHT1种群单独聚为一类;第五类由HHHT2和BZ2组成。
两种分子标记的聚类结果显示YKS、ARQ1、ARQ2、WNTQ2和ZLQ等5个栽培种群总是与野生种群聚在一类,说明这5个栽培赤芍种群与野生赤芍种群的亲缘关系较近;且均显示栽培赤芍种群ELC3是独立聚类的,该种群与其他栽培赤芍种群相比差异显著,亲缘关系较远,具有独特的遗传背景。ISSR结果中LK、LK1和FS种群聚为一类,这3个种群分别来自黑龙江省和吉林省,证明种质聚类与地理分布有一定的相关性。但不完全一致,RAPD聚类中同是栽培种的安徽亳州BZ和内蒙古呼和浩特HHHT2种质聚在一起,以及ISSR聚类结果中ELC1和WNNTQ1种群、RAPD聚类结果中EEGN2和ELC2种群也未完全分开,这可能存在人为引种等原因导致它们在遗传背景上相似。
3 讨 论
分子标记被认为是最可靠、最有力的种质资源鉴定手段[23]。不同分子标记的结合使用可以根据各自的特点检测基因组的不同部分,提高多态性位点的覆盖率和均匀度,弥补一种分子标记带来的局限性和弊端[24, 25]。在评价赶黄草[26]、野生艾蒿[27]和红花[28]种质遗传多样性的研究中发现多种分子标记技术的使用可以互相验证结果,从多方面、多角度地了解植物资源的遗传信息,有效地揭示种质之间的遗传多样性。近年来, 国内外学者对芍药属进行了大量的遗传多样性研究,主要是探讨牡丹的种间亲缘关系[29, 30]和观赏芍药的群体遗传关系[31-32],而关于药用芍药遗传结构的研究多集中于白芍[33-34]。内蒙古作为赤芍的道地产区,因其优越的自然地理条件及退耕还林政策,赤芍的蕴藏量十分丰富,目前对该地区赤芍道地药材的分子遗传研究鲜有报道。本研究应用ISSR和RAPD两种分子标记评估不同赤芍种群遗传多样性水平、遗传变异以及种群之间的亲缘关系,对于就地保护野生赤芍种质资源和内蒙古赤芍产业的发展具有重要意义。
在本研究中,ISSR和RAPD 两种分子标记分析均发现内蒙古锡林郭勒盟多伦县种群(DL)的赤芍遗传多样性水平最高,而近代以来一直推崇内蒙古多伦县所产的野生赤芍为最佳道地药材,使得多伦亦处于生产性赤芍资源濒危状态。因此,亟需就地建立自然保护区,制定赤芍资源保护策略,尽快开展优良种质基因库的保护、研究及科学引种工作。通过历代本草的记载发现,野生赤芍产区随着野生资源的枯竭逐渐北移,目前主产区已转至呼伦贝尔等地[35]。来自呼伦贝尔市的大部分赤芍野生种群具有较丰富的遗传多样性,是选育优良药用和观赏品种的物质基础;而栽培赤芍种群遗传多样性降低,可能是由于栽培赤芍所用繁殖材料主要取自野生资源并以分根的方式克隆繁殖,且药农多从经济价值角度出发,主观选择根较粗壮的植株种植,使得群体的种质趋于单一;另外在栽培种群引种驯化过程中,参与驯化的野生种群偏小影响其基因频率的变化,遗传多样性逐渐变窄。
两种标记的聚类结果虽都将野生种群聚在一类,但栽培赤芍种群和野生赤芍群体之间有所交叉,未完全分开,可能是由于栽培赤芍的种源多来源于野生种,且初期栽培种多用种苗和芽头无性繁殖[36]。在雪莲果遗传研究中认为,无性繁殖的营养性质会使其遗传变异性变低[37],使得栽培种与野生种之间的性状差异并不显著,因而难以按产地聚类。独自聚类的ELC3种群在所有种群中具有最低水平的遗传多样性,根据第四次中药资源普查了解到内蒙古鄂伦春自治旗(县)赤芍种植历史悠久,ELC3可能是在人工驯化过程中形成了独特的基因型种质,可作为优质赤芍新品种进行进一步培育。对药用植物而言,次生代谢物是临床疗效的物质基础,丰富的化学成分多样性使其具有更高的进化潜力和应用价值[38]。次生代谢物的合成和积累主要受内部遗传基础和外部环境因素的影响。因此,基于本研究基础,扩大采样区域,结合化学成分及环境因子对赤芍资源进行更加全面系统的分析和评价,以保存和挖掘优良的基因型和化学型,为赤芍原位保护、遗传改良和品种选育提供科学依据。
