酶抑制法快速检测牛奶中β-内酰胺酶抑制剂多残留
2021-07-28刘凤银王小鹏吴晓丹陈凤燕袁学文穆洪涛
刘凤银,李 滢,王小鹏,吴晓丹,陈凤燕,梁 岳,袁学文,穆洪涛,
(1.广东第二师范学院生物与食品工程学院,广东 广州 510303;2.广东省生物工程研究所,广州甘蔗糖业研究所,广东 广州 510316)
β-内酰胺酶抑制剂是一类小分子化合物,其能够与β-内酰胺类抗生素竞争性结合耐药菌产生的β-内酰胺酶,使酶失活,恢复细菌对β-内酰胺类抗生素的敏感性[1-4]。目前常见的β-内酰胺酶抑制剂有舒巴坦、克拉维酸、他唑巴坦和阿维巴坦,结构见图1。食品中残留的β-内酰胺酶抑制剂主要有两方面来源,一是内源性残留,在动物生产中,为提高抗生素的抗菌作用,β-内酰胺酶抑制剂常与β-内酰胺类抗生素联合使用,但由于不规范用药甚至滥用问题,导致奶及动物组织中β-内酰胺酶抑制剂残留[5-7];二是外源性添加,一些不法商家为掩盖奶中β-内酰胺类抗生素残留,加入β-内酰胺酶作为“解抗剂”,同时又加入β-内酰胺酶抑制剂以躲避β-内酰胺酶的检测,导致奶中β-内酰胺酶抑制剂残留;增大了奶及肉类的安全风险,对消费者身体健康造成威胁[8-9]。鉴于此,国内外均对β-内酰胺酶抑制剂制定了最高残留限量(maximum residue limit,MRL),欧洲医药评价局与我国农业部均规定牛、羊奶中克拉维酸的MRL为200 μg/kg[10-11]。

图1 4 种常见的β-内酰胺酶抑制剂化学结构式Fig.1 Chemical structures of four common β-lactamase inhibitors
目前对β-内酰胺酶抑制剂的检测方法主要有仪器分析法和酶抑制法。前者主要有高效液相色谱法[12-13]、液相色谱-串联质谱法[14-15]和毛细管电泳法[16]等,仪器分析法优点在于高准确性、高灵敏度,缺点在于设备昂贵、检测成本高,对从业人员的专业技术要求较高,无法满足快速、简便、大样本量筛查的检测需求。酶抑制法是基于待测物能够不可逆地抑制相应酶的活性,根据酶促反应强度的变化测定待测物的含量,具有灵敏度高、快速简便、成本低廉及易于基层推广的优点[17-18]。Uri等[19]首次基于克拉维酸能够不可逆地抑制β-内酰胺酶活性的原理,以肺炎克雷白氏菌的发酵液作为酶原,头孢硝噻吩作为显色底物,建立了一种酶抑制法检测克拉维酸。后续关于酶抑制法检测β-内酰胺酶抑制剂的少数研究报道,均基于类似原理。如戴西达等[20]将上述原理应用于微生物样品中克拉维酸的检测,筛选克拉维酸高产菌株。王斯文等[21]基于该原理,建立了一种β-内酰胺酶抑制剂高通量筛选模型,用于新药研发中药物的筛选。也有研究[22]将该原理应用于食品安全检测领域,检测牛奶样品中的舒巴坦残留,但报道未提供其他几种β-内酰胺酶抑制剂的交叉反应率数据,同时检测灵敏度较差,对舒巴坦的检出限为5 mg/L。目前,我国仅规定了动物源食品中克拉维酸残留量检测的出入境检验检疫行业标准(液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法)[23],尚未出台其他3 种β-内酰胺酶抑制剂的标准检测方法。因此,开发准确灵敏、快速简便、便于基层推广的检测方法,丰富食品中β速内酰胺酶抑制剂残留的监督检测手段,十分必要。
β-内酰胺酶能够催化头孢硝噻吩(淡黄色,λmax=390 nm)水解生成红棕色化合物(在本实验体系中,其λmax为488 nm);β-内酰胺酶抑制剂能够与β-内酰胺酶产生稳定结合,导致其酶活性丧失,抑制上述显色反应;在一定浓度范围内,反应体系的显色强度与β-内酰胺酶抑制剂浓度呈负相关。本研究基于该原理,建立一种酶抑制法,可实现牛奶中的β-内酰胺酶抑制剂多残留快速高通量筛查。
1 材料与方法
1.1 材料与试剂
牛奶样品购于本地超市。
舒巴坦(纯度98%) 北京百灵威科技有限公司;克拉维酸钾(纯度95%)、他唑巴坦(纯度>98%)北京伊诺凯科技有限公司;阿维巴坦钠(纯度99%)上海博湖生物科技有限公司;β-内酰胺酶(TEM-1,酶活力3×106U/mL)、头孢硝噻吩、二甲基亚砜(≥99.9%)、甲酸(色谱纯)、乙腈(色谱纯) 上海阿拉丁生化科技股份有限公司;96 孔微孔板 厦门怡佳美实验器材有限公司;其他试剂均为国产分析纯;实验用水为超纯水。
1.2 仪器与设备
SP-Max 2300A2光吸收型全波长酶标仪 上海闪谱生物科技有限公司;PHS-3C精密酸度计 上海雷磁仪电科学仪器股份有限公司;LC-20ADXR液相色谱仪(配AB SCIEX API4000三重四极杆质谱仪) 日本岛津公司。
1.3 方法
1.3.1 实验步骤
配制0.2 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS),用于β-内酰胺酶、β-内酰胺酶抑制剂的溶解与稀释;头孢硝噻吩用少量二甲基亚砜溶解后,用PBS稀释至合适浓度。以96 孔微孔板为反应容器,实验步骤如下:向β-内酰胺酶溶液中加入β-内酰胺酶抑制剂标准溶液混匀进行孵育,再加入头孢硝噻吩溶液进行水解显色,采用酶标仪测定各孔吸光度A488nm。上述β-内酰胺酶、β-内酰胺酶抑制剂、头孢硝噻吩溶液的体积比为1∶8∶1。实验全程避光反应。
1.3.2 4 种β-内酰胺酶抑制剂的检测灵敏度初步评价
以0.2 mol/L pH 7.0 PBS分别配制β-内酰胺酶溶液(3×104U/mL),头孢硝噻吩溶液(0.5 mg/mL),舒巴坦、克拉维酸钾、他唑巴坦和阿维巴坦钠系列浓度梯度标准溶液。按照1.3.1节方法,37 ℃水浴孵育30 min、显色1 h进行实验。分别以β-内酰胺酶抑制剂浓度的对数值为横坐标X,吸光度为纵坐标Y,绘制其抑制曲线,计算半抑制浓度IC50,以此初步评价方法对4 种β-内酰胺酶抑制剂的检测灵敏度。选择IC50最大的β-内酰胺酶抑制剂进行后续工作条件优化。
1.3.3 最佳工作条件的优化
采用单因素试验,考察缓冲体系pH值(4.0、5.0、6.0、7.0、8.0、9.0)、反应温度(4、25、37、50 ℃)、β-内酰胺酶活力(3.33×103、1.0×104、3.0×104、9.0×104、2.7×105U/mL)、头孢硝噻吩质量浓度(0.125、0.25、0.5、1、2 mg/mL)、孵育时间(15、30、60 min)和显色时间(20、40、60、80 min)等理化因素对检测灵敏度的影响。绘制抑制曲线,从曲线拟合度、最大吸光度Amax、IC50和Amax/IC50等方面综合评价抑制曲线的性能。
1.3.4 样品前处理
准确称取2.00 g牛奶样品于离心管中,加入2 mL乙腈涡旋混匀,4 000 r/min离心5 min;取出上清液转移至另一离心管中,加入2 mL正己烷,剧烈涡旋1 min,4 000 r/min离心5 min,收集下层清液,重复2 次;将下层清液40 ℃水浴下用氮气吹干。加入2 mL PBS超声复溶,过0.22 μm水相滤膜,用于酶抑制法检测;加入2 mL 10%乙腈水超声复溶,过0.22 μm有机相滤膜,用于LC-MS/MS法检测。
1.3.5 标准曲线的建立与基质效应的消除
取不含有舒巴坦、克拉维酸钾、他唑巴坦、阿维巴坦钠和β-内酰胺酶的空白牛奶样品(β-内酰胺酶抑制剂含量经LC-MS/MS法测定;β-内酰胺酶残留量按照NY/T 3313—2018《生牛乳中β-内酰胺酶的测定》中第二法胶体金快速试纸条法测定),按照1.3.4节步骤,进行样品前处理,制备空白基质溶液。用PBS和空白基质溶液分别溶解稀释4 种β-内酰胺酶抑制剂标准品,配制一系列浓度梯度的溶剂标准溶液和基质匹配标准溶液。在上述确定的最佳工作条件下进行酶抑制法实验,分别绘制其溶剂标准曲线和基质匹配标准曲线。计算出4 种β-内酰胺酶抑制剂的检出限(IC10)、IC50和线性范围(IC20~IC80)。
1.3.6 牛奶中残留β-内酰胺酶对检测结果的影响
向空白基质溶液中加入β-内酰胺酶,使其终浓度为0、40、200 U/mL,分别以其作为稀释液,配制一系列浓度梯度的舒巴坦基质匹配标准溶液,进行实验,分别绘制在基质溶液含有不同β-内酰胺酶浓度水平下的基质匹配标准曲线。考察牛奶中残留β-内酰胺酶对检测结果的影响。
1.3.7 添加回收率的测定
向空白牛奶样品中,分别添加舒巴坦(200、1 000、10 000 μg/kg)、克拉维酸钾(100、200、300 μg/kg)、他唑巴坦(20、50、100 μg/kg)、阿维巴坦钠(20、50、100 μg/kg),经样品前处理后进行添加回收实验。酶抑制法采用基质匹配外标法定量,计算回收率。同时采用LC-MS/MS法进行测定,比对测定结果。
1.3.8 LC-MS/MS法确证
色谱条件:色谱柱为Kinetex XB-C18(2.1 mm×100 mm,2.6 μm);柱温40 ℃;进样量5 μL;流速0.4 mL/min;流动相及梯度:A为0.1%甲酸溶液,B为乙腈,0~1.0 min,95% A,5% B;1.0~1.5 min,95%~5% A,5%~95% B;1.5~4.0 min,5% A,95% B;4.0~4.1 min,5%~95% A,95%~5% B;4.1~5 min,95% A,5% B。
质谱条件:电离源为大气压电喷雾离子源负离子模式;毛细管电压4.50 kV;源温度550 ℃;脱溶剂气温度550 ℃;脱溶剂气流量500 μL/min;锥孔反吹气流量200 μL/min;电子倍增管电压2 200 V;检测方式:多反应监测模式;特征离子见表1。

表1 主要质谱参数Table 1 Main MS/MS parameters
1.4 数据处理
采用Excel 2010进行数据分析、表格绘制;采用Origin 2019绘制抑制曲线;采用ChemDraw pro 18绘制化学结构式。
2 结果与分析
2.1 4 种β-内酰胺酶抑制剂的检测灵敏度初步评价
4 种β-内酰胺酶抑制剂均能抑制β-内酰胺酶活性,但抑制能力不同[24-25],使得方法对其检测灵敏度亦不同。实验结果显示,在初始条件下,舒巴坦、克拉维酸钾、他唑巴坦和阿维巴坦钠的IC50分别为1 190.72、107.34、17.06 μg/kg和22.17 μg/kg,其中他唑巴坦的灵敏度最高,舒巴坦的灵敏度最低。为实现对4 种β-内酰胺酶抑制剂的同时检测,尽可能地提高对舒巴坦的检测灵敏度,实验选择舒巴坦作为基准分析物,进行后续工作条件优化。
2.2 最佳工作条件的优化
选择曲线拟合度好、Amax较大、IC50较小、Amax/IC50较大的反应条件作为最佳工作条件。得最佳工作条件如下:缓冲体系pH 7.0、反应温度37 ℃、β-内酰胺酶活力3.0×104U/mL、头孢硝噻吩质量浓度1 mg/mL、孵育时间30 min、显色时间1 h。
2.3 样品前处理方法的选择
本实验旨在建立牛奶中4 种β-内酰胺酶抑制剂的多残留检测方法,为使在实际样品检测中对4 种目标分析物均能获得较好的回收率,故从4 种化合物的结构性质、实际样品的基质成分出发,筛选合适的样品前处理方法。牛奶中含有大量的蛋白质和脂肪,对其进行除蛋白、除脂处理是检测前的必要步骤。常用的蛋白质沉淀剂有强酸沉淀剂,如高氯酸、三氯乙酸、浓硝酸等,但舒巴坦、克拉维酸和他唑巴坦均含有一个四元环结构,在强酸条件下易分解[26],实验测试了即使使用有效沉淀牛奶蛋白的最低质量浓度三氯乙酸(在牛奶体系中约18 g/L)进行处理,克拉维酸的回收率亦不足60%;亚铁氢化钾和乙酸锌无机沉淀剂,郑小严等[27]研究发现该沉淀剂虽能较好地沉淀牛奶中的蛋白质,但会造成舒巴坦、克拉维酸和他唑巴坦的严重损失;对有机溶剂沉淀剂如乙腈、甲醇、乙醇、丙酮等,实验比对了有效沉淀牛奶蛋白所需的4 种有机溶剂的量,其与牛奶的体积比分别为乙腈1∶1、甲醇4∶1、乙醇3∶1、丙酮1.5∶1,乙腈的使用量最小,故实验采用乙腈作蛋白沉淀剂。克拉维酸的热稳定差,实验发现氮吹时水浴温度超过50 ℃,克拉维酸便有明显降解,故牛奶样品经乙腈沉淀蛋白、正己烷除脂后,40 ℃水浴下氮气吹干,用相应的溶剂复溶备用。
2.4 标准曲线的建立与基质效应的消除
基质成分引起的基质效应严重干扰了待测物定量分析的准确性,尤其是针对有复杂成分组成的食品样品中的待测物检测,仅依赖简单的前处理手段,难以很好地消除基质的干扰。目前已有多种消除基质效应的方法报道,其中基质匹配标准溶液法采用不含目标待测物的空白样品提取液配制标准溶液,建立校正曲线,可同等程度地补偿样品基质对待测物的检测干扰,是一种有效的、国际上常用的基质效应消除方法[28-29]。
分别绘制4 种β-内酰胺酶抑制剂的溶剂标准曲线和基质匹配标准曲线,如图2所示。计算不同标准曲线下4 种β-内酰胺酶抑制剂的IC50、检出限和线性范围,见表2。虽采用溶剂标准曲线计算时,4 种β-内酰胺酶抑制剂均取得了更低的IC50和检出限,但从图2可知,在目前的样品前处理条件下,仍存在一定的基质干扰,尤其在中低浓度范围内,有明显的基质抑制效应,以溶剂标准曲线进行实际样品检测时,会影响定量的准确性。故实验采用基质匹配标准曲线作为标准工作曲线,以消除基质效应对结果准确性的影响,使结果更可靠。
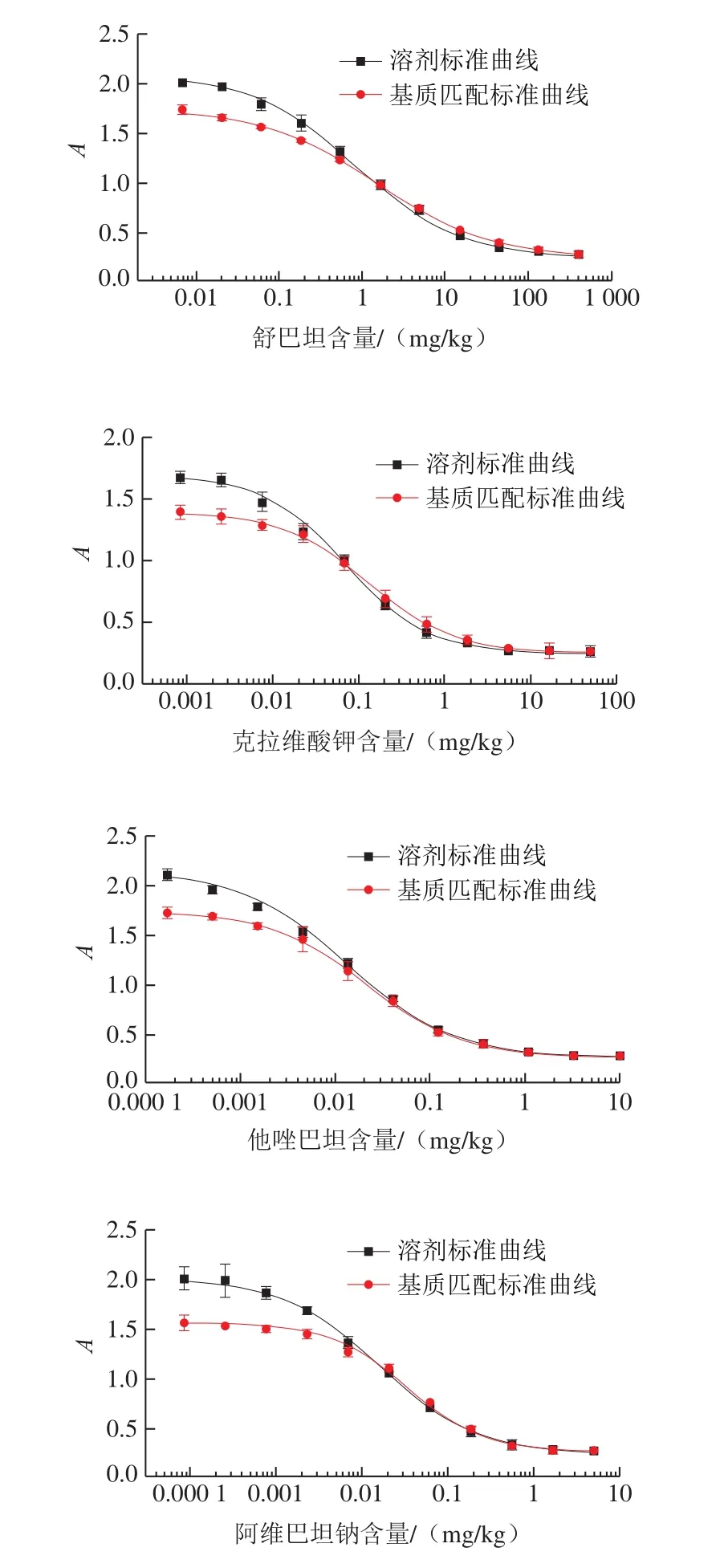
图2 4 种β-内酰胺酶抑制剂的溶剂标准曲线及基质匹配标准曲线Fig.2 Solvent standard curves and matrix-matched standard curves for four β-lactamase inhibitors
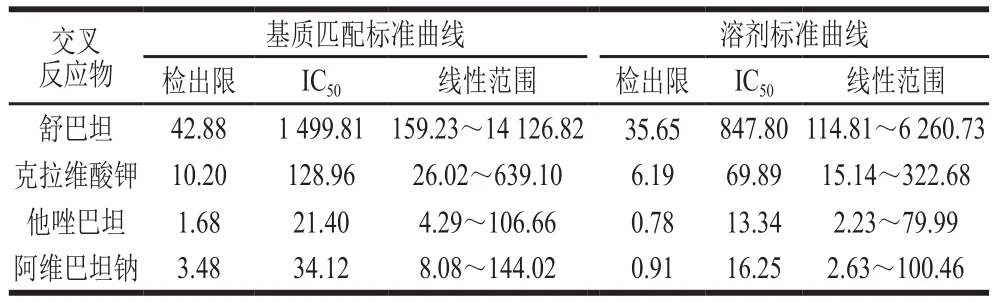
表2 不同标准曲线下4 种β-内酰胺酶抑制剂的检出限、IC50及线性范围比较Table 2 Comparison of detection limit, IC50 and linear range for four β-lactamase inhibitors with different standard curves μg/kg
以基质匹配标准曲线作为标准工作曲线,方法对牛奶中舒巴坦、克拉维酸钾、他唑巴坦和阿维巴坦钠的检出限分别为42.88、10.20、1.68 μg/kg和3.48 μg/kg。以克拉维酸的MRL(200 μg/kg)为参考,本方法满足牛奶中4 种β-内酰胺酶抑制剂残留的检测灵敏度需求。
2.5 牛奶中残留β-内酰胺酶对检测结果的影响
基于β-内酰胺酶催化头孢硝噻吩水解显色的原理,通过测定显色的强度,间接测定牛奶中β-内酰胺酶抑制剂的含量。若牛奶本身残留β-内酰胺酶过多,可能会对检测结果产生影响。研究表明,目前牛奶中β-内酰胺酶的残留量大多在4 U/mL以下[30]。实验向空白基质溶液中加入了其10、50 倍浓度水平即β-内酰胺酶含量为40、200 U/mL,考察其对检测结果的影响,结果见图3。与不含β-内酰胺酶的基质匹配标准曲线相比,当含量为40 U/mL时,其曲线与前者基本完全重叠,说明该浓度水平下的β-内酰胺酶对实验结果无影响;当含量为200 U/mL时,在舒巴坦中低质量浓度范围内,其曲线偏离前者明显,吸光度较大,易导致假阳性。综上,β-内酰胺酶残留量不超过40 U/mL时,对检测结果的准确性无影响。考虑到在样品前处理过程中,会导致牛奶中残留的部分β-内酰胺酶被去除或失活,方法对牛奶中残留的β-内酰胺酶的实际耐受水平应该更高。
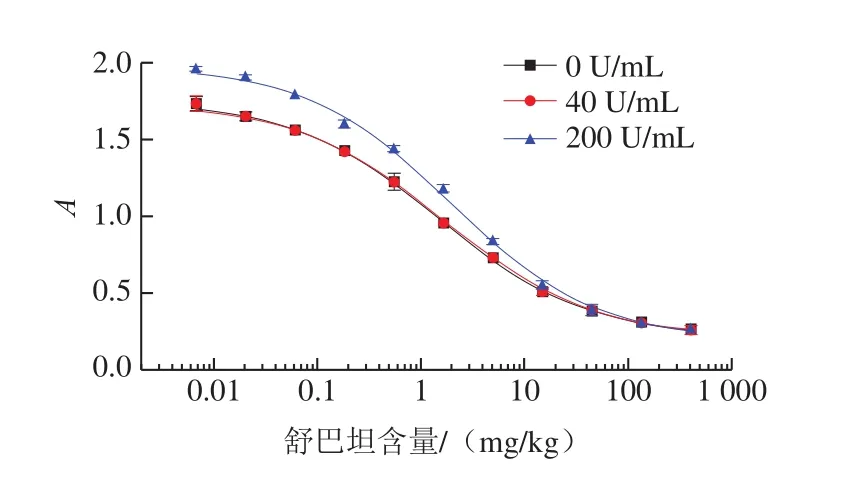
图3 牛奶中残留β-内酰胺酶对检测结果的影响Fig.3 Effect of β-lactamase residue levels in milk on results of detection
2.6 添加回收率实验
以被测化合物定量离子信噪比为3,确定LC-MS/MS法对舒巴坦、克拉维酸钾、他唑巴坦和阿维巴坦钠的检出限分别0.53、4.45、0.28 μg/kg和0.28 μg/kg;4 种β-内酰胺酶抑制剂在10~500 μg/kg质量浓度范围内,均呈良好的线性关系。目前我国农业部仅制定了奶中克拉维酸的MRL。针对制定有MRL的克拉维酸钾,实验参照EN 2002/657/EC标准[31],以0.5、1.0、1.5 倍MRL三个水平进行添加回收试验;对于未制定MRL的舒巴坦、他唑巴坦和阿维巴坦钠3 种β-内酰胺酶抑制剂,在其酶抑制法(基质匹配标准曲线)的线性范围内选取高、中、低3 个水平进行添加。4 种β-内酰胺酶抑制剂的添加量均处于酶抑制法的线性范围内,且高于LC-MS/MS法的线性范围下限;当添加量高于LC-MS/MS法的线性范围上限时,对样品提取液进行适当稀释,使其浓度处于线性范围内。对空白牛奶样品进行添加回收实验,比对酶抑制法和LC-MS/MS法的测定结果。从表3可知,采用基质匹配外标法定量时,酶抑制法具有良好的回收率和重复性,平均回收率在80.43%~115.87%之间,变异系数在1.63%~10.14%之间。LC-MS/MS法的平均回收率在80.08%~104.35%之间,变异系数在0.60%~5.32%之间。两种方法检测结果的相关性见图4,相关系数R2为0.982,酶抑制法与LC-MS/MS法测定结果一致性良好,说明本实验建立的酶抑制法具有良好的准确性。

表3 酶抑制法、LC-MS/MS法对4 种β-内酰胺酶抑制剂的加标回收率测定结果(n=3)Table 3 Recoveries of four β-lactamase inhibitors from spiked milk samples by the enzyme inhibition method and LC-MS/MS (n= 3)
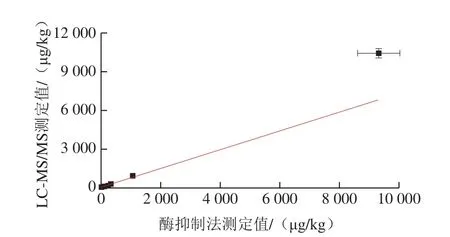
图4 酶抑制法和LC-MS/MS测定结果相关性曲线Fig.4 Correlation of LC-MS/MS results with enzyme inhibition results
3 结 论
4 种β-内酰胺酶抑制剂除阿维巴坦之外,均含有四元内酰胺环,在强酸强碱条件下易降解。以牛奶为筛查对象,为使酶抑制法对每种目标分析物均能获得较为理想的添加回收率,实验对比了多种样品前处理方法,发现以乙腈沉淀蛋白、正己烷除脂、氮气吹干后用等量PBS复溶,采用基质匹配标准溶液法消除基质干扰,4 种β-内酰胺酶抑制剂均获得了良好的添加回收率。
对于牛奶中可能残留的β-内酰胺酶,推测其可能会对检测结果产生影响[32],并给出了去除牛奶中微量β-内酰胺酶的方法,即采用强酸(盐酸和硝酸的混合液)沉淀蛋白后,再用氢氧化钠调节pH值至中性。考虑到克拉维酸的酸敏感性,该样品前处理方式并不适用于β-内酰胺酶抑制剂的多残留检测。同时本研究发现,在该酶抑制法体系下,牛奶中少量的β-内酰胺酶残留(不超过40 U/mL),不会影响检测结果的准确性。
实验基于酶抑制法原理,建立了一种β-内酰胺酶抑制剂多残留快速检测方法,最佳工作条件为测定波长488 nm、缓冲体系pH 7.0、反应温度37 ℃、β-内酰胺酶活力3.0×104U/mL、头孢硝噻吩质量浓度1 mg/mL、孵育时间30 min和显色时间1 h。在牛奶样品中,对舒巴坦、克拉维酸钾、他唑巴坦和阿维巴坦钠的检出限分别为42.88、10.20、1.68 μg/kg和3.48 μg/kg,满足牛奶样品的检测灵敏度要求。相较于目前报道的β-内酰胺酶抑制剂单残留快速检测方法,如戴西达等[20]建立的克拉维酸单残留检测法、沙芳芳等[7]建立的舒巴坦ELISA法,该酶抑制法能够在一次分析实验中,同时筛查4 种β-内酰胺酶抑制剂,在分析通量、成本和实用性方面,具有突出优势。实验丰富了β-内酰胺酶抑制剂的检测方法,对牛奶中β-内酰胺酶抑制剂残留标准检测方法的建立提供参考。
