基于氮稳定同位素比例质谱和液相色谱-高分辨质谱的有机番茄鉴别
2021-07-29王世成李国琛高凝轩王颜红
王世成,李国琛,王 莹,李 波,高凝轩,孙 辞,宋 阳,王颜红
(中国科学院沈阳应用生态研究所,辽宁省农产品环境与质量安全控制工程技术研究中心,辽宁 沈阳 110016)
近年来,农业生产从数量满足型向质量需求型转变,环境友好型的循环农业也日益凸显优势。随着生活水平的提高,消费者需求也逐渐从传统食品升级为绿色食品、有机食品。有机食品在生产过程中拒绝使用化学性肥料和农药,因而具有较高的安全性和经济价值。受利益驱使,一些不法商家随意标注“有机”字样,假冒“有机食品”坑害消费者。欧洲议会“公共卫生和食品安全委员会”将有机食品列为10 个风险较高的掺假食品的第3位[1]。因此,鉴别有机产品的真实性对于保障消费者安全和市场诚信,保护消费者和有机品牌的经济利益至关重要。
在对有机与非有机种植模式的农产品鉴定研究中,有近红外光谱[2]、高效液相色谱[3-4]和氮同位素比例质谱[1,5]等技术得到应用,但仅通过一种检测手段或只对单一目标物检测的技术很难满足鉴别需求,将光谱、色谱以及质谱结合的组学及化学计量学分析技术已逐渐成为研究热点[6]。
有机食品是指根据有机农业生产的规范生产加工并经过认证的农产品和加工品。有机食品禁用化肥,允许施用有机肥,土壤有机肥的施用是种植业有机产品生产的主要控制要素[7]。研究表明[8-10],化学肥料中δ15N的丰度变化范围小,平均值为0.2‰,而有机肥料中δ15N的丰度变化范围大,平均值为8.5‰,有机肥中15N同位素丰度高于化肥中15N丰度。有机模式种植的农产品主要施用有机肥,不施用化肥,因此致使农产品中氮同位素比值(δ15N)存在差异,通常表现为有机产品中δ15N高于施用化肥的普通产品。农产品中δ15N丰度依次为施用有机肥>不施肥(土壤内源氮)>施用化学合成氮肥[11]。对有机番茄的化学成分研究表明[12-13],有机番茄中山柰酚、槲皮素等类黄酮化合物高于普通番茄,且有机种植的番茄中的类黄酮含量随种植时间延长而增加,而传统种植的类黄酮含量并无显著差异。因此,利用氮稳定同位素结合化学成分的变化,可以甄别有机食品与普通食品。本实验对有机和普通种植番茄的稳定同位素比值特征与化学组成成分进行对比研究。
1 材料与方法
1.1 材料与试剂
番茄:番茄样品共计94 个,包括宝石、大红、3944、安哥拉等大果番茄品种,其中有机番茄样品50 个,普通番茄样品44 个。采集于2017年6月至10月期间。地点分别位于辽宁沈阳新民、沈阳法库、江苏南京、山东潍坊、四川西昌的有机番茄及附近的普通番茄生产基地,其中有机番茄采自当地按有机种植方式生产的有机农场或企业。每个产地样品的采摘方式为随机选择10 个有机种植模式的番茄植株和普通种植模式的番茄植株,在植株的不同部位采摘成熟度一致的果实。为增大采集样品数量,每株植株随机摘取4~6 枚果实,所摘取的番茄大小均匀,具有代表性。每个植株的番茄为1 组。样品的来源及相关信息见表1。

表1 有机与普通番茄样品的产地来源Table 1 Geographical origins of organic and common tomato samples tested in this study
甲醇、乙腈(均为色谱级) 德国默克公司;乙醇、甲酸(均为色谱级) 天津市科密欧化学试剂有限公司;超纯水经Millipore超纯水系统纯化。
1.2 仪器与设备
HPLC-Q Exactive高效液相色谱-四极杆-静电场轨道阱高分辨质谱(high performance liquid chromatographyhigh resolution mass spectrometry,HPLC-HRMS)联用仪美国Thermo Scientific公司;Deltaplus XP稳定同位素比例质谱(isotope ratio mass spectrometry,IRMS)仪、Flash EA1112元素分析仪、ConFlo III元素分析仪-IRMS连续流接口 美国Thermo-Finnigan公司;SQP电子天平赛多利科学仪器(北京)有限公司;KQ-250B型超声波清洗器 昆山市超声仪器有限公司;TTL-DC氮吹仪II型 北京同泰联科技发展有限公司;CT15RE冷冻离心机 日本日立公司。
1.3 方法
1.3.1 样品的制备
采集获得的番茄样品洗净切片,混匀后,用匀浆机打碎,冷冻干燥成粉末,过20 目筛放于-80 ℃备用。
1.3.2 HPLC-HRMS分析
冻干后的样品,称量约150 mg,加入3 mL水-乙醇(1∶4,V/V),超声30 min后,4 000 r/min离心15 min,取2 mL上清液于氮气流下挥发(45 ℃)至近干。残渣加水-甲醇(1∶4,V/V)2 mL进行复溶,超声30 min,4 ℃、14 000 r/min离心15 min,过0.22 μm滤膜,分取1.5 mL上清液于液相进样瓶中,进行分析。
1.3.3 氮同位素比值测定
冻干后的样品,分别称量约2 mg,并用锡杯包裹压实,利用元素分析仪-同位素比值质谱仪测定稳定氮同位素比值。每份样品重复3 次,并根据下式计算δ15N值[14-17]:

式中:(15N/14N)样品为样品稳定氮同位素比值;(15N/14N)标准为标准物质稳定氮同位素比值。
1.3.4 液相色谱条件
采用Waters Atlantis T3色谱柱(2.1 mm×150 mm,3 μm);流动相为0.1%甲酸-乙腈溶液(A)和0.1%甲酸溶液(B);流速0.3 mL/min;柱温45 ℃;梯度洗脱条件:0~0.5 min,5% A,95% B;0.5~5 min,5%~30% A,95%~70% B;5~9.5 min,30%~90% A,70%~10% B;9.5~9.75 min,90%~5% A,10%~95% B;9.75~12 min,5% A,95% B。进样体积5 μL。
1.3.5 高分辨质谱条件
电喷雾离子源;喷雾电压3.2 kV;蒸汽温度350 ℃;离子传输管温度320 ℃;鞘气流速35 arb;辅助气流速15 arb;Full MS-ddMS2扫描模式,Full MS质量扫描范围m/z100~900,一级分辨率70 000,二级分辨率17 500。
1.3.6 同位素比值测试条件
元素分析系统氧化柱填料Cr2O3/Co3O4,温度为960 ℃,还原柱填料为高纯Cu/CuO,温度为640 ℃,载气He流量为90~100 mL/min,氧喷条件为175 mL/min。
1.4 数据处理
HPLC-HRMS数据采用Thermo Scientific公司的Xcalibur4.0数据软件进行原始数据采集。Compound Discover软件(version 3.0, Thermo Scientific)对总离子流图中的色谱峰进行时间和峰对齐校正、滤噪,数据处理分析,与数据库进行计算匹配。处理结果导出样品名称、保留时间、分子式、分子质量、质荷比以及对应的离子峰面积强度组成的数据集。主要参数设置如下:保留时间范围为1~12 min;质荷比范围为m/z100~900;偏差为5×10-6;信噪比为3;保留时间漂移值为0.2 min。得到的峰面积利用SIMCA-P 11.5软件(Umetrics, Umea, Sweden)进行化学计量学分析。采用主成分分析(principal component analysis,PCA)非监督分析方法进行探索性数据分析,实现样本间分析联系的可视化。使用SIMCA-P剔除异常值样品,使用有监督的偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)方法对样本及已确定的类别进行建模[18-22]。采用多变量和单变量分析选择法选定差异显著的变量,筛选出统计学意义显著的化合物[23-26]。化合物的初步鉴定是在准确的物质组成基础上进行,从精确质量数、同位素组成及分布与预测分子式的吻合度、一级质谱/二级质谱碎片和数据库匹配等方面进行推测。
IRMS数据利用SPSS 19.0软件进行统计分析,并利用Excel和Origin 8.5软件进行绘图统计处理。
2 结果与分析
2.1 稳定同位素比值分析
2.1.1 有机与普通番茄稳定氮同位素比值的差异分析
利用元素分析仪-IRMS测得不同地区50 种有机种植番茄样品以及44 种普通种植番茄样品,由图1A可以看出,有机番茄δ15N值的中位值在8.68‰左右,而普通方式种植的番茄δ15N值的中位值则为3.61‰,有机番茄氮同位素比值明显高于普通番茄。有机番茄的肥料主要为有机肥,普通番茄主要施用化肥。有机肥以畜禽粪便、动植物残体等富含有机质的副产品资源为主要原料,Peterson等[10]研究发现,植物氮源主要来自于土壤中动植物腐烂物质及动物排泄物。由于15N与14N在生物体内反应所需能量不同,反应速率存在差异,造成15N在生物体内产生富集。因而有机肥15N丰度高于化肥,有机肥中高含量的15N使有机作物果实中15N比例增高[8,11]。

图1 所有样品(A)及不同产地来源(B)的有机与普通番茄稳定氮同位素比值Fig.1 Stable nitrogen isotopic ratios of organic and common tomato samples (A) and samples from different geographical origins (B)
所有有机和普通番茄稳定同位素比值在一定范围内互有重叠(图1A),但按4 个地区分组比较发现,同一地区所产有机番茄的δ15N均高于普通番茄,并且存在显著差异(P<0.01),且无重叠(图1B)。因此,可以通过比较同一地区番茄的δ15N初步判断是否为有机番茄。进一步比较有机番茄和普通番茄种植土壤的同位素比值发现,除四川西昌外,其他4 个地区的有机番茄土壤的δ15N值也均高于普通土壤,多年有机种植模式下土壤中氮同位素比值有增加的趋势。但统计分析发现除四川土壤外,其他地区的有机和普通土壤二者无显著差异(图2)。

图2 土壤及对应番茄稳定氮同位素比值Fig.2 Sable nitrogen isotope ratios of soil and corresponding tomatoes
2.1.2 番茄与对应的土壤氮同位素变化特征
番茄与对应土壤的δ15N值对比发现,除辽宁一个产地(法库)外,其他4 个产地有机番茄的氮同位素比值均高于对应的土壤同位素比值(图2);除山东外,普通番茄δ15N值均低于对应的土壤(图2),在土壤氮源中δ15N丰度差异不显著的情况下,施用外源肥料后,有机番茄主要吸收有机肥中的高δ15N的有效氮,导致有机番茄中δ15N高于土壤的δ15N,普通番茄吸收无机肥的低δ15N有效氮,导致普通番茄的同位素比值低于土壤同位素比值[8]。
2.2 液相色谱高分辨质谱分析番茄化学组成成分
2.2.1 液相色谱分析结果
分别采集番茄样品的HPLC-HRMS正离子和负离子模式的总离子流色谱图。图3为具有代表性的有机番茄样品正离子模式指纹图谱。在正离子模式下共有约25 个明显可见的色谱峰,而在负离子模式下,样品出峰较少,在扣除试剂空白后,仅有5 个明显的色谱峰存在。

图3 番茄样品的HPLC-HRMS总离子流色谱图(正离子模式)Fig.3 HPLC-HRMS total ion current chromatogram of tomato samples (in the positive ion mode)
2.2.2 液相色谱-高分辨质谱的多元统计判别分析
94 个样品的色谱峰面积经SIMCA-P软件剔除异常值样品,获得符合要求的样品91 个,随机取56 个作为训练集,其中有机样品28 个,普通样品28 个,35 个作为验证集样品,其中有机样品20 个,普通样品15 个。
应用Compound Discover软件,对色谱峰进行峰对齐、保留时间校正和滤噪处理后,提取其中的所有质谱信息。使用软件的化合物筛查过滤模式,提取化合物峰面积大于105,且60%以上样品都有响应的化合物组成成分,提取其中的875 个化合物的峰面积数据。采用SIMCA-P软件进行PCA和PLS-DA,PCA不能将样品很好分开,采用PLS-DA提取3 个PC,模型解释的训练集累计贡献率(R2Y)达到0.915(通常R2越接近1,模型越良好),模型交叉验证对训练集预测的累计贡献率(Q2)为0.539(通常Q2>0.5表明模型对新数据的预测能力良好)。采用Permutation校验方法[21]验证模型是否存在过拟合现象(图4),通过200 次迭代的排列测试,模型结果显示Q2点散射回归线与垂直轴的截距小于零,说明PLS-DA模型验证结果良好,数据模型拟合成功,模型可靠。建立的模型能够实现2 组样本完全分离,模型的总预测正确率为92.3%(表2)。

图4 PLS-DA模型的200 次permutation校验结果Fig.4 Results of verification of PLS-DA model with 200 permutation tests

表2 模型对有机和普通番茄的判定结果Table 2 Results of the model for organic and common tomatoes
2.2.3 有机番茄和普通番茄组成成分的单变量差异性分析
采用Compound Discover软件,同2.2.1节处理,对番茄样品的HPLC-HRMS组间数据峰面积均值进行比对,形成单变量统计分析结果的火山图(图5)。图中框图标注区域为有机番茄和普通番茄单变量统计差异显著(P<0.05),并且有机番茄相比于普通番茄(普通/有机),面积比值增加(log2fold change<0.5)或降低(log2fold change>2)的特征化合物,共有18 个,这些化合物成分在有机和普通番茄中存在较大差异,需进一步确证。

图5 不同化合物的有机与普通番茄组间的火山图Fig.5 Volcano plots showing differential compounds between organic and common tomatoes
2.2.4δ15N与HPLC-HRMS组合的化学计量学判别分析
为了提高模型的预测能力,将δ15N数据与875 个色谱峰数据合并形成新的数据集,采用SIMCA-P软件进行PLS-DA,提取3 个PC,模型解释的训练集累计贡献率(R2Y)达到0.918,交叉验证模型预测的训练集累计贡献率(Q2)为0.559,模型预测的正确率为93.4%(表2)。与δ15N变量加入前相比,信息提取率、预测能力和准确率均有一定提高。前3 个PC的得分图上,2 组样本实现了完全分离(图6a)。在前2 个PC的载荷图(图6b)中,距离原点最远的变量为318.07和δ15N,说明这2 个指标对判定有机番茄的贡献最大,其次为分子质量192.03、208.15、274.19、159.07、609.39、305.27、453.29 Da等变量,也有可能成为有机和普通番茄产生差异的主要标志化合物。

图6 有机和普通番茄的得分图(a)及载荷图(b)Fig.6 Score plot (a) and loading plot (b) for organic and common tomatoes
2.2.5 特征变量因子筛查与确证分析
将SIMCA-P软件多变量处理结果与Compound Discover软件单变量分析的结果相结合,进一步筛选特征化合物,以更全面阐明有机和普通样品之间的差异化合物成分。单变量处理的组间存在显著差异(P<0.05)的219 个变量中,满足多变量处理变量重要性投影(variable importance in projection,VIP)大于1.0的变量153 个,其中VIP值大于1.5的变量53 个,这53 个化合物可能成为有机番茄和普通番茄具有显著差异的特征化合物。这些化合物与采用Compound Discover处理的火山图结果(图5)中的18 个化合物中有14 个一致,这14 个成分中有9 个化合物在有机番茄中含量低于普通番茄,有5 个高于普通番茄,说明通过简单的化合物峰面积比较可初步发现存在含量差异的化合物。
针对筛选出的除δ15N以外的152 个变量,通过精确分子质量、二级质谱分析,并检索mzclound、chemspider、massbank、KEGG等数据库,结合文献[27-31],初步确定mzclound数据库匹配度大于70%,在有机与普通番茄中存在差异的13 个化合物,见表3。在这些化合物中,主要为有机酸、黄酮类化合物,这两类化合物是番茄中的主要抗氧化成分。与普通番茄组相比较,有机番茄中的小分子有机酸含量降低,黄酮类化合物槲皮素-3-O-三糖苷的含量增加。这与已有研究结果基本一致,环境胁迫可激活番茄植株体内苯丙醇类化合物的生物合成,有机处理的番茄中类黄酮含量随种植年限增加而增加,而传统处理的类黄酮含量并无显著差异[5,12]。
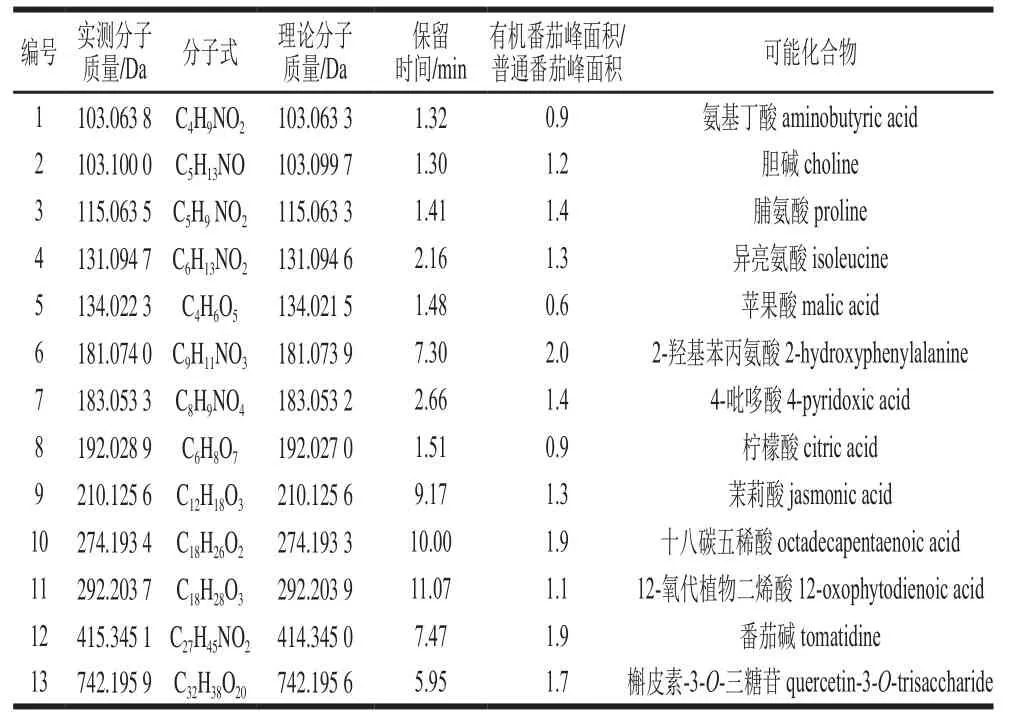
表3 初步确定两组间差异显著的化合物信息Table 3 Information about significantly differential compounds between organic and common tomatoes
3 结 论
本实验采用IRMS和HPLC-HRMS分析技术,借助PLS-DA技术建立一种有机番茄鉴别方法。有机和普通种植方式所生产的番茄,其果实中稳定氮同位素比值差异显著。可结合地区特征,通过稳定氮同位素比值大小在一定程度上判定样品是否为有机番茄。为进一步提高判别效果,将液相色谱高分辨质谱分析数据与稳定碳同位素比值相结合,构建了有机番茄判别模型,筛查出特征变量因子,包括稳定氮同位素比值,50多个可能的化学成分,鉴定出其中的13 个化合物,可作为有机和普通番茄区别的特征成分。所建立的模型对有机番茄的判别正确率为93.4%,基本可以满足有机番茄判别的需要。对有机产品的判定,稳定氮同位素差异分析更为简洁方便,但由于有机与普通产品的稳定氮同位素比值界限时有重叠,给判定增加了不确定性,因此应该进一步结合液相色谱-串联质谱的组学技术,提高判别的可靠性。
猜你喜欢
杂志排行
食品科学的其它文章
- 气相色谱-负化学源电离-质谱法测定蔬菜中氟虫腈及其代谢物残留
- 甲烷氧化菌素-纳米金修饰金电极溶出伏安法对Cu2+的检测
- 脂质去除分散固相萃取-气相色谱-串联质谱测定鸡蛋中62 种农药残留
- 咪鲜胺及其代谢物2,4,6-三氯苯酚在金柑防腐保鲜贮藏中的残留动态及风险评估
- QuEChERS-高效液相色谱-串联质谱法测定稻田水产品中氟虫腈及其代谢物残留
- Analysis of Acetanilide Herbicide Residues in Adzuki Beans(Vigna angularis) by Aqueous Two-Phase Extraction Coupled with High Performance Liquid Chromatography
