改善烟叶品质微生物的筛选及其作用效果研究
2021-07-28于少藤毛淑蕊胡安妥陆兆新朱怀远孔梁宇别小妹
于少藤,毛淑蕊,胡安妥,陆兆新,朱怀远,孔梁宇,别小妹*
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.湖南省益阳市烟草专卖局,湖南 益阳 413000;3.江苏中烟工业有限责任公司,江苏 南京 210019)
烟草是我国重要的经济作物之一,其种植面积、总产量、卷烟产量及销售量均居世界首位[1]。烟叶的品质与其自身含有的许多大分子物质有密切的关系[2],如蛋白质、碳水化合物在高温燃烧过程中转化产生稠环芳烃、自由基和氮亚硝胺等有害的化合物,不仅对卷烟的品质有巨大的影响,而且还会危害人体健康[3]。随着人们健康意识不断增强,越来越多的消费者更愿意吸食无毒、安全的烟草制品。因此,烟草行业需要采用行之有效的方法使烟草制品中的有害大分子化合物的含量向有利的方向发展,进而提高烟草制品质量和安全性[4]。
烟叶发酵是烟草行业用来提高烟叶质量的主要加工手段,也是卷烟加工的重要步骤[5]。研究发现,烟叶表面聚集着大量的种类丰富的微生物,而且这些微生物在烟草发酵过程中起着重要作用[6]。高品质的烟叶表面微生物的数量庞大,种类繁多,它们在生长发育的同时能够合成分泌多种胞外降解酶,这些酶可以加快果胶、纤维素、蛋白质和木质素等物质的降解,从而转化为一些有利于提高烟草品质和安全性的小分子化合物,最终改变烟草的品质[7-9]。人工添加有益微生物在烟叶加工中的作用为可缩短发酵和醇化时间以及改善烟叶品质。如庹有朋等[10]筛选得到22株菌株用于烟叶发酵,发现发酵7个月就可达到现有发酵技术发酵3年的效果,并起到了增香提质的作用。王充等[11]利用造纸法再造烟叶浓缩液微生物,在30 ℃条件下振荡发酵72 h,可明显提高再造烟叶的香气量,改善舒适度。陈小敏[12]从晾晒烟叶表面分离出一些产酶微生物并制成微生物制剂,发现其可明显提高烟叶的吸食性。
为了获得可同时降解烟叶中多种大分子化合物的菌株,本研究从不同产地、不同品种的烟叶中分离细菌,并对其产酶条件及作用效果进行研究,以期为微生物发酵烟叶提供新的理论基础。
1 材料与方法
1.1 试验材料
1.1.1 烟叶用于菌株筛选的4种烟叶分别采自重庆彭水(2018年,编号A)、陕西商洛(2016年,编号B)、贵州毕节大方(2018年,编号C)、云南临沧(2016年,编号D),由江苏中烟工业有限责任公司提供。
1.1.2 主要试剂酪素购自北京酷来搏科技有限公司;D-半乳糖醛酸购自上海源叶生物科技有限公司;木质素购自上海麦克林生化科技有限公司;其他试剂均购自国药集团化学试剂有限公司。所有试剂均为分析纯。
1.1.3 培养基淀粉培养基:可溶性淀粉20.0 g,蛋白胨10.0 g,牛肉膏5.0 g,NaCl 5.0 g,1 000 mL去离子水,pH(7.0~7.2),115 ℃灭菌30 min。羧甲基纤维素钠液体培养基:羧甲基纤维素钠10 g,(NH4)2SO44.0 g,蛋白胨1.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,琼脂20 g,1 000 mL去离子水,115 ℃灭菌30 min。苯胺蓝培养基:LB培养基中加入18 g·L-1琼脂,1 g·L-1苯胺蓝。酪蛋白培养基:酪素5 g,牛肉膏3 g,蛋白胨10 g,NaCl 10 g,琼脂15 g,1 000 mL去离子水,pH(7.0~7.5),121 ℃高压灭菌30 min。果胶培养基:果胶5.0 g,MgSO4·7H2O 2.0 g,K2HPO41.0 g,NH4Cl 0.4 g,FeSO40.01 g,1 000 mL去离子水,调pH值至7.0,121 ℃灭菌30 min。LB培养基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂18 g,1 000 mL去离子水,121 ℃灭菌30 min。
1.2 试验方法
1.2.1 烟叶中细菌的分离取适量烟叶样品于三角瓶中,然后加入适量的无菌生理盐水,将三角瓶放于摇床中,调节温度至30 ℃,转速为180 r·min-1,振荡培养30 min得到菌悬液。取1 mL菌悬液加入9 mL的灭菌生理盐水进行稀释,得到10-1的稀释液,并逐步稀释得到10-2、10-3、10-4的稀释液。将不同浓度的稀释液涂布于LB平板,置于37 ℃培养箱中培养48 h(每个浓度梯度设置3个平行),观察菌落的生长情况,挑选不同菌落形态的菌株进行分离纯化。
1.2.2 细菌降解能力的检测将上述分离出的细菌划线于LB平板上培养出单菌落,挑取单菌落分别点接在淀粉、纤维素、木质素、蛋白质及果胶筛选固体培养基上,通过观察菌落周围是否有透明圈的产生判断细菌是否降解相应大分子。综合上述结果挑选出可同时降解多种成分的细菌并保存。
1.2.3 种子液及粗酶液的制备将初筛得到的细菌接种于LB液体培养基中(调节D600为0.1),摇床温度及转速分别为37 ℃和180 r·min-1,培养12 h后获得种子液;将种子液以1%(体积分数)的接种量接入100 mL的LB液体培养基中,相同条件下培养菌株48 h得到发酵液。取适量发酵液在4 ℃、8 000 r·min-1条件下离心10 min得到上清液,即为粗酶液。
1.2.4 细菌酶活性的测定淀粉酶、果胶酶和纤维素酶活性测定采用DNS法[13],蛋白酶活性测定采用福林酚法[14],木质素过氧化物酶(LiP)和锰过氧化物酶(MnP)活性测定采用付丽等[15]的方法。根据初筛菌株的各种降解酶活性高低进行菌株复筛,选择6种降解酶的酶活性均处于中高水平的菌株yc10进行后续产酶条件优化及作用效果研究。
1.2.5 菌株的鉴定将菌株yc10接种于 LB 培养基上,待菌落长出后,对其进行形态学观察,同时对菌株进行革兰氏染色[16],在光学显微镜下观察菌体的形态特征。采用水煮法提取菌株的DNA。
以菌株yc10的DNA为模板,使用通用引物27F(AGAGTTTGATCCTGGCTCAG)及1429R(GGTTACCTTGTTACGACTT)扩增其16S rDNA片段[17]。PCR反应体系(25 μL):2×TaqMaster Mix 10 μL,上、下游引物各 1 μL,DNA模板2 μL,无菌水补足至25 μL。PCR反应条件:94 ℃ 10 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,共30个循环;72 ℃ 10 min。PCR产物送生工生物工程(上海)股份有限公司进行测序,在NCBI基因库中进行菌株的同源性比对并构建系统发育树,结合形态学观察、革兰氏染色结果及16S rDNA测序结果对菌株yc10进行鉴定。
1.2.6 产酶条件优化1)发酵时间的优化。以1%的接种量将菌株yc10的种子液接种于100 mL的液体培养基中,37 ℃、180 r·min-1条件下培养菌株,于12、24、36、48和60 h时取样,每组培养时间设置3个平行。按照取样时间取适量的发酵液,低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株的最佳发酵时间。
2)发酵温度的优化。以1%的接种量将菌株yc10的种子液接种于100 mL的液体培养基中,培养温度设置为30、33、37、40和43 ℃,每个温度设置3个平行,摇床转速为180 r·min-1条件下培养菌株至最佳发酵时间,取发酵液低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株产酶的最佳培养温度。
3)pH值的优化。使用pH电子显示计测定LB液体培养基pH值,并用1 mol·L-1HCl和1 mol·L-1NaOH调整pH值为5、6、7、8和9,以1%的接种量将菌株yc10的种子液接种于100 mL的LB液体培养基中,每个pH设置3个平行,调节摇床温度为最适的发酵温度,180 r·min-1条件下培养菌株至最佳发酵时间,取发酵液低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株产酶的最佳发酵pH值。
4)接种量的优化。将菌株yc10的种子液按照体积分数2%、4%、6%、8%、10%的接种量接种于100 mL的液体培养基中,每个接种量设置3个平行,调节体系为最佳发酵pH值,调节摇床温度为最适的发酵温度,180 r·min-1条件下将菌株培养至最佳发酵时间,取发酵液低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株产酶的最佳接种量。
5)装液量的优化。将菌株yc10的种子液按最佳接种量分别接种于60、80、100、120和140 mL的培养基中,每个处理设置3个平行,调节体系为最佳发酵pH值,调节摇床温度为最适的发酵温度,180 r·min-1条件下将菌株培养至最佳发酵时间,取发酵液低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株产酶的最佳装液量。
6)摇床转速的优化。将菌株yc10的种子液按照最佳接种量接种于最适装液量的培养基中,调节体系为最佳发酵pH值,分别设置摇床转速为140、160、180、200和220 r·min-1,每个处理设置3个平行,设置摇床温度为最佳培养温度,将菌株培养至最佳发酵时间,取发酵液低温离心获得粗酶液,测定粗酶液中酶活性,得出菌株产酶的最佳转速。
1.2.7 菌株yc10发酵液对烟叶中大分子化合物降解的效果将菌株yc10的种子液按照最佳产酶条件培养以获得发酵液,称取100 g烟叶,将30 mL发酵液均匀喷洒在烟叶表面,空白对照组仅喷洒LB液体培养基而不接种菌株。将烟叶放在37 ℃、65%湿度的恒温恒湿箱中发酵48 h,发酵结束后将烟叶烘干粉碎,测定发酵前、后烟叶中大分子化合物的含量变化。烟叶中淀粉含量采用碘显色法测定[18],纤维素含量测定采用安玉民等[19]的方法,木质素含量测定采用木质素含量试剂盒测定(索莱宝科技有限公司),蛋白质含量测定采用王万能等[20]的方法,果胶含量测定采用果胶含量试剂盒测定(索莱宝科技有限公司)。
1.2.8 烟叶中香气成分的测定将发酵前、后的烟叶A样品送杭州研趣信息技术有限公司,使用固相微萃取气质联用仪(岛津,GCMS-QP2010 SE)进行香气成分的测定。
2 结果与分析
2.1 菌株的分离与筛选
从4种烟叶样品中分离出87株细菌,将分离出的细菌接种到不同种类的特定选择性培养基中,测定细菌对淀粉、纤维素、木质素、蛋白质和果胶的降解能力,以菌株可同时降解物质种类的多少作为筛选指标,共筛选出9株细菌可以同时降解烟叶中的淀粉、纤维素、木质素、蛋白质和果胶,分别为yc7、yc9、yc11、yc2、yc10、yc8、fc3、d11、X2。
对9株细菌所产生的6种降解酶活性进行测定,结果(图1)显示,不同细菌所产酶的酶活性没有明显的规律。由于菌株yc10的6种降解酶的酶活性均处于中高水平,所以选择菌株yc10进行后续试验。

图1 不同菌株产生的6种酶的酶活性Fig.1 Enzyme activity of 6 enzymes produced by different strainsLiP:木质素过氧化物酶Lignin peroxidase;MnP:锰过氧化物酶Mn-dependent peroxidase.下同。The same as follows.
2.2 菌株的鉴定
2.2.1 形态学观察菌株yc10可以在LB培养基上良好生长,且菌落呈淡黄色圆形,不透明,边缘光滑,表面有褶皱。革兰氏染色结果显示yc10是革兰氏阴性杆菌。
2.2.2 分子生物学鉴定提取菌株yc10的基因组DNA,使用通用引物扩增16S rDNA序列后送生工生物工程(上海)股份有限公司进行测序,测序结果采用NCBI网站的BLAST进行比对,用MEGA 7.0软件建立菌株的系统发育树(图2)。菌株yc10与Pseudomonasgessardii(CIP 105469)的同源性达到99.4%,确定菌株yc10为盖氏假单胞菌(Pseudomonasgessardii)。

图2 基于菌株yc10的16S rDNA测序结果构建的系统发育树Fig.2 Phylogenetic tree constructed based on 16S rDNA sequencing results of strain yc10
2.3 菌株的产酶条件优化
2.3.1 发酵时间优化如图3所示:当发酵时间为12~36 h时,菌株yc10的淀粉酶、纤维素酶、果胶酶和木质素过氧化物酶(LiP)活性随着发酵时间的延长而升高并达到最大值,最大酶活性分别为2.68、2.90、217.67 U·mL-1和23.71 U·L-1;当发酵时间继续延长,各降解酶的活性逐渐降低。当发酵时间在12~24 h时,菌株yc10的锰过氧化物酶(MnP)和蛋白酶活性随着发酵时间的延长而升高并达到最大值,最大酶活性分别为30.05 U·L-1和12.06 U·mL-1。菌株yc10产生各种酶的酶活性随着发酵时间的延长均呈先升高后下降的趋势,这可能是菌体需要消耗营养物质来保证自身的生长繁殖和代谢活动,随时间延长,营养物质含量降低而代谢产物大量积累,抑制了菌体的生长和代谢。综合考虑,菌株yc10产酶的最佳发酵时间为36 h。

图3 不同发酵时间对菌株yc10降解酶活性的影响Fig.3 Effects of different fermentation time on degrading enzyme activity of strain yc10不同字母表示差异显著(P<0.05)。下同。Different letters indicate significant difference at 0.05 level. The same as follows.
2.3.2 发酵温度优化如图4所示:菌株yc10的淀粉酶、纤维素酶、蛋白酶和果胶酶活性在发酵温度为37 ℃时达到最大值,分别为2.92、2.77、12.08和230.63 U·mL-1,当发酵温度继续升高时,上述降解酶的活性逐渐降低。菌株yc10的 LiP和MnP活性分别在40 ℃和33 ℃达到最大值。较低的培养温度会影响菌体的生长,使其达不到旺盛生长阶段,从而使菌株yc10的产酶减少;而温度过高,菌体的生长速度过快会加速营养物质的消耗,使菌体过早衰亡,从而影响菌株产酶。综合考虑,选择37 ℃为菌株产酶的最佳发酵温度。

图4 不同发酵温度对菌株yc10降解酶活性的影响Fig.4 Effects of fermentation temperatures on degrading enzyme activity of strain yc10
2.3.3 培养基pH值的优化如图5所示:随着培养基pH值的升高,菌株yc10产生的各种降解酶的活性都呈先升高后降低的趋势。淀粉酶、纤维素酶和MnP活性在pH值为7时达到最大值,分别为2.91、2.75 U·mL-1和24.88 U·L-1,而蛋白酶和果胶酶活性在pH值为8时达到最大值,分别为17.02和259.13 U·mL-1,LiP活性在pH值为6时达到最大值37.48 U·L-1。过高或过低的pH值都会对菌株的生长产生抑制作用,不利于菌株代谢产物的积累。综合考虑,菌株产酶的最佳pH值为7。

图5 不同pH值对菌株yc10降解酶活性的影响Fig.5 Effect of different pH value on degrading enzyme activity of strain yc10
2.3.4 接种量的优化如图6所示:随接种量的增加,菌株yc10的6种降解酶活性都呈先升高后降低的趋势,淀粉酶、纤维素酶、MnP和果胶酶的活性在接种量为6%时达到最大值,LiP活性在接种量为8%时达到最大值,蛋白酶活性在接种量为4%时达到最大值。当菌株的接种量过高时,会导致生物量迅速增长,培养基中的营养成分消耗过快不利于菌株细胞内各种酶的合成;当接种量过低时,菌体生长缓慢,产酶也较少。综合考虑,菌株产酶的最佳接种量为6%。

图6 不同接种量对菌株yc10降解酶活性的影响Fig.6 Effects of different inoculation amounts on degrading enzyme activity of strain yc10
2.3.5 装液量的优化如图7所示:随着装液量的增加,菌株yc10的各降解酶活性均呈先升高后下降的趋势。菌株yc10的淀粉酶、纤维素酶、蛋白酶和果胶酶的活性均在装液量为80 mL时达到最大值,而LiP和MnP活性则在装液量为100 mL时达到最大值。当培养基装液量过低时,培养基中的营养物质不足以支撑菌株的生长发育,使菌株产酶减少;当培养基装液量过多时,使菌株生长环境中的溶氧量不足,也会阻碍细菌的代谢活动,导致菌株产酶减少。综合考虑,菌株yc10产酶的最佳培养基装液量为80 mL。
2.3.6 摇床转速的优化如图8所示:随着摇床转速的增加,6种降解酶的活性均呈先增加后降低的趋势。菌株yc10的淀粉酶活性在转速为160 r·min-1时达到最大值,纤维素酶、MnP和果胶酶的活性均在转速为200 r·min-1时达到最大值,而LiP和蛋白酶的活性在转速为180 r·min-1时达到最大值。综合考虑,菌株产酶的最佳摇床转速为200 r·min-1。

图8 不同转速对菌株yc10降解酶活性的影响Fig.8 Effects of different rotation speeds on degrading enzyme activity of strain yc10
2.3.7 最佳产酶条件通过对菌株yc10的产酶条件进行优化,得出其最佳产酶条件为:发酵时间36 h,发酵pH值7,发酵温度37 ℃,接种量6%,装液量80 mL,摇床转速200 r·min-1。由表1可见:经过发酵后菌株yc10的淀粉酶、纤维素酶、LiP、MnP、蛋白酶和果胶酶活性分别比优化前提高了184.00%、233.00%、82.13%、122.00%、63.59%和212.00%。

表1 菌株yc10优化前、后的降解酶活性Table 1 Degrading enzyme activity before and after optimization of production conditions of strain yc10
2.4 菌株yc10发酵液对烟叶中大分子化合物降解效果的影响
由表2可以看出:烟叶经过yc10菌株发酵后,5类大分子化合物含量相比于发酵前均有所降低,发酵后烟叶A、B、D中果胶的降解效果较为显著,降解率超过30%;4种烟叶中纤维素的降解效果次之,约为20%;淀粉的降解效果稍弱,但均超过10%;4种烟叶中木质素的降解效率差异较大,在烟叶A、C中的降解效率最低,小于10%。

表2 发酵前、后每克烟叶中大分子化合物的含量变化Table 2 The content change of macromolecular compounds in each gram of tobacco leaves before and after fermentation %
由表3可以看出:经过菌株发酵后,烟叶中的总糖含量增加。菌株yc10发酵后烟叶A、B、C、D中总糖含量比发酵前分别增加20.29%、9.84%、19.89%、11.38%。
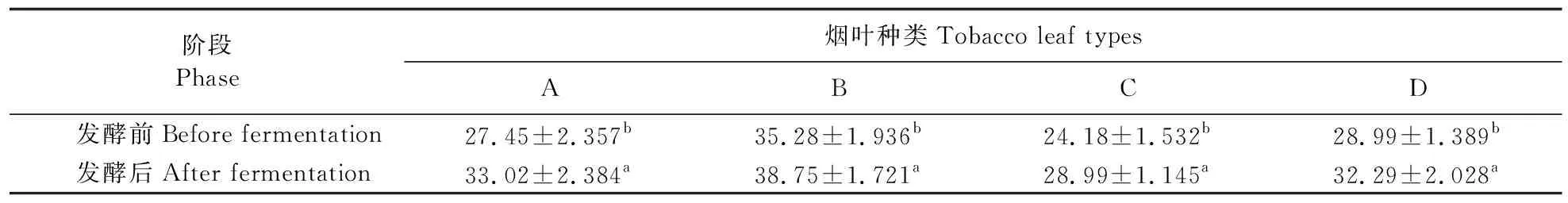
表3 发酵前、后每克烟叶中总糖含量的变化Table 3 Total sugar content change in each gram tobacco leaves before and after fermentation %
2.5 烟叶中香气成分的测定
由表4可见:烟叶A经过菌株yc10发酵后,酮类物质、酸类物质、酯类香气成分和杂环类化合物含量均比发酵前增加。烟叶中酸类物质中,乙酸及3-甲基丁酸含量增加较多;叶绿醇含量明显增加,比发酵前增加了21.53%。在烟叶A中还发现了3种醛类物质,虽然种类不多,但是经过yc10菌株发酵后醛类物质的总量增加了0.45%。

表4 发酵前、后烟叶中香气成分含量变化Table 4 Aroma components contents change in tobacco leaves before and after fermentation
3 讨论与结论
研究表明,改善和提高烟叶质量的主要措施是将烟叶中对烟叶品质有显著影响的大分子物质降解或通过发酵将它们转化成小分子的香气物质[21-23]。烟草行业常用的发酵方法一般分为自然发酵和人工发酵两类。生物发酵相比于自然发酵和人工发酵来说有诸多的优点,比如发酵周期短,不受天气情况的限制,占地面积小,同时生物发酵会增加烟叶中香气成分的含量,弥补了人工发酵之后烟叶香气不足的缺点。本研究从烟叶表面筛选出1株具有多重降解效果的假单胞杆菌属细菌菌株Pseudomonasgessardiiyc10,可以同时降解烟叶中的淀粉、纤维素、木质素、蛋白质和果胶,有效降解烟叶中的大分子化合物和有害前体物质,减少烟草燃吸过程中产生的有毒性和刺激性气体,增加烟叶中的香气成分,改善了烟叶品质。
生物发酵的基本原理是用微生物来降解烟叶中的大分子物质,如淀粉、蛋白质、果胶等,减少有害物质(如烟碱、焦油等)的产生,提高烟叶中的小分子物质,增加香气成分的含量,提高烟叶的品质[24-25]。微生物发酵效率明显高于传统的烟叶自然或人工发酵,在优化条件下更能大大缩短发酵时间。利用微生物发酵技术诱发烟叶内有机物质的转化,促进烟叶香味物质的积累,对提高烟叶内香味物质含量,改善陈化烟叶香吃味具有重要意义。
本研究中,经过对烟叶样品香气成分的分析,发现菌株发酵后烟叶A中的酮类、酯类、醇类等香气物质的含量均有不同程度增加,这些物质都是烟叶中重要的致香物质,与烟草的香气与品质密切相关。用菌株yc10发酵后,含量增加的酮类物质中,紫罗兰酮和大马酮是玫瑰油的主要香气化合物,它们赋予烟气花香和木香的吸味品质;β-大马酮可以赋予烟叶木香、花香、果香和甜香,特别是赋予充分成熟的烟草香味特征,同时茄酮、巨豆三烯酮主要形成了烤烟精油的香气[26]。含量增加的挥发性脂肪酸(C10以下)中,乙酸、丙酸及丁酸等对烟叶的香味有显著影响,可以调节烟草的酸碱度,使吸味醇和,增加烟气浓度,从而在烟气中起到平衡作用[27]。烟叶中的酯类化合物对香气成分的影响和贡献很大,许多酯类化合物对烟气香味有较好的影响,具有明显的香味特征[28],烟叶A经过发酵后挥发性内酯的含量增加,增加烟气的丰富性,对烟叶香气也有显著影响。烟草中分离出来的杂环类化合物、醇类成分及醛类成分均为重要的致香物质,烟叶A发酵后含量增加的叶绿醇具有花香和香脂香气,3-甲基-1-苯基吡啶、苯甲醛,苯乙醛的含量也有所增加,这些化合物可以赋予烟叶浓郁的烤香,对增强和改进烟叶香味具有明显作用[29-30]。
此外,由于微生物使烟叶中的淀粉、纤维素等大分子化合物降解为单糖等小分子物质,使烟叶A中的总糖含量增加,烟叶中的糖在热分解时会使烟气pH值呈酸性,中和烟气中烟碱的作用,降低烟气的刺激性。
本研究将菌株yc10的发酵液喷洒在烟叶表面,可有效降低发酵样中的淀粉、纤维素、木质素、蛋白质和果胶含量,发酵后烟叶中总糖含量增加,酮类、酸类、酯类、杂环类、醇类和醛类物质的含量也增加,表明微生物作用于烟叶之后对烟叶的香气品质有所改善。但不足的是,本研究是在实验室条件下对微生物降解烟叶中淀粉、纤维素、木质素、果胶和蛋白质等大分子化合物的作用效果进行的初步探索,作用条件及应用范围与实际生产还存在差异,还需要进一步研究。
