钙敏感受体及下游PLC/TRPM5介导苯丙氨酸刺激猪十二指肠分泌胆囊收缩素
2021-07-28王绿阳康翠翠丁立人冯江银洪秋霞游美敬保浩宇杭苏琴
王绿阳,康翠翠,丁立人,冯江银,洪秋霞,游美敬,保浩宇,杭苏琴*
(1.南京农业大学国家动物消化道营养国际联合研究中心/江苏省消化道营养与动物健康重点实验室/消化道微生物研究室,江苏 南京 210095;2.南京农业大学动物科学类国家级实验教学示范中心,江苏 南京 210095)
养猪生产中,采食量是影响猪生产性能的关键因素之一。研究表明,给猪自由采食的基础上再强饲20%,其体重可提高40%[1],说明提高采食量促进了动物生长。动物采食量主要与由十二指肠以及空肠近端Ⅰ细胞分泌的胃肠饱感激素胆囊收缩素(cholecystokinin,CCK)有关[2-3]。研究表明CCK主动免疫可以促进猪的采食,提高生长性能[4],说明CCK参与猪的采食调控。氨基酸可有效刺激CCK分泌,其中芳香族氨基酸——苯丙氨酸(phenylalanine,Phe)能显著刺激啮齿类动物小肠分泌CCK[5]。人体十二指肠灌注L-Phe可升高血液CCK浓度,降低胃肠蠕动速率,抑制机体食欲[6]。这表明日粮或蛋白质降解产生的Phe可能同样刺激猪CCK分泌。
胃肠道内分泌细胞(enteroendocrine cells,EEC)表达的G蛋白偶联型受体(G protein-coupled receptors,GPCR)参与介导胃肠激素的分泌,这些受体包括钙敏感受体(calcium sensing receptor,CaSR)和鲜味受体(type 1 taste receptor 1/3,T1R1/T1R3)[7]。研究发现,CaSR和T1R1/T1R3可介导啮齿类动物CCK的分泌[8-9],但这2个受体是否同样介导Phe刺激猪CCK分泌还不清楚。胞内磷脂酶C(phospholipase C,PLC)是介导CCK分泌的关键分子,其催化4,5-二磷酸磷脂酰肌醇(4,5-phosphatidylinositol bisphosphate,PIP2)分解产生的1,4,5-三磷酸肌醇(inositol triphosphate,IP3)可促进内质网钙库释放Ca2+[10]。另一方面,细胞膜阳离子通道蛋白瞬时受体电位离子通道蛋白5(transient receptor potential subfamily M member 5,TRPM5)的打开也依赖于胞内Ca2+浓度变化,尤其是PLC活化诱导的胞内Ca2+浓度升高[11],因此下游PLC/TRPM5可能是介导CCK分泌的关键分子。
目前关于氨基酸对胃肠激素分泌及食欲影响的研究主要集中于啮齿类动物或内分泌细胞系,而啮齿类动物与猪胃肠道氨基酸感应受体的表达存在差异[12-13]。此外,相比于内分泌细胞系,肠道组织培养能够保证细胞所处的环境基本保持完整,并能保留细胞极性[14]。因此,本研究以CCK分泌的主要部位——猪十二指肠组织为研究模型,结合本实验室前期建立的组织体外灌流方法,探究Phe对猪十二指肠组织CCK分泌的影响及其潜在机制,以期为从营养角度调控猪的采食奠定基础。
1 材料与方法
1.1 试验材料
CaSR抑制剂NPS 2143、calhex 231和PLC抑制剂U-73122均购自MedChem Express公司;L(D)-Phe、T1R1/T1R3激活剂肌苷酸(inosine monophosphate,IMP)、TRPM5抑制剂氧化三苯基磷(triphenylphophine oxide,TPPO)购自上海源叶生物科技有限公司;T1R1/T1R3抑制剂lactisole购自Cayman Chemical公司;猪胆囊收缩素(CCK)ELISA试剂盒购自南京奥青生物技术有限公司;CaSR抗体(MA1-934)和山羊抗鼠IgG(H+L)均购自Thermo Pierce公司,β-actin抗体购自Santa Cruz公司。
1.2 猪十二指肠组织灌流试验
1.2.1 灌流组织的采集及灌流样品制备用无菌蒸馏水配制0.01 mol·L-1PBS(135 mmol·L-1NaCl、8 mmol·L-1K2HPO4、2.7 mmol·L-1KCl、1.5 mmol·L-1KH2PO4,pH7.2),用于冲洗十二指肠组织中的食糜;配制基础(Kreb’s)缓冲液(136.87 mmol·L-1NaCl、3.0 mmol·L-1CaCl2、4.02 mmol·L-1KCl、2.10 mmol·L-1MgCl2、25.18 mmol·L-1HEPES、33.33 mmol·L-1Glucose,pH7.4),用于组织灌流。
猪十二指肠组织采集于江苏省南京市当地屠宰场,试验猪体重100~130 kg,品种为杜洛克×长白×约克夏三元杂交猪。猪屠宰后,立即采集长约6 cm的猪近端十二指肠,放置于充满气体(含95% O2和5% CO2)的预冷Kreb’s缓冲液中,于1 h内送至实验室,立即将组织放置于无菌操作台,参照谈寅飞等[15]和Xian等[16]的方法,剪取长3 cm左右的猪十二指肠,去除肠系膜脂肪后将肠道纵向剖开,用0.01 mmol·L-1PBS冲洗。将洗净的组织切成约1 mm3的组织块,混匀,按照每组400 mg称量并随机放入灌流小室。试验中所用的样品均来自3头猪的十二指肠组织混合物。
1.2.2 组织灌流程序灌流装置详见Wang等[17]的描述。灌流试验开始前,通过蠕动泵将含有气体的灌流液引入灌流小室,用水浴锅预热,使灌流小室液体温度达到37 ℃。将制备好的猪十二指肠组织放入灌流小室,调节蠕动泵速率为6 mL·h-1,用Kreb’s缓冲液预灌流20 min,使所有十二指肠组织处于同一状态。组织灌流程序如图1所示。试验一:根据Feng等[18]的方法并进行调整,分别用0、10、20和50 mmol·L-1的L-Phe溶液进行灌流(图1-A),筛选刺激猪十二指肠组织分泌CCK的L-Phe浓度;试验二:分别用D-Phe和L-Phe刺激组织比较氨基酸构型对CCK分泌的影响(图1-B);试验三:分别在灌流液中加入CaSR抑制剂NPS 2143(25 μmol·L-1)和calhex 231(20 μmol·L-1),T1R1/T1R3激动剂IMP(2.5 mmol·L-1)和抑制剂lactisole(5 mmol·L-1),PLC抑制剂U-73122(10 μmol·L-1)和TRPM5抑制剂TPPO(100 μmol·L-1),探究CaSR、T1R1/T1R3和下游信号分子PLC、TRPM5在L-Phe刺激CCK分泌过程中的作用(图1-C)。将试验过程中收集的灌流液4 ℃、10 000 r·min-1离心5 min,收集上清液,-20 ℃保存用于后续CCK浓度的测定。

图1 猪十二指肠组织灌流程序图Fig.1 The perfusion procedure of porcine duodenum A.不同浓度L-Phe对CCK分泌的影响;B. Phe构型对CCK分泌的影响;C.激活或抑制CaSR、T1R1/T1R3、PLC和TRPM5对L-Phe刺激CCK分泌的影响。A. Effects of different concentrations of L-Phe on CCK secretion;B. Effects of different configurations of Phe on CCK secretion;C. Effects of activation or inhibition of CaSR,T1R1/T1R3,PLC,and TRPM5 on L-Phe stimulated CCK secretion.

图2 猪十二指肠CaSR蛋白的表达Fig.2 Protein expression of CaSR in porcine duodenum
1.3 测定指标与方法
1.3.1 十二指肠CaSR蛋白免疫印迹检测在南京市某屠宰场再采集3头猪的十二指肠组织。提取组织蛋白并进行SDS-PAGE,之后将凝胶上的蛋白转移至聚偏氟乙烯膜上,用含50 g·L-1脱脂奶粉的TBST室温封闭1 h,再分别加CaSR(1∶2 000)和β-actin抗体(1∶1 500)4 ℃孵育过夜。TBST洗涤4次后,用二抗山羊抗鼠免疫球蛋白G(IgG,H+L,1∶5 000)室温孵育1 h。TBST洗涤3次,加入ECL发光底物后曝光,拍照。
1.3.2 灌流液CCK浓度测定严格按照猪CCK ELISA试剂盒说明书检测灌流液中的CCK浓度。试剂盒检测浓度为10~200 ng·L-1,批间变异系数小于15%,批内变异系数小于9%。
1.4 数据统计与分析

2 结果与分析
2.1 猪十二指肠CaSR蛋白的表达
如图1所示:3头猪的十二指肠均存在CaSR蛋白表达,且清晰度、条带数均较相似。
2.2 Phe对CCK分泌水平的影响
为了探讨不同浓度氨基酸对CCK分泌水平的影响,本试验分别用0、10、20和50 mmol·L-1L-Phe进行猪十二指肠灌流,并检测灌流液中的CCK浓度。结果如图3-B所示:与对照组(0 mmol·L-1Phe)相比,50 mmol·L-1L-Phe能够显著促进猪十二指肠CCK的分泌(P<0.05),而10、20 mmol·L-1L-Phe并不能促进CCK的分泌(P>0.05)。为进一步探讨CCK分泌是否与氨基酸的构型(D-型和L-型)有关,在上述试验的基础上,均分别选取0、50 mmol·L-1D-Phe和L-Phe 进行猪十二指肠灌流。结果图(3-D)显示:与0 mmol·L-1L-Phe相比,50 mmol·L-1L-Phe能够显著促进猪十二指肠CCK的分泌(P<0.05),而50 mmol·L-1D-Phe未能促进CCK的分泌(P>0.05),说明Phe促进CCK分泌与其特定结构有关。

图3 Phe浓度(A、B)及构型(C、D)对CCK分泌的影响Fig.3 Effects of Phe concentration(A,B)and configuration(C,D)on CCK level不同小写字母表示差异显著(P<0.05)。下同。Different letters mean significant difference(P<0.05). The same as follows.
2.3 CaSR抑制剂对CCK分泌水平的影响
如图4所示:与对照组(0 mmol·L-1L-Phe)相比,50 mmol·L-1L-Phe显著促进猪十二指肠CCK的分泌,但加入CaSR抑制剂NPS 2143或calhex 231后,L-Phe引起的CCK分泌被显著抑制(P<0.05)。这表明CaSR参与介导L-Phe刺激猪十二指肠分泌CCK。

图4 CaSR抑制剂NPS 2143(A、B)和calhex 231(C、D)对CCK分泌的影响Fig.4 Effects of CaSR inhibitors NPS 2143(A,B)and calhex 231(C,D)on CCK level
2.4 T1R1/T1R3抑制剂和激动剂对CCK水平的影响
如图5所示:与对照组(0 mmol·L-1L-Phe)相比,50 mmol·L-1L-Phe显著促进猪十二指肠CCK的分泌,但加入T1R1/T1R3激动剂IMP和抑制剂lactisole后,L-Phe引起的CCK分泌并无显著变化(P>0.05)。这表明T1R1/T1R3并未参与介导L-Phe刺激猪十二指肠CCK的分泌。
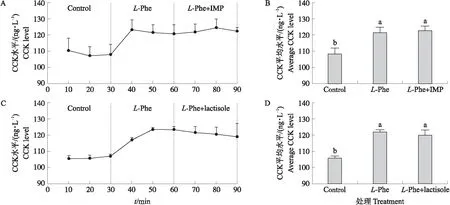
图5 T1R1/T1R3激动剂IMP(A、B)和抑制剂lactisole(C、D)对CCK分泌的影响Fig.5 Effects of T1R1/T1R3 agonist IMP(A,B)and inhibitor lactisole(C,D)on CCK level
2.5 PLC和TRPM5抑制剂对L-Phe诱导的CCK水平的影响
如图6所示:与对照组(0 mmol·L-1L-Phe)相比,50 mmol·L-1L-Phe显著促进猪十二指肠CCK的分泌,但分别加入下游信号分子PLC抑制剂U-73122和TRPM5抑制剂TPPO后,L-Phe引起的CCK分泌均显著降低(P<0.05)。这表明L-Phe刺激CCK分泌需要下游信号分子PLC和TRPM5的参与。

图6 PLC抑制剂U-73122(A、B)和TRPM 5抑制剂TPPO(C、D)对CCK水平的影响Fig.6 Effects of PLC inhibitor U-73122(A,B)and TRPM5 inhibitor TPPO(C,D)on CCK levels
3 讨论
3.1 猪十二指肠CaSR蛋白的表达
作为跨膜蛋白,CaSR由胞外结构域、跨膜结构域及胞内结构域3个独立的部分构成[19]。为探究CaSR在Phe刺激猪十二指肠分泌CCK中的作用,本研究验证了猪十二指肠存在CaSR蛋白的表达。结果显示,猪的CaSR为相对分子质量130 000和150 000的条带,人和啮齿类动物蛋白结果同样显示CaSR包含130 000和150 000蛋白条带[20-21]。研究显示,检测到的130 000条带是位于胞内的、未修饰的不成熟结构,150 000条带是位于细胞膜、经糖基化修饰后的成熟结构,其糖基化结构包括甘露糖或复合碳水化合物,并被认为对CaSR在细胞表面的定位、从细胞内向膜运输以及蛋白的折叠至关重要[22]。断奶仔猪胃肠道CaSR的表达由强到弱依次为回肠、空肠、胃、十二指肠、结肠,这可能与营养物质主要在小肠被吸收有关。研究表明CaSR的主要激活剂Ca2+有超过60%被回肠吸收、20%左右被空肠和十二指肠吸收,剩下的被胃和大肠吸收。因此,CaSR在猪胃肠道的分布模式与不同肠段对营养物质吸收的相对贡献是一致的[23]。
3.2 Phe对CCK分泌的影响
作为必需氨基酸,L-Phe灌胃能显著提高啮齿类动物血液CCK水平并抑制机体食欲[5]。此外,人体十二指肠灌注L-Phe同样能够提高血液CCK水平,降低机体能量摄入[24]。说明L-Phe是CCK分泌的刺激物。本研究表明,50 mmol·L-1L-Phe能够显著刺激猪十二指肠CCK的分泌,而10和20 mmol·L-1无此效应。但目前不同研究中L-Phe刺激CCK分泌的水平并不一致,对啮齿类动物细胞系的研究显示L-Phe刺激CCK分泌的浓度是10 mmol·L-1或20 mmol·L-1[11,25],这可能是由细胞系和十二指肠组织之间的差异引起的。另外,同属于芳香族氨基酸的L-色氨酸(L-tryptophan,L-Trp)在20 mmol·L-1时便可显著刺激猪十二指肠分泌CCK,这表明氨基酸的结构特征和理化性质影响激素的分泌[26]。同时,仅L-Phe可以刺激CCK分泌而非D-Phe,表明氨基酸构型同样是影响CCK分泌的因素。除了CCK,L-Phe还是其他胃肠激素分泌的刺激物。L-Phe体外灌流还可以刺激啮齿类动物肠道和结肠L细胞分泌胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)和酪酪肽(peptite YY,PYY)[27]。此外,渗透压可能是刺激激素分泌的因素之一[28-29],但本研究中L-Phe诱导CCK的分泌与渗透压无关,因为50 mmol·L-1D-Phe并没有出现该效应。
3.3 CaSR 和T1R1/T1R3在L-Phe诱导的CCK分泌中的作用
为进一步探究CaSR和T1R1/T1R3的作用,本研究首先在灌流液中分别加入CaSR特异性抑制剂NPS 2143和calhex 231,发现L-Phe对CCK的促分泌作用消失,这表明L-Phe促进猪十二指肠CCK的分泌依赖于CaSR。同时,抑制剂NPS 2143和Calhex 231的浓度也被证明对细胞活力和CCK的分泌没有影响[25,30]。加入T1R1/T1R3激动剂IMP或拮抗剂lactisole后,L-Phe刺激的CCK分泌并无显著变化,这表明T1R1/T1R3并未参与介导L-Phe刺激猪十二指肠CCK的分泌,这与对啮齿类动物以及小鼠细胞系的研究结果存在差异。啮齿类动物和猪T1R1/T1R3蛋白的同源性只有73%[31],这可能是本研究与啮齿类动物研究中T1R1/T1R3对L-Phe的感应存在差异的原因。
作为氨基酸感应体,CaSR和T1R1/T1R3均属于G蛋白偶联型受体C家族,其中CaSR主要感应芳香族氨基酸(色氨酸、酪氨酸、苯丙氨基酸),而T1R1/T1R3可识别20多种L-氨基酸,尤其对L-谷氨酸(L-glutamate,L-Glu)敏感[32]。Daly等[9]对小鼠近端小肠的研究发现,L-Phe能够同时激活CaSR和T1R1/T1R3诱导CCK分泌,但L-Glu只能通过T1R1/T1R3诱导激素分泌。本实验室前期研究也表明,T1R1/T1R3能介导L-Glu刺激猪十二指肠CCK的分泌[33]。结合本研究,L-Phe和L-Glu可能分别通过激活CaSR和T1R1/T1R3刺激猪十二指肠CCK的分泌。
3.4 PLC和TRPM5在L-Phe诱导的CCK分泌中的作用
关于胃肠道PLC/TRPM5信号通路的研究已经很多,尤其是在介导胃肠激素分泌中的作用。研究表明,抑制PLC活性能够减弱H2S刺激小鼠STC-1细胞GLP-1和PYY的分泌[34]。此外,呕吐毒素刺激小鼠STC-1细胞CCK的分泌依赖于TRPM5的激活[35]。本文进一步研究了PLC/TRPM5在L-Phe刺激猪十二指肠CCK中的分泌。结果表明,灌流液中分别加入PLC和TRPM5特异性抑制剂U-73122和TPPO后,L-Phe 对CCK的促分泌作用消失,这表明PLC/TRPM5同样介导L-Phe刺激猪十二指肠CCK的分泌。此外,PLC活化而引起的TRPM5通道的打开能够引发胞外Na+内流,从而升高胞内膜电位,诱导细胞去极化[36];细胞去极化能够造成质膜上电压门控钙离子通道(voltage-gated calcium channel,VGCC)的打开,进一步提高胞内Ca2+浓度[37]。最新的研究表明,直接诱导细胞去极化的发生就足以促使内分泌细胞GLUTag分泌GLP-1,说明细胞去极化也是胃肠激素分泌的诱因之一[38]。因此推测PLC/TRPM5可能会进一步通过诱导细胞去极化与胞内升高的Ca2+浓度协同促进CCK分泌。
本试验证明了猪十二指肠表达CaSR,揭示CaSR、T1R1/T1R3、PLC和TRPM5的激活剂或抑制剂在L-Phe 刺激猪十二指肠CCK分泌中的作用。但是本研究仅仅证明了PLC和TRPM5在其中的介导作用,而Ca2+作为二者之间信号传递者的作用未被证实;同时体内环境复杂,需要利用激活剂或抑制剂进一步验证CaSR、PLC和TRPM5在其中的作用。
