干扰EZH2的表达对奶山羊精原干细胞抗氧化能力的影响
2021-07-28蔡玉邓明田刘孜斐张国敏马键宇安世钰王智博张艳丽王锋
蔡玉,邓明田,刘孜斐,张国敏,马键宇,安世钰,王智博,张艳丽,王锋
(南京农业大学江苏省家畜胚胎工程实验室,江苏 南京 210095)
精子发生是雄性生殖期的一个循环过程,保障了哺乳动物种群的正常繁衍和遗传物质的稳定[1]。哺乳动物精子的发生在睾丸曲精细管上皮进行,主要由3个阶段组成:精原细胞的有丝分裂、精母细胞的减数分裂和成熟精子的形成[2]。在分裂过程中,精原干细胞分化产生精原细胞,促进精子形成[3],同时保持自我更新能力以维持自身数量稳定和精子发生[4]。因此,精原干细胞是雄性动物精子发生和生殖的基础。
氧化应激是体内活性氧(reactive oxygen species,ROS)与抗氧化剂之间不平衡的结果,在精子发生中起着核心作用。适量ROS的产生对于精子获能和精卵结合必不可少,但过量的ROS会导致精子脂质膜过氧化、DNA损伤、畸形和过度凋亡[5],引起精子发生障碍,最终造成雄性不育[6]。研究发现,抗氧化治疗可在一定程度上提高精子浓度、活力和精子形态[7]。对干细胞中ROS的研究已有报道,癌症干细胞中ROS含量较高,种类复杂,常引发恶性肿瘤的发生[8]。在造血、神经和肌肉干细胞中,ROS和氧化还原稳态对于干细胞功能维持及其组织动态平衡至关重要[9]。随着人类胚胎干细胞(embryonic stem cells,ESC)的分化,线粒体DNA含量增多,ROS水平升高,过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)表达量下降[10]。而在成骨分化后,人类间充质干细胞中线粒体质量和耗氧量显著增加,抗氧化酶SOD和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的表达上调,阻断了细胞内ROS的积累[11]。上述结果说明,干细胞中ROS代谢导致抗氧化酶基因发生变化,改变干细胞的命运。
果蝇zeste基因增强子人类同源物2(enhancer of zeste homolog 2,EZH2)是polycomb抑制复合物2(polycomb repressive complex 2,PRC2)中的成员,具有组蛋白H3K27甲基转移酶活性,能够作为转录沉默染色质的标记,并维持干细胞特性[12]。氧浓度能够调控染色质修饰基因的转录水平[13],ROS激活也与表观遗传的改变息息相关[14]。有研究报道,采用EZH2抑制剂3-去氮腺嘌呤A(3-deazaneplanocin A,DZNep)或者小干扰RNA(small interference RNA,siRNA)抑制EZH2在小鼠肾缺血/再灌注损伤模型中的表达后,ROS含量下降,并在体内阻断氧化应激激活和凋亡[15],表明EZH2是氧化应激的关键调控因子。与体内环境相比,体外培养是一个静态的高氧压条件,易诱发精原干细胞中ROS浓度升高,影响其自我更新[16]。然而,EZH2对奶山羊精原干细胞抗氧化能力的影响尚不清楚。本研究通过siRNA技术,进一步借助实时定量PCR(quantitative real time PCR,qPCR)、Western blot和ELISA等试验方法探究EZH2在奶山羊精原干细胞抗氧化中的作用,为探索精子发生机制提供参考。
1 材料与方法
1.1 试验材料
奶山羊永生化精原细胞系(goat male germline stem cells,mGSC,以下简称奶山羊精原干细胞)由陕西省干细胞工程技术研究中心华进联老师课题组分离纯化后惠赠[17];奶山羊精原干细胞培养所需的DMEM/F12 glutaMAXTM培养基、0.05 g·L-1胰酶、磷酸缓冲盐溶液(PBS)、Lipofectamine 3000和Trizol试剂(Invitrogen,USA)均购自美国Thermo Scientific公司;胎牛血清(FBS)购自美国Zeta-Life公司。
定量酶AceQ qPCR SYBR Green Master Mix(Q111-02/03)购自南京诺唯赞公司;反转录试剂盒购自TaKaRa(大连)生物公司;相关引物由南京擎科生物科技公司合成;BCA蛋白浓度检测试剂盒和免疫荧光试剂盒购自碧云天公司(Beyotime);CAT、SOD2、ACTB单克隆抗体及辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗均购自美国Cell Signaling Technology(CST)公司;荧光标记的山羊抗兔二抗购于Boster公司;ECL试剂盒购自南京建成生物有限公司;山羊过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活性和丙二醛(malondialdehyde,MDA)含量检测的ELISA试剂盒购自南京金益柏生物科技有限公司;其他试剂均为国产分析纯。NanoDrop 2000分光光度计、全波长酶标仪购自美国Thermo Fisher公司;倒置荧光显微镜购自日本Nikon公司;发光成像系统Image Quant LAS 400购自日本Fiji film公司。
1.2 细胞培养及处理
奶山羊精原干细胞在37 ℃、5% CO2条件下,采用细胞专用培养瓶培养于含有10%胎牛血清的DMEM/F12 glutaMAXTM培养基中。
采用siRNA技术干扰EZH2在奶山羊精原干细胞中的表达。EZH2siRNA(简写为siEZH2)及阴性对照siRNA(negative control,NC)由上海吉玛制药技术有限公司纯化合成。序列对如下:正义链5′-GCAGCUUUCUGUUCAACUUTT-3′,反义链 5′-AAGUUGAACAGAAAGCUGCTT-3′。将奶山羊精原干细胞传代至 6孔板中培养,待其生长至60%~70%汇合度时,根据Lipofectamine 3000说明书分别将含有NC和siEZH2的脂质体复合物充分混匀后,室温静置15 min,缓慢添加至细胞培养液中,培养48 h后,收集细胞进行后续试验。
1.3 qPCR检测抗氧化相关基因的表达水平
采用Trizol试剂提取转染48 h后奶山羊精原干细胞的RNA。用NanoDrop 2000分光光度计测定RNA浓度后,用TaKaRa反转录试剂盒将RNA反转录为cDNA,随后用AceQ qPCR SYBR Green Master Mix进行qPCR(Applied Biosystems 7500)检测抗氧化相关基因mRNA表达水平,再通过2-ΔΔCT方法进行定量。以管家基因β肌动蛋白基因(β-actin)作为内参,每个试验均独立重复3次。用于qPCR的特异性引物序列见表1。

表1 荧光定量PCR中的特异性引物Table 1 Details of primer sequences used for quantitative real-time PCR
1.4 ELISA检测抗氧化指标的酶活性或含量
细胞转染48 h后,收集上清液,利用ELISA试剂盒检测CAT、SOD和GPx活性,同时也检测精原干细胞中脂质氧化终产物MDA的含量。批内变异系数均小于10%,批间变异系数均小于15%。
1.5 免疫荧光检测EZH2的干扰效率
将奶山羊精原干细胞接种于内含爬片的12孔板中,当细胞汇合度达到60%~70%时,固定于4%多聚甲醛中1 h,用0.2% Triton X-100通透1 h;用PBS清洗3次,每次10 min;随后用50 g·L-1BSA室温封闭 2 h,加一抗(兔抗EZH2抗体,1∶250稀释)4 ℃孵育过夜,再次清洗后加荧光标记的抗兔二抗(1∶1 000)避光孵育2 h;然后采用DAPI(4′,6-diamidino-2-phenylindole)染细胞核15 min,PBS清洗3次后,加抗荧光淬灭剂后封片,在激光共聚焦显微镜(Carl Zeiss,Germany)下镜检并拍照。
1.6 Western blot(WB)检测抗氧化相关蛋白的表达水平
收集转染72 h后的细胞样品,加入含有蛋白酶抑制剂和磷酸酶抑制剂(1∶100)的RIPA溶液,置于1.5 mL离心管中,冰上充分裂解30 min后,12 000 r·min-1离心10 min。取上清液采用BCA试剂盒测定蛋白浓度后,将蛋白与上样缓冲液充分混匀,70 ℃煮沸10 min使蛋白变性,-20 ℃保存备用。随后取10 μg(10 μL)样品进行SDS-PAGE(200 V,40 min),结束后1.5 V转膜15 min,在50 g·L-1脱脂奶粉中封闭2 h。加一抗,4 ℃孵育过夜,TBST溶液洗涤3次,加HRP标记的山羊抗兔二抗,室温孵育1 h。一抗和二抗的稀释比例见表2。随后滴加ECL超敏发光液在发光成像系统Image Quant LAS 400进行曝光,以Actin为内参,采用Image J软件分析条带灰度值后检测蛋白相对表达量。
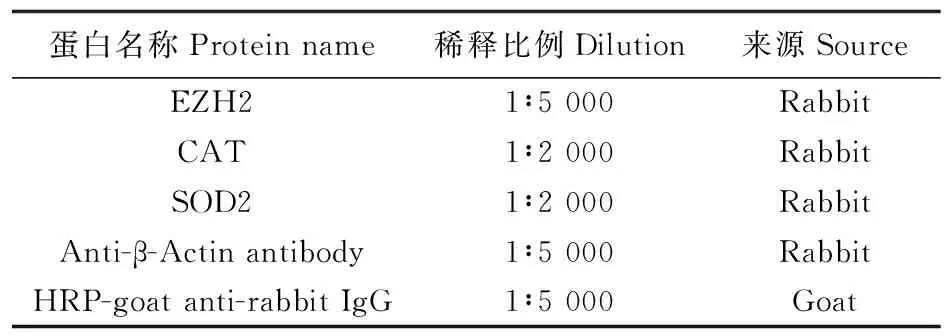
表2 Western blot所用一抗稀释比例Table 2 The dilution ratio of specific primary antibody for Western blot used in the study
1.7 数据统计与分析

2 结果与分析
2.1 奶山羊精原干细胞中EZH2干扰效率的验证
qPCR和Western blot结果如图1所示:与对照组相比,干扰EZH2(siEZH2)极显著降低了(P<0.01)奶山羊精原干细胞中EZH2的mRNA和蛋白表达水平。此外,免疫荧光检测结果显示:干扰EZH2后,与对照组相比,EZH2的荧光强度极显著下降(P<0.01),与上述结果一致,说明siEZH2成功干扰了奶山羊精原干细胞中EZH2的表达,能够进行后续试验。
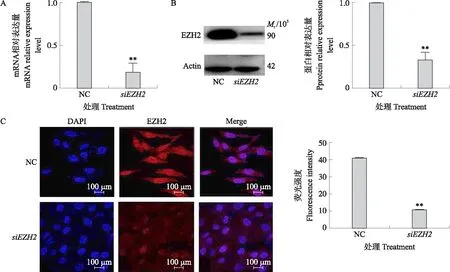
图1 奶山羊精原干细胞(mGSC)中EZH2干扰效率的验证Fig.1 Verification of siEZH2 efficiency of mGSC A. mGSC转染NC和siEZH2后EZH2 mRNA的表达;B. mGSC转染NC和siEZH2后EZH2蛋白的表达;C. 免疫荧光检测在mGSC转染NC和siEZH2后EZH2蛋白的表达。A. mRNA expression of EZH2 after transfected with NC and siEZH2 in mGSC;B. Protein expression of EZH2 after transfected with NC and siEZH2 in mGSC;C. EZH2 protein expression in EZH2 knockdown mGSC as reflected by immunofluorescence.1)NC:对照组Control group;siEZH2:EZH2 siRNA;2) **表示与对照组相比差异极显著(P<0.01)。下同。 ** means significant differences at 0.01 level. The same below.
2.2 干扰EZH2对奶山羊精原干细胞抗氧化物水平的影响
采用ELISA检测细胞培养液中CAT、SOD、GPx活性和MDA含量。如图2所示:与对照组相比,干扰EZH2后,奶山羊精原干细胞中CAT、SOD和GPx活性极显著升高(P<0.01),而MDA含量极显著下降(P<0.01),说明干扰EZH2后提高了精原干细胞的抗氧化能力。

图2 干扰EZH2对奶山羊mGSC中CAT、SOD、GPx活性和丙二醛(MDA)含量的影响Fig.2 Effects of siEZH2 on the activities of catalase(CAT),superoxide dismutase(SOD),glutathione peroxidase(GPx)and the content of malondialdehyde(MDA)in mGSC
2.3 干扰EZH2对奶山羊精原干细胞抗氧化相关基因和蛋白表达的影响
采用qPCR、Western blot检测干扰EZH2后,奶山羊精原干细胞中CAT、SOD2和GPx的mRNA和蛋白相对表达量。如图3所示:与对照组相比,在奶山羊精原干细胞中干扰EZH2后,CAT、SOD2和GPxmRNA表达量极显著上升(P<0.01),CAT和SOD2蛋白的表达水平极显著升高(P<0.01),进一步说明EZH2通过激活抗氧化基因的表达影响奶山羊精原干细胞的抗氧化水平。
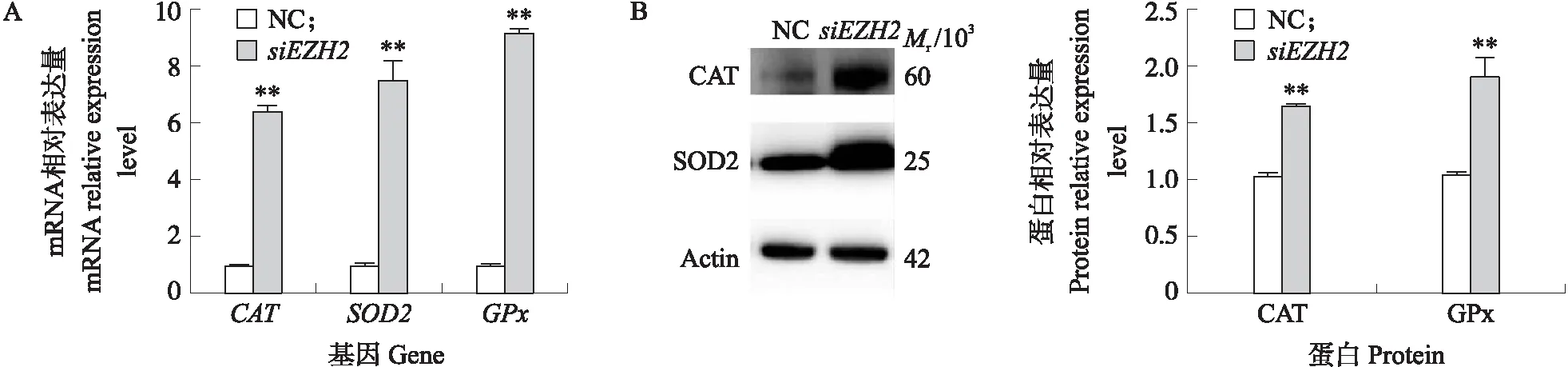
图3 干扰EZH2对奶山羊mGSC中CAT、SOD2和GPx的mRNA(A)和蛋白(B)相对表达水平的影响Fig.3 Effect of siEZH2 on the relative expression level of CAT,SOD2 and GPx mRNA(A) and protein(B)in mGSC
3 讨论
氧化应激会导致睾丸产生病理损伤,进而造成生精受阻,诱发雄性不育[18]。精原干细胞的损伤不可逆转,最终会导致精子发生障碍。与其他干细胞类似,精原干细胞具有多向分化和自我更新的能力,使其不断增殖,防止衰老。ROS信号传导对于干细胞群体的调控至关重要,影响了干细胞稳态和谱系传承,在干细胞老化过程中具有重要作用[19]。近期研究表明,干细胞对氧化应激较为敏感,低氧是线粒体氧化的抑制剂[20],能够调节干细胞命运[21]。此外,ROS既能维持胚胎干细胞的干性和未分化状态[22],也能调节成体干细胞自我更新和分化之间的平衡[16]。精原干细胞是精子发生的源头,虽然在正常状态下会产生氧自由基,但是过量的ROS则会导致细胞内氧化及抗氧化系统失衡。因此,提高精原干细胞的抗氧化能力是改善生精的重要机制之一。
EZH2是PRC2复合物的核心组分,属于组蛋白-赖氨酸-甲基转移酶家族、Ez亚家族,包含SET结构域,是转录沉默染色质的标记,在维持干细胞命运[23]和基因组印迹中具有重要作用[24]。EZH2在人和小鼠的睾丸组织中高表达[25],影响小鼠精原细胞的分化和凋亡[26]。敲除EZH2后导致人类胚胎干细胞的自我更新和分化特性受损[27]。本研究采用siRNA技术干扰EZH2的表达,探索EZH2在奶山羊精原干细胞抗氧化能力中的作用。经过Lipofectamine 3000转染后,qPCR、Western blot和免疫荧光结果均表明,转染siEZH2能够极显著降低奶山羊精原干细胞中EZH2的表达水平,证明采用siEZH2干扰是有效的,能够进行后续试验。在氧化损伤和炎症过程中,激酶激活与表观遗传的改变密切相关[14],机体可能通过调节DNA和组蛋白甲基化等表观遗传修饰来清除ROS[28]。有研究表明,低氧诱导因子1α(HIF-1α)由线粒体ROS产生,与EZH2直接相关,HIF-1α是乳腺癌中PRC2和EZH2功能的关键调节剂[29]。EZH2在维持干细胞分化中发挥关键作用,EZH2表达的增加激活了细胞存活途径[30]。因此,本试验在干扰EZH2后,首先检测了奶山羊精原干细胞中氧化应激相关指标。研究发现,与对照组相比,SOD活性显著提高,而MDA含量呈现下降趋势,这与在心肌缺血再灌注模型中的结果类似[31],说明干扰EZH2后,细胞中的氧化及抗氧化系统发生障碍,降低了氧自由基对细胞的损伤,其作用机制可能与抑制脂质过氧化反应、维持细胞内氧化及抗氧化系统的平衡有关。
在进化过程中,机体不断完善自身的抗氧化防御系统,其中一些靶基因在机体抵抗氧化应激中发挥关键作用。在小鼠胚胎干细胞中,20%氧气处理组EZH2的转录水平降低,说明氧气浓度的高低影响EZH2的转录水平[13]。有研究通过NaHS处理肠上皮细胞后,GPx活性显著提高,暗示其增强了细胞的氧化应激水平[32]。在牛精液冷冻过程中,添加适量包埋胆固醇的甲基-β-环糊精显著增加了CAT、GPx和SOD基因的表达量,提高了冻融牛精子的抗氧化能力[33]。此外,在成骨分化后,人类间充质干细胞中SOD和GPx的表达量上调,阻断了细胞内ROS积累[11]。本研究通过qPCR、Western blot检测发现干扰EZH2后,CAT、SOD2的mRNA和蛋白水平显著提高,同时GPx的mRNA表达量显著上升,与上述结果一致,说明干扰EZH2能够避免奶山羊精原干细胞受到氧化损伤,提高细胞的抗氧化性能。细胞防御自身免受氧化应激等损伤的“抗氧化应答”机制与细胞糖代谢有关,小分子以可逆的方式靶向糖酵解途径激活抗氧化反应[34]。在高糖处理的肾小管上皮细胞中,敲除EZH2阻断了ROS的积累[35]。本试验结果表明EZH2通过调控奶山羊精原干细胞中相关基因的表达影响其正常的氧化能力,干扰EZH2可能通过降低ROS水平进而提高精原干细胞的抗氧化能力,但其是否与糖代谢机制相关仍需进一步验证。
综上所述,干扰EZH2可提高奶山羊精原干细胞内CAT、GPx和SOD酶活性,降低MDA含量,可能通过调控CAT、GPx和SOD2基因的表达水平来提高精原干细胞抗氧化能力,但具体分子机制有待深入研究,以上研究结果将为探索精子发生相关机制提供理论参考。
致谢:江苏省家畜胚胎工程实验室所有成员和南京农业大学生物信息学中心高性能计算平台在样品收集和试验技术等方面给予了指导和帮助,谨致谢意。
