花后渍水对小麦根系形态、生理及地上部干物质分配和产量的影响
2021-07-28马尚宇韩笑王艳艳黄正来张文静樊永惠马元山
马尚宇,韩笑,王艳艳,黄正来*,张文静,樊永惠,马元山
(1.安徽农业大学农学院/农业农村部黄淮南部小麦生物学与遗传育种重点实验室,安徽 合肥 230036;2.江苏省现代作物生产协同创新中心,江苏 南京 210095;3. 安徽农业大学农业园管理中心,安徽 合肥 230036)
稻麦轮作是我国长江中下游主要种植方式,该区域小麦产量占全国小麦总产量的22%左右[1],然而,由于水稻栽培需要长期浸水,因此稻田土壤具有板结、黏重和通透性差等特点,同时,长江中下游地区雨量充沛,强降水较频繁,小麦生长季平均降水量达500~800 mm,尤其是开花期至成熟期降水量大,因此,小麦花后渍水成为制约该地区小麦产量的重要限制因素[2]。渍水降低小麦株高、叶面积指数和叶片相对含水量,使其黄化和老化[3],光合作用减弱[4],抑制其干物质积累和转运,降低籽粒产量和品质[5-6],一般减产约20%[7]。根系是小麦受渍水影响最直接的器官,当土壤中氧气浓度低于临界值0.12 mol·m-3时,小麦根系便处于缺氧状态,生长速度开始减慢,3 d后停止生长,甚至部分根系出现坏死[8]。渍水显著降低小麦根系活力,降低根系对土壤中N、P、K等营养物质的吸收和运输能力[9-10]。有研究发现,渍水对小麦生育后期根系质量和次生根数量的抑制作用较苗期显著,在小麦不同生育期分别渍水处理20 d,与未渍水处理相比,渍水促进幼苗期小麦单株根重的增加,却显著降低拔节期、孕穗期和灌浆期单株根重,对灌浆期抑制作用最强,抑制率为28.31%;同时,渍水显著提高幼苗期、拔节期和孕穗期的次生根数量,分别增加 56.09%、32.95%和12.52%,而对灌浆期的次生根数量无显著影响[11];也有研究发现,与未渍水处理相比,在小麦生育前期(返青期—拔节期、拔节期—孕穗期)进行渍水处理20 d能够促进次生根生长,次生根数量分别增加75.86%和59.2%,而在孕穗期以后(孕穗期—扬花期、灌浆期)渍水降低了次生根数量,分别降低19.78%和26.50%[12]。前人在研究渍水对小麦根系的影响时,多集中在对根系干物重和次生根数量的比较[13-14],而对根系其他形态指标鲜有报道。本研究通过在小麦开花期设置不同时间的渍水处理,探索渍水对小麦根系形态、根系抗氧化酶活性、成熟期干物质分配及其产量的影响,同时探究渍水条件下小麦根系生长状况与产量之间的关系,旨在为生产中提高小麦抗渍能力提供理论依据。
1 材料与方法
1.1 试验材料
试验于2016—2017年在安徽省合肥市庐江县郭河镇安徽农业大学试验基地(东经117°01′,北纬 30°57′)进行。供试小麦品种选用‘宁麦13’和‘皖麦52’。采用盆栽试验方法,圆柱形塑料桶直径30 cm,高30 cm,桶底部带有5个排水孔。供试土壤取自试验基地田间耕作层表土,土质为黄褐土,含有机质14.28 g·kg-1,碱解氮 66.80 mg·kg-1,速效磷 23.2 mg·kg-1,速效钾 52 mg·kg-1,pH值5.16。
1.2 试验设计
将供试土壤过筛后,每盆称取土壤10 kg,将其与肥料混匀后装入直径30 cm,高30 cm的塑料盆中。每盆施纯N 2.4 g、P2O51.2 g、K2O 1.2 g,在小麦拔节期每盆追施纯N 1.6 g。播种时间为2016年11月11日,每盆播种25粒,于3叶期定苗,每盆留苗10株。
采用随机区组设计,以不渍水处理为对照组(W0),渍水处理于小麦开花期开始,将盆栽小麦搬入深40 cm的土槽中,并用水管向土槽中注水,保持小麦地上部1 cm水层,分别设置渍水3、6和9 d(分别用W3、W6和W9表示)。渍水处理结束时,将盆栽小麦从渍水土槽中搬出,在正常条件下继续培养;其中对照组(W0)土壤水分含量在70%~80%。每个处理3次重复,每个重复种15盆。各处理组分别在开花期和花后7 、14和21 d时取样,用自来水冲洗根部,测定根系形态、抗氧化酶活性和干物质量等指标。
1.3 测定项目与方法
1.3.1 根系中内源保护酶活性和丙二醛含量的测定在小麦花后7、14和21 d时,分别取不同处理条件下长势一致的小麦3盆,用自来水冲洗根系并取根尖1 cm处,用锡箔纸包装作好记号并立即放液氮中速冻,在-70 ℃冰箱中贮存备用。采用硫代巴比妥酸反应法(TBA)测定丙二醛(MDA)含量,采用氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性,采用紫外线吸收法测定过氧化物酶(POD)活性[15]。
1.3.2 根系形态扫描在小麦开花期及花后7、14和21 d时,分别取不同处理条件下长势一致的小麦 3盆,用自来水冲洗根系,并用吸水纸擦干。采用德国产WinRHIZO Pro 2008根系扫描仪进行扫描,以 *.TIF 格式保存在电脑中进行分析,测量根系体积、表面积、根系总长和根系平均直径等根系形态指标。
1.3.3 小麦干物质积累与分配在小麦开花期及花后7、14和21 d时,分别取不同处理条件下长势一致的小麦3盆,用自来水冲洗根系,用吸水纸擦干后,于105 ℃杀青1 h,80 ℃烘干至恒重,测定根系干物重。同时,于成熟期,分别取不同处理条件下长势一致的小麦3盆,按茎鞘、叶片、颖壳+穗轴、籽粒分开,于 105 ℃杀青1 h,80 ℃烘干至恒重,测定干重并计算其在地上部干重中所占比例。
1.3.4 籽粒产量及其构成因素调查在成熟期,取不同处理条件下长势一致的小麦各5盆,调查有效穗数和穗粒数,脱粒自然晾干后,测定千粒重。
1.4 数据分析
用DPS 7.05进行单因素方差分析,各渍水处理的平均值用LSD法(P<0.05)进行差异显著性检验,采用Microsoft Excel 2007软件整理试验数据、制表和绘图。
2 结果与分析
2.1 渍水对小麦根系生长的影响
2.1.1 渍水对小麦根系总长和平均直径的影响从表1可见:渍水处理降低了‘宁麦13’和‘皖麦52’的根系总长和根系平均直径,2个品种W3处理的根系总长和根系直径与W0处理差异不显著,而W6和W9处理根系总长和根系平均直径均显著低于W0。2个品种的根系总长在开花后不再增长,花后7~21 d,2个品种根系总长不断降低。与花后7 d相比,花后21 d时‘宁麦13’的W0、W3、W6和W9处理根系总长分别降低22.47%、20.69%、18.15%和31.33%;花后21 d‘皖麦52’的W0、W3、W6和W9处理组根系总长分别降低14.47%、14.60%、22.44%和23.69%。随生育进程2个品种的根系平均直径变化存在差异。花后7~21 d,‘宁麦13’根系直径不断变大,与花后7 d相比,花后21 d时W0、W3、W6和W9处理根系平均直径分别增加12.24%、14.89%、13.04%和8.89%,其中W9处理对‘宁麦13’根系损伤较大;花后21 d‘皖麦52’W0、W3、W6和W9处理根系平均直径分别减少3.03%、6.15%、9.52%和14.29%。
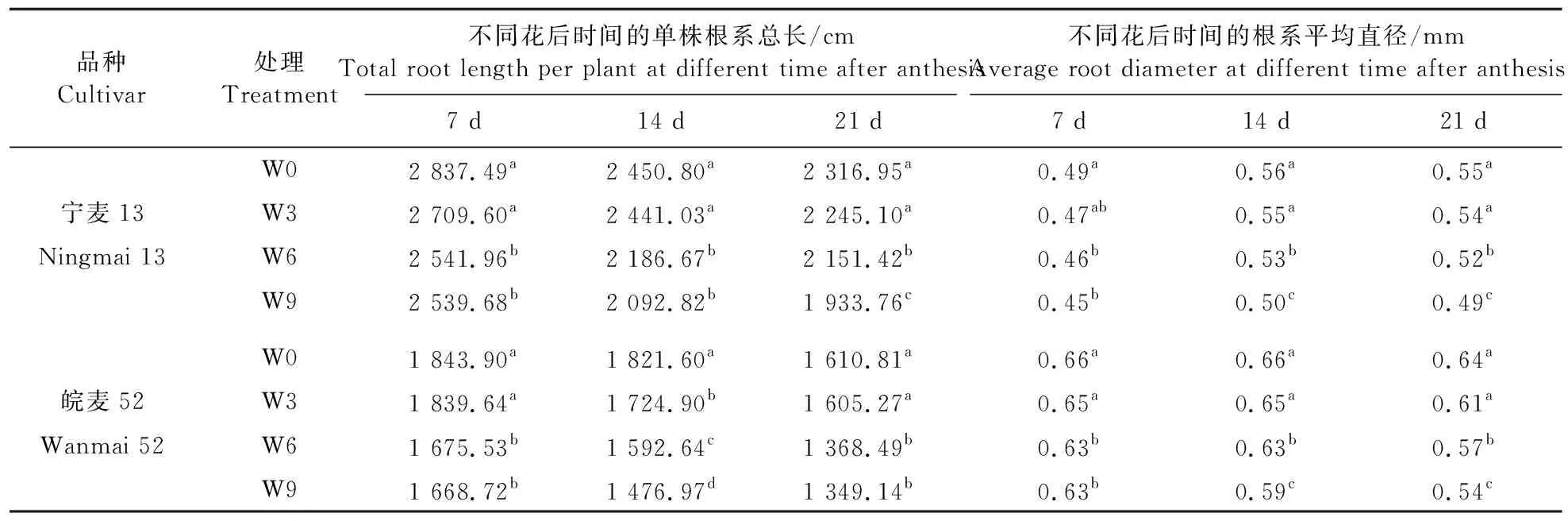
表1 不同时间渍水处理对小麦根系总长和平均直径的影响Table 1 The effect of different waterlogging stress time on the total root length and average root diameter in wheat
2.1.2 渍水对小麦根系干重、体积和表面积的影响从图1可见:渍水降低了2个品种的根系干重、根系体积和根系表面积。2个品种的W3处理根系干重、体积和表面积与W0无显著差异,而W6和W9处理组显著低于W0。渍水处理对‘宁麦13’根系干重、体积和表面积的抑制作用随渍水时间的延长而增加,花后14~21 d,W9处理根系体积和表面积显著低于W6处理,而根系干重在花后21 d时显著低于W6处理。‘皖麦52’在花后14 d时,W9的根系干重、体积和表面积显著低于W6,但在花后21 d时,2个处理间差异不显著。

图1 不同渍水时间对小麦根系生物量、根系体积和表面积的影响Fig.1 The effect of different waterlogging time on the root dry weight,root volume and root surface in wheat
2.1.3 渍水对小麦根系MDA含量和抗氧化酶活性的影响从图2可见:花后7~21 d 2个品种W3处理根系中MDA含量与W0无显著差异;花后7~21 d‘宁麦13’的W6和W9处理间根系中MDA含量差异不显著,但均显著高于W0。花后7 和14 d,‘皖麦52’的W6和W9处理根系中MDA含量显著高于W0,但在花后21 d,W6处理与W0差异不显著,W9处理根系中MDA含量显著高于W0。
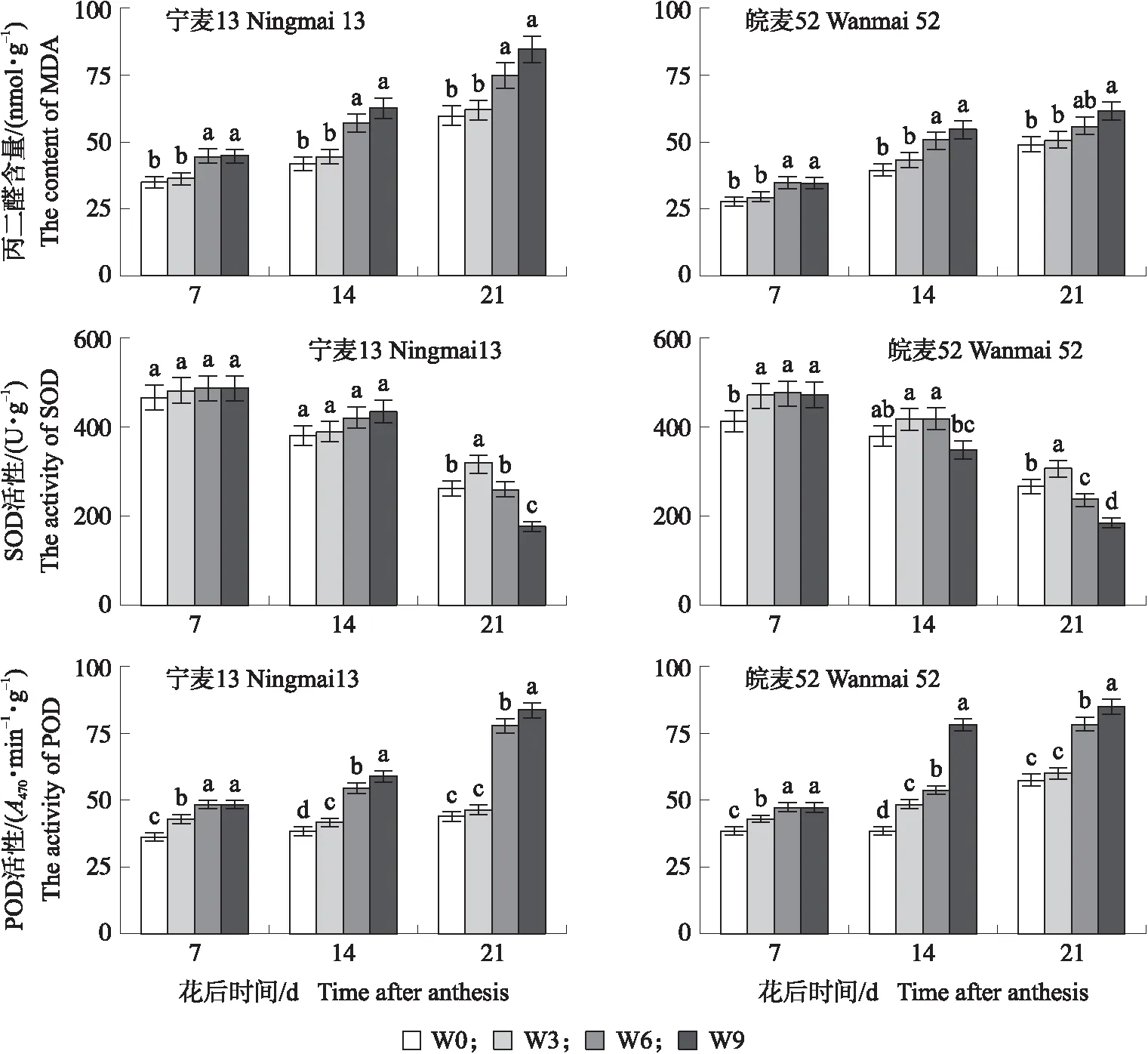
图2 不同渍水时间对小麦根系中MDA含量以及SOD和POD活性的影响Fig.2 The effect of different waterlogging stress time on the content of MDA and the activities of SOD and POD of root in wheat
花后7和14 d,各渍水处理2个品种根系中SOD活性增加,但与W0无显著差异;花后21 d,2个品种W3处理根系中SOD活性均显著高于W0,‘宁麦13’的W9处理和‘皖麦52’的W6和W9处理根系中SOD活性显著低于W0。表明花后渍水3 d 2个品种根系中SOD酶活性显著增加,而花后渍水6和9 d 2个品种根系中SOD活性降低(图2)。
渍水显著增加2个品种根系中POD活性,并随渍水时间的延长而增加。花后7、14和21 d,2个品种各渍水处理根系中POD活性均显著高于W0,但在花后21 d,2个品种W3处理根系中POD活性与W0差异不显著,而2个品种 W6和W9处理均显著高于W0,其中‘宁麦13’较W0增加77.41%和90.37%,‘皖麦52’增加36.78%和47.66%(图2)。
2.2 渍水对小麦成熟期干物质分配的影响
从表2可见:与对照组W0相比,W3处理对2个品种地上部干重无显著影响,而W6和W9处理的 2个品种地上部干重显著降低;W3处理对2个品种地上部各部分干重及其所占比例均无显著影响,而W6和W9处理显著降低2个品种的籽粒干重及其所占比例,显著提高穗轴+颖壳中干重所占比例;W6处理对‘宁麦13’的茎秆+叶鞘+叶片的干重无显著影响,W9处理中‘宁麦13’茎秆+叶鞘+叶片的干重显著降低,较对照组W0显著降低25.00%;W6和W9处理中‘皖麦52’的茎秆+叶鞘+叶片干重显著降低,较对照组W0分别降低20.34%和 26.62%。
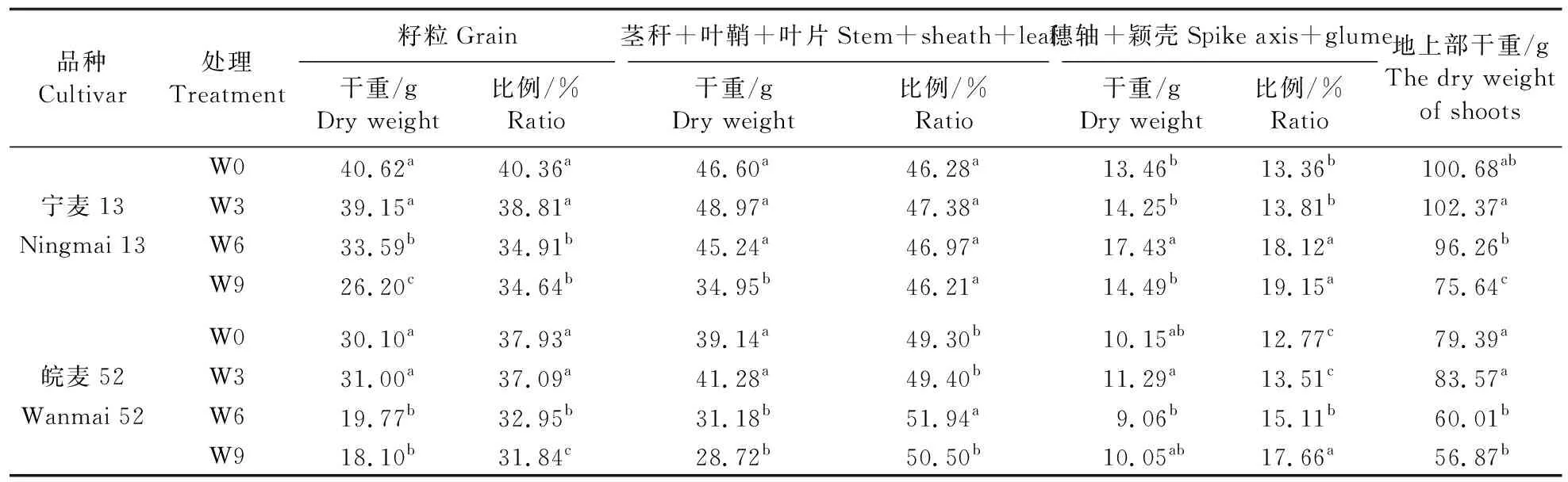
表2 不同时间渍水处理对成熟期小麦地上部每盆干物质分配的影响Table 2 The effect of different waterlogging stress time on dry matter distribution of shoots per pot in wheat at mature period
2.3 渍水对小麦产量及其构成因素的影响
从表3可见:不同时间的花后渍水对2个品种的穗数均无显著影响,但对其穗粒数、千粒重和产量的影响存在差异。开花后渍水对‘宁麦13’的穗粒数无显著影响,而W6和W9处理‘宁麦13’的千粒重和产量显著低于W0,产量降幅分别为17.31%和35.50%;W6和W9处理‘皖麦52’的穗粒数、千粒重和产量显著低于W0,产量降幅分别为34.32%和39.88%。
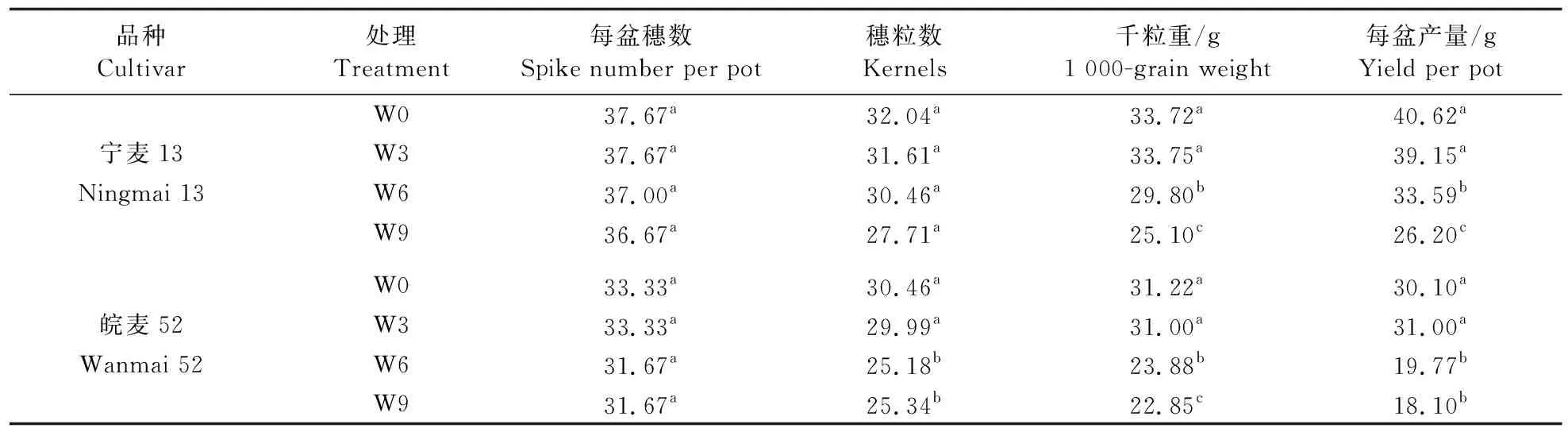
表3 不同时间渍水处理对小麦产量及其构成因素的影响Table 3 The effect of different waterlogging stress time on yield and its component factors in wheat
2.4 渍水条件下小麦根系生长发育与产量的关系
从图3可见:2个品种不同渍水处理(W0、W3、W6和W9)的成熟期产量与其在花后21 d时根系干重、根系体积和表面积呈显著线性正相关关系(R2分别为0.982 1、0.882 6和0.973 4),产量随根系干重、体积和表面积的增加而升高。在本试验条件下,小麦根系干重、体积和表面积的增加对提高产量具有重要作用。

图3 花后21 d不同渍水处理小麦根系生长发育与成熟期产量的关系Fig.3 The relationship between yield and the root growth in wheat of 21 days after anthesis under different waterlogging treatments
3 讨论
3.1 渍水对小麦根系形态生长的影响
渍水导致植株根系处于无氧条件,抑制根系生长发育,同时加速其衰老。Shao等[16]在小麦分蘖期和 拔节期分别进行渍水处理3 d,保持地表水深0.5~1.0 cm,2个处理组小麦根长和根鲜重均显著降低。在小麦生长21 d时,渍水处理14 d显著降低了根长、根系相对生长率、单株次生根数量和总次生根长[17]。本研究发现,W6和W9处理2个小麦品种的根系总长和平均直径显著降低,同时与未渍水对照组相比,渍水处理加快了2个品种根系总长的降低,抑制‘宁麦13’根系平均直径的增粗,促进‘皖麦52’根系平均直径的萎缩;W6和W9处理2个品种的根系干物质、根系体积和表面积显著降低;小麦根系干重、根系体积和表面积与产量呈显著线性正相关关系,可见小麦灌浆中后期根系形态显著影响籽粒产量。
3.2 渍水对小麦根系抗氧化酶活性的影响
在渍水条件下,植物体内会产生大量活性氧自由基,破坏细胞内大分子物质及细胞膜透性,其中丙二醛含量能够反映植物遭受逆境伤害的程度。超氧化物歧化酶(SOD)和过氧化物酶(POD)能够缓解逆境对植物造成的伤害。研究发现,渍水显著增加根系中MDA含量,但对根系中SOD活性变化的影响存在差异,在小麦孕穗期渍水处理20 d,小麦根系中SOD活性随着渍水时间的增加而逐渐降低[18];在小麦拔节期至开花后20 d进行渍水处理,在渍水前15 d时,根系中SOD活性显著高于未渍水对照组,但随着渍水时间的延长根系中SOD活性不断下降,在花后5 d时,根系中SOD活性显著低于未渍水对照组[19]。本研究发现,W6和W9处理根系中MDA含量显著高于W0,灌浆中后期的SOD活性显著低于W0,与前人研究结果相似。而W3处理根系中MDA含量与W0差异不显著,灌浆中后期SOD活性显著高于W0,这可能是由于W3渍水时间较短,对小麦损害较小,促进小麦抗逆性提高。在小麦生育前期(苗期、拔节期和孕穗期)进行渍水处理能够显著提高根系中POD活性,而灌浆期渍水则显著降低POD活性[11]。在本研究中,W3、W6和W9均显著提高小麦根系的POD活性,与前人研究结果存在差异,这可能由于本试验渍水时间较短,能够引起小麦的抗性,而较长时间渍水处理对小麦造成较大伤害,降低其耐渍能力。
3.3 渍水对小麦干物质分配及产量的影响
渍水能够诱导植株叶片气孔关闭,影响其光合作用,使干物质合成减少。在小麦拔节期和开花期渍水处理地上部干物质积累量显著低于未渍水对照[20]。在小麦孕穗期和灌浆期渍水处理降低小麦根系、叶片、茎鞘和穗部的干物质积累,增加茎鞘和叶片的干物质分配比例,在灌浆期渍水还减少穗部的干物质分配比例[21]。本研究中,花后渍水降低成熟期小麦籽粒和茎叶中干物质的积累,渍水显著降低籽粒中干物质的分配比例,显著提高穗轴和颖壳中干物质分配比例,而对茎秆+叶鞘+叶片中干物质分配比例无显著影响。这与胡继超等[21]研究灌浆期渍水增加了茎鞘和叶片中干物质分配比例的结论存在差异,这可能与试验中设置渍水时间的长短或者供试小麦品种存在差异有关。
渍水对小麦产量及其构成因素的影响存在差异。花后渍水对小麦穗数无显著影响,但却显著降低穗粒数、千粒重和籽粒产量[22-24]。有研究指出,穗粒数取决于孕穗前期的穗分化过程,因此,小麦生长后期(灌浆期)发生渍害胁迫对穗粒数的影响较小,未达到显著水平[25]。本研究结果表明,W3处理对2个小麦品种产量及其构成要素没有显著影响;而W6和W9处理对2个品种的穗数无显著影响,但千粒重和产量显著降低;对穗粒数的影响因品种不同而存在差异。
本研究中,花后渍水6 和9 d显著降低2个品种的根系总长、平均直径、根系干重、表面积、体积以及根系中SOD活性,显著增加小麦根系中MDA含量和POD活性,而花后渍水3 d显著增加2个品种根系中SOD性;花后渍水6和9 d显著提高穗轴+颖壳中干重所占比例,显著降低成熟期籽粒干重及其在地上部干重中所占比例,显著降低千粒重和产量。
