光周期对切花菊生长及开花的调控*
2021-07-28陆思宇杨再强
陆思宇,杨再强,2**
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2.江苏省农业气象重点实验室,南京 210044)
菊花为多年生宿根草本植物,在中国已有3000多年的栽培历史,作为世界四大切花之一,在切花消费中占有很大比重,被广泛应用于礼品观赏、庆典活动、殡葬祭奠等,仅日本每年需求量就有20多亿支,一年四季均有需求,消费高峰为3、8、9和12月[1]。在荷兰花卉拍卖市场销售的十大切花中,切花菊排名第二,仅次于玫瑰。国内外花卉市场对切花菊品质要求较高,切花菊茎秆长度在60cm以上,叶片大小适中,按叶序均衡排列,花瓣瓣质厚硬且瓶插寿命长。由于切花菊周年生产技术仍不成熟,使得中国切花生产仍停留在较低水平,主要问题有品质低下、不稳定、只能阶段出花[2]。
目前多利用光敏植物的光周期现象实现花卉的周年生产。光周期现象是指日照长短控制植物开花的现象,这对植物由营养生长转向生殖生长有重要作用。菊花为典型的短日光周期植物,其花芽分化对日照长度极其敏感,四季栽培需具备严格的遮光、补光措施。杨娜等研究表明,小于12h·d-1的短日照处理能促使菊花花期提前,花败育减少[3]。姚悦梅等研究发现,波斯菊以10h·d-1促花效果最佳,花期得到明显提前,但菊花生长状况一般[4]。短日植物的临界日长对植株开花与否有决定性作用,日照时数也会对植株的营养生长状况产生很大影响[5]。王彩侠等研究表明,部分光周期控制下的菊花由于营养生长严重不足,提早现蕾的多数有柳叶,出现花芽败育现象[6]。祁娟霞等通过研究不同补光时间对番茄生长发育的影响,发现番茄在7h·d-1的光照条件下幼苗生长最好但花期滞后,10h·d-1下促花最明显,但由于营养生长不足,品质较差[7]。由此可见,不同光照周期直接影响到光敏植物的生育进程,同化物仍主要用于营养生长时其成花代谢受阻,而在促花的同时也会在某种程度上影响植物的营养生长[6]。毛洪玉等研究也证实了这一点,切花型菊‘C029’在长日照条件下植株高度和叶片数均明显大于短日菊花,随着日照长度的缩短,花期提前但株高、茎粗、叶片数以及花径等均有不同程度的减小[8]。这使得通过光周期调控菊花的周年生产上,出现了初花期和出花品质间的矛盾,如何在将花期提前的同时,保证切花菊品质能达到市场标准从而抢占市场份额显得格外重要。切花品质与植株生长状况、可溶性糖以及蛋白等有机物的合成积累息息相关。可溶性蛋白包括酶蛋白和结构蛋白,均为植株形态、花器官建成的重要物质基础[9],而可溶性糖既是结构物质,也是能源物质[10],蔗糖更是作为一种可感知光周期信号的信使分子参与到植物的各种生命活动中[11]。
关于短日光周期处理对菊花的花期调控,以及不同光周期对菊花光合生长的研究较多,但均未系统设置不同短日、长日光周期,研究其对菊花生长及开花时间、发育品质的影响。因此,本研究以市场上较高需求量的菊花为试材,研究不同短日、长日光周期处理对菊花不同发育期叶片生长、花期、切花质量、糖蛋白及干物质分配等发育品质的影响,并据此针对不同发育期提出补光建议,以解决生产上初花期与出花品质间的矛盾。
1 材料与方法
1.1 试验材料
试验于2019年7-11月在南京信息工程大学农业气象试验站的温室(Venlo型)中进行。以菊花品种 ‘红面’(Hongmian)为试材,于2019年5月将菊花幼苗定植于口径为20cm的花盆中(每盆1株)进行常规培养,待菊花高度长至约35cm时,随机选取还未开始花芽分化且长势一致的植株进行光周期试验。
1.2 试验设计
试验采用黑膜遮光法,自2019年7月17日起,以黑色塑料膜作为遮光棚材料,按表1设置5个不同的光周期处理组,分别为昼/夜7h/17h(记为Ph7)、8h/16h(Ph8)、9h/15h(Ph9)、10h/14h(Ph10)和11h/13h(Ph11)。即每天8 :00打开Ph11的遮光膜接受自然光照,9 :00打开Ph10的遮光膜,10:00打开Ph9的遮光膜,11:00打开Ph8的遮光膜,12: 00打开Ph7的遮光膜,并于每日19:00统一盖上所有处理组的遮光膜,使其处于黑暗不透光状态。直至11月30日各处理植株均达盛花期(50%以上植株头状花序中部黄色雄蕊清晰可见)时试验结束。

表1 试验方案设计Table 1 Experimental design
以日照时长13~14h为对照(CK),每处理组10株。7-8月所有处理光源均为自然光,9-11月由于自然光照时长缩短,自然光照外的时段均采用生长补光灯进行人工补光。不同处理组除光照时长不同外,环境温度、光强及水肥管理措施均相同。
1.3 项目观测
1.3.1 发育时间和叶片数
分别记录不同处理现蕾(50%以上植株出现肉眼可见花蕾)、破蕾(50%以上植株花蕾顶部露白)、初花(50%以上植株头状花序最外轮花瓣外展)、盛花(50%以上植株头状花序中部黄色雄蕊清晰可见)时间,并记录下不同时期的叶片数。
1.3.2 可溶性总糖和蔗糖
采集不同发育期的菊花中部1~2g成熟叶片烘干后,取0.05g磨碎干样于80%乙醇中水浴保温30min,冷却离心,收集上清液于试管中,重复3次,收集三次上清液置于85℃恒温水浴,使乙醇蒸发至2~3mL,移至50mL容量瓶,以蒸馏水定容,供可溶性总糖与蔗糖含量的测定。每个处理取3株不同菊花叶片作为3个样品重复。可溶性糖含量的测定参考蒽酮比色法[12],用分光光度计(UV-1800,日本)在620nm下比色。
1.3.3 可溶性蛋白
可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[12]。称取不同发育期植株中部鲜样叶片1g,加入5mL水研磨成匀浆后,4000r/min离心20min,取上清液0.5mL于具塞试管中,加入5mL考马斯亮蓝G-250溶液,充分混合,放置2min后用分光光度计(UV-1800,日本)在595nm下比色。每个处理3个样品重复。
1.3.4 植株各器官干鲜重
每个处理取3株处于盛花期的菊花,将待测植株从茎基部截断,分离出花、叶、茎,将地下根部分洗净待水分自然风干,用精度为0.001g电子天平分别测定花、叶、茎、根各器官鲜重,然后105℃杀青10min,80℃烘干至恒重,分别测定各部分干重,并计算全株干重、根冠比,以及干物质在各器官的分配率。
其中,Wflower、Wleaf、Wstem、Wroot分别表示花、叶、茎、根干重。
1.4 数据统计分析
试验数据采用SPSS26进行单因素ANOVA方差分析及Duncan多重比较(α=0.05)。
2 结果与分析
2.1 光周期对切花菊生长及开花时间的调控
2.1.1 叶片数
由图1可知,苗期不同光周期处理组间叶片数差异较小,随着发育期的推进,现蕾期长日照CK叶片数以2倍速增加,Ph11、Ph10在破蕾期叶片数增加率远大于CK,不同处理组间在初花期和盛花期叶片数出现分层,且差异显著(P<0.05),表现为叶片数随光照时长的增加而增大,即CK最大,其次是Ph11,Ph7最小。不同处理叶片数的最大值间差异显著(P<0.05),达到最大值时的发育时期也有所不同。Ph7的峰值最小,仅有69片,CK叶片数峰值最大,可达174片,为Ph7的2.5倍,其次为Ph11、Ph10。Ph7、Ph8和Ph10均在破蕾期叶片数达到最大值,处理间差异显著(P<0.05),与试验初相比分别增加了1.5、1.6、2.1、2.7倍;Ph11和CK初花期时叶片数达到最大值,差异显著(P<0.05),较试验初分别增加了3.6和4倍。不同处理叶片数开始减少的时期也不同。Ph7、Ph8和Ph10均为初花期叶片数开始减少,处理间差异显著(P<0.05),与各自峰值相比分别减少了13%、9.2%、11.6%、5.9%,Ph11和CK至盛花期叶片数才开始出现减少,与最大值相比减少了14.1%和3.4%。可见,在辐射强度一致的情况下,每日光照时间越长,植株上叶片数越多,叶片随生育进程增加越快。每天少于8h光照处理均不利于叶片增加。
2.1.2 开花时间
由表2可见,不同光照周期可明显干预‘红面’菊花花期,菊花花蕾的形成、破蕾显色及花蕾发育快慢均与光照时间密切相关。Ph10处理下的菊花从现蕾、破蕾到初花形成均最快,Ph11次之。从初花期到盛花期以Ph11发育最快,仅用了2d,而Ph10用了16d。极短日光周期处理Ph7、Ph8与长日组CK‘红面’菊现蕾时间均远远迟于Ph10。Ph7、Ph8由于光照时间过少,前期营养生长不足,花蕾发育出现滞后现象。CK组菊花营养生长旺盛,但由于光照时间远大于其开花的临界日长,故花期也出现严重滞后现象。
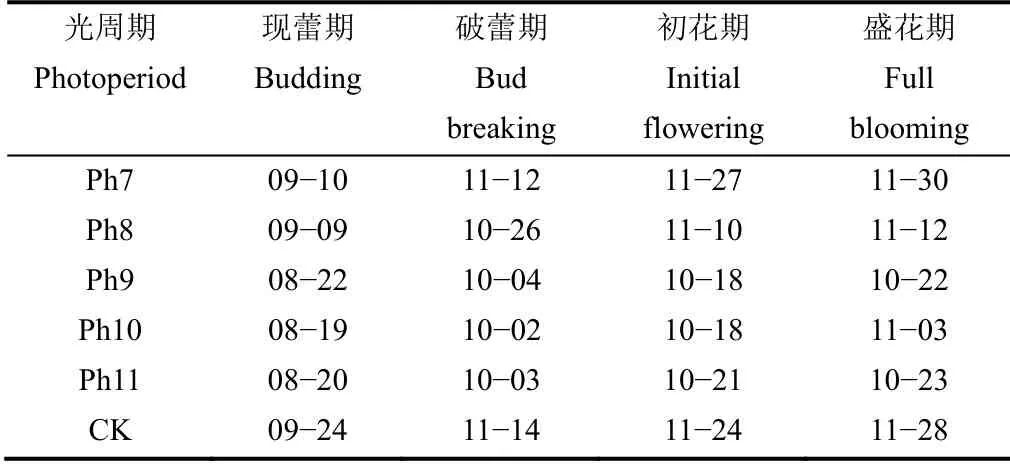
表2 不同光周期处理‘红面’菊花发育时间的比较(月-日)Table 2 Comparison of development time of ‘Hongmian’Chrysanthemum among different photoperiod treatments(mm-dd)
2.2 光周期对切花菊发育品质的调控
2.2.1 叶片可溶性糖含量
从图2可看出,菊花处于苗期时,叶片可溶性总糖含量较低,花芽分化时总糖含量达到峰值,之后不断下降,于开花前开始上升再次达到一个峰值后再次下降,整体呈“M”形趋势变化,说明花蕾的形成和发育与可溶性糖含量息息相关。开花前的第二次峰值大于花芽分化的第一次峰值,即从破蕾到显色成花消耗的可溶性糖含量较大。且短日处理组可溶性总糖的上升与下降幅度均大于CK,即短日照对菊花糖类物质合成与消耗的干预较大。
从可溶性总糖的绝对含量来看,CK整个生育期的可溶性总糖含量始终大于其余短日处理组,差异显著(P<0.05),Ph7始终最小,仅有CK的59%,其次为Ph8,说明光照时间显著影响叶片碳水化合物的合成。从菊花开始花芽分化到现蕾、破蕾,Ph11的可溶性总糖含量较大,其次是Ph10,与CK相比差异显著(P<0.05)。而从开花前的第二峰到初花期,Ph10的可溶性总糖含量则大于Ph11,二者差异显著(P<0.05)。盛花期时Ph11可溶性总糖含量较大,Ph10较小。说明Ph11在花蕾形成与花蕾完全绽放阶段糖代谢旺盛,Ph10在花蕾初绽时可溶性糖代谢合成增多。
由图3可知,不同生育期蔗糖含量也呈双峰“M”形变化,与可溶性总糖的变化趋势相比,蔗糖的峰值变化幅度更大,特别是开花前的第二峰。同样地,Ph7处理整个生育期的蔗糖含量始终最小,其次为Ph8。光诱导期和花芽分化启动期Ph10的蔗糖含量为继CK后的最大值,其次是Ph11。开花前Ph10蔗糖含量急剧上升,远大于CK。到达盛花期时,Ph10急剧下降,成为继Ph8后的最小值,并以Ph11的蔗糖含量较高。
2.2.2 叶片可溶性蛋白含量
由图4可知,菊花叶片不同发育期可溶性蛋白含量与上述可溶性糖含量变化趋势基本一致。叶片可溶性蛋白含量呈“M”形变化,两次峰值均出现在花芽分化期和开花前,现蕾、破蕾、初花以及盛花期可溶蛋白含量均不断下降,且开花前的第二峰值大于花芽分化时的第一次峰值,即从破蕾至显色成花消耗的可溶性蛋白含量较大。Ph10整个生育期的可溶性蛋白含量始终最大,其次是Ph11,且均大于CK,说明适宜的短日处理可诱导菊花叶片中可溶性蛋白含量的提高。Ph7始终最小,峰值时也仅有CK的51.4%。
2.2.3 干物质积累与分配
由表3可见,不同光周期照射下菊花成品各器官鲜重及其在各器官间的分配占比存在明显差异,其中光照时间缩短11h(即Ph11)花朵质量最高,平均每朵花达到11.54g,茎的质量也最大,花朵和茎重分别占全株总质量的17.66%和38.78%。随着日照时间的缩短,各处理花朵和茎的质量逐渐减小,其中缩短到10h(即Ph10),平均每朵花鲜重为5.04g,仅有Ph11的43.67%,二者差异达显著水平(P<0.05)。当日照时间继续缩短到8h(即Ph8)和7h(即Ph7)时,花朵和茎的质量显著减小,与Ph11相比差异均达显著水平(P<0.05)。其中Ph7的花鲜重为0.65g,仅有Ph11的5.63%,茎鲜重为11.98g,占全株总质量的45.59%。可见,不同光周期处理会显著干扰切花菊花朵质量,以Ph11切花质量最佳,Ph7和Ph8的花朵质量最差,因此出现短日组Ph7、Ph8茎重占全株质量占比较高。
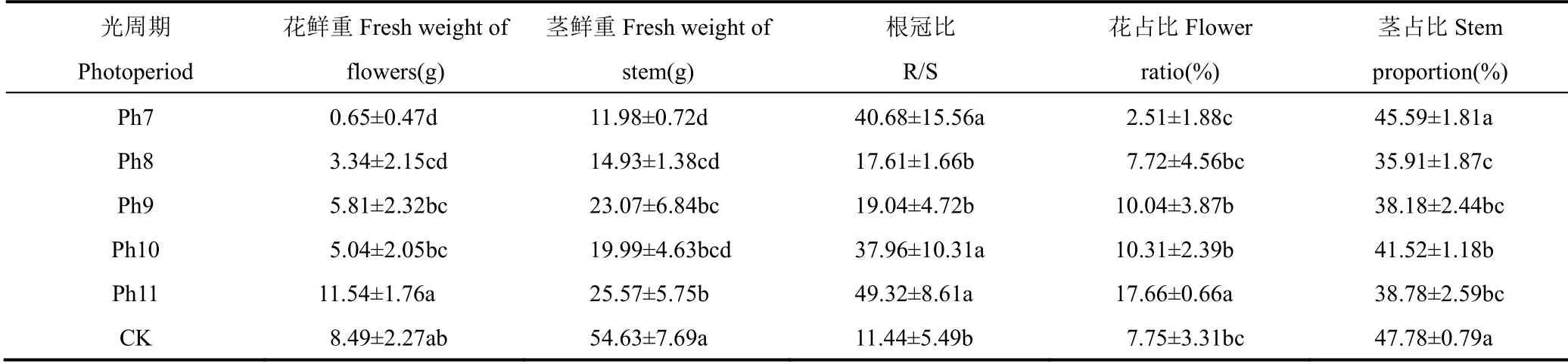
表3 不同光周期处理盛花期各器官鲜重和占比的比较Table 3 Comparison of fresh weight and proportion of organs at full blooming stage under different photoperiod treatments
进一步计算不同处理间各器官干物质的积累和分配情况,结果见表4。由表可见,Ph7、Ph8和Ph10干物质在各器官的分配率表现为茎>叶>根>花,Ph11则为茎>叶>花>根,即Ph11的促花效果最佳。CK干物质在茎、根的分配率远大于其他短日处理组,茎分配率可达57.89%(P<0.05),即长日照CK菊花营养生长状况最佳。干物质在叶片的分配率则以Ph7最大,从大到小依次为Ph8、Ph9、Ph10、Ph11,CK最小,即随着光照周期的延长,干物质在叶片的分配率不断减小,CK在叶片的分配率仅为Ph7的57.96%(P<0.05),随着光照时间的缩短,菊花生理活动集中于促叶生长。干物质在花的分配率以Ph11最大,为CK的2.52倍(P<0.05),其次是Ph10,Ph7最小,仅有Ph11的16.39%(P<0.05),充分说明了Ph11的促花效果显著。

表4 不同光周期处理盛花期各器官干物质分配率(%)的比较Table 4 Comparison of dry matter distribution rate ( % ) in different organs at full blooming stage under different photoperiod treatments
3 结论与讨论
3.1 讨论
秋菊属于短日光周期作物,日照长度直接影响植株的花芽分化和小花发育进程,临界日长为12h·d-1[13],促花栽培需小于临界日长,胡晓龙等研究表明,在大于12h·d-1的长日照条件下菊花维持着旺盛的营养生长,花期延迟但植株生长状况最佳[14],本试验结果与之相符。本研究中长日照下的‘红面’菊从定植到现蕾耗时最长,但由于光照时间得到保证,植株营养生长旺盛,叶片数始终且远大于其余短日处理组,CK叶片可溶性总糖、干物质在地上地下部的积累量均最大,光周期可直接影响植株的营养生长状况。
糖类化合物的合成积累更是与植株的花芽发育过程密切相关[15]。试验初所有短日处理组的可溶性总糖、蛋白含量均较低,经一段时间的光诱导,菊花开始花芽分化,叶片中可溶性总糖与蛋白含量急剧上升达到峰值,以Ph10最大,Ph11次之,说明短日处理诱导了植株体内碳水化合物、氨基酸类物质的快速合成,促花越快的处理,其合成量越大。现蕾、破蕾期糖含量不断降低,说明花蕾发育与糖蛋白含量变化息息相关。开花前急剧上升再次达到峰值,初花期和盛花期均不断下降,仍以Ph10为最大,说明可溶性糖、蛋白为小花发育的物质基础,小花的形成与发育需不断消耗糖蛋白。李兴军等[16-17]分别在杨梅和菊花上的研究都表明花芽分化前叶片中的碳水化合物含量快速增加,张翠华等[18]发现经光周期处理启动花芽分化的菊花,叶片可溶性糖含量表现为先增加后降低的趋势,李月华等[19]对紫丁香花芽分化过程的研究中,可溶性蛋白含量也呈先增后降的趋势,本研究结果均与其一致。
缩短日照长度有助于加快短日光敏植物的花芽分化进程并使其提前开花。汪菊渊等[20]研究表明,Ph10光周期下的菊花从处理到成花所需时间最短,本试验结果与之相符。蔗糖作为可感知光周期信号的信使分子,本试验结果表明光诱导期、花芽分化期和开花前Ph10叶片蔗糖含量为所有短日处理中的最大值,说明Ph10为最先感应到光周期信号并作出开花响应的处理。可溶性蛋白作为植物成花过程的关键要素及重要物质基础[21],Ph10的可溶蛋白含量始终保持最大。但在花芽分化物质储备期Ph10的可溶性总糖含量较小,生殖生长需要得不到充分满足,导致盛花期时干物质在花的分配率最小,Ph10菊花从最外轮花瓣展开的初花期,到花瓣全展开的盛花期耗时过长,远大于Ph11。
而Ph11的生长状况较好,叶片数为继CK后的最大值,可溶性总糖含量在花芽分化、现蕾、破蕾以及盛花期均仅次于最大值CK,根冠比、干物质在花的分配也较大,根冠比是衡量植物健康与否的重要标准,说明Ph11菊花营养生长状况较好。贾探民等的研究表明,Ph11光照条件下的菊花开花期晚于Ph10[22],本试验结果与其相符,Ph11从光周期处理到现蕾成花均晚于Ph10,但由于Ph11菊花营养生长状况较佳,从初花到盛花耗时较短。Ph7、Ph 8处理下的菊花因日照时数过短,光照条件不能满足生长需求,营养生长状况极差,这与先前研究结果一致,Ph7、Ph 8叶片光合色素含量最低,光合能力也表现为最差[23]。Ph7、Ph8不管是叶片数还是可溶性总糖、蔗糖、可溶性蛋白含量在整个生育期均为最小值,地上地下部的干物质量也最小,植株的营养生长状况会直接影响生殖生长的进行,本试验结果与朱玲俐等的研究结果一致,Ph7、Ph 8的切花菊花期最晚且切花品质极差[24],因干物质总量最小且所有营养均主要用于叶片生长,因此干物质在叶的分配率以Ph7、Ph8最大。
3.2 结论
(1)不同发育期菊花叶片数均随光照时长的增加而增加。以长日照处理组CK、Ph11的叶片增加速率最大,Ph10次之,Ph7最小。
(2)不同光周期处理可显著干预‘红面’菊花的花期。Ph10从光周期处理到菊花现蕾、破蕾、成花均耗时最短,Ph11次之,但Ph11从初花发展到花瓣全展开的盛花期耗时最短,Ph7、Ph8和长日照组CK的菊花花期严重滞后。
(3)光照时间显著影响‘红面’菊花叶片碳氮化合物的合成与消耗。可溶性总糖以保持旺盛营养生长的CK最大,Ph11次之;与花芽分化密切相关的可溶性蛋白、蔗糖含量以Ph10最大。
(4)花鲜重以Ph11最大。从切花质量角度分析,Ph11的促花效果最显著。
综上所述,在对菊花进行短日照促花前,为最快地抢占市场份额,得到满足市场要求的高品质切花菊,处理前应保证菊花已进行充分的营养生长,根据栽培目的的不同采取不同的补光措施。在苗期应保证大于Ph11即大于11h·d-1的长日照条件,以保证菊花植株能进行充分的营养生长而不会诱发花芽分化,随之对其进行Ph10即10h·d-1的短日照促花处理,花蕾形成且开始初绽显色后,花芽分化已不可逆,此时可将其置于Ph11下正常开花,且可最快达到花瓣全绽放的盛花期。
本研究结论适用于秋菊品种‘红面’,且本试验仅从生长、开花以及糖蛋白角度研究了不同光周期对切花菊的影响,关于与花芽分化密切相关的内源激素、保护酶等随花期的变化还有待进一步研究。
