不同来源寡聚-1,6-葡糖苷酶异源表达及酶学特性
2021-07-26王永红
华 烨, 刘 鹏, 王永红
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
凝结芽孢杆菌(Bacillus coagulans)是一种兼性厌氧革兰氏阳性菌,具有耐高温、耐酸、稳定性好、抗逆性强等优点[1],在工业发酵中主要用来生产L-乳酸。相比于其他生产菌株,凝结芽孢杆菌的发酵温度更高,不易染菌,且发酵工艺较简单[2],并可以利用一些廉价碳源作为底物原料。但目前在以玉米粉/淀粉水解液为底物的凝结芽孢杆菌生产乳酸的工业发酵过程中,发酵结束时会有较高浓度的残糖[3],这会使得糖酸转化率下降,并导致乳酸分离纯化过程费用增加、产品质量下降以及货架期缩短。在乳酸发酵液残糖中,异麦芽糖质量占残糖总质量的60%左右,而寡聚-1,6-葡糖苷酶(oligo-1,6-glucosidase,EC 3.2.1.10)对于异麦芽糖有较高的利用活性。
寡聚-1,6-葡糖苷酶也称异麦芽糖酶或糊精6-α-D-葡萄糖水解酶[4-5],是一种外切酶,可以从多糖的非还原性端催化水解α-1,6-糖苷键,如α-极限糊精、异麦芽糖、异麦芽糖酮糖、异麦芽三糖等,同时也能水解对硝基苯-α-D-葡萄糖苷(pNPG)生成葡萄糖苷和对硝基苯酚(pNP)[6]。不同细菌来源的寡聚-1,6-葡糖苷酶的酶学性质有所差异,为了水解凝结芽孢杆菌乳酸发酵残糖液中的异麦芽糖,要求酶具有较好的耐热性和耐酸性。关于酶的热稳定性,Suzuki 等[4]和Watanabe 等[7]提出了脯氨酸法则,在氨基酸序列中脯氨酸含量的增加会使得每个区域结构更加紧密稳定以及疏水性更强,从而提高蛋白的热稳定性。研究人员将蛋白中的氨基酸残基定点诱变为脯氨酸后增加了蛋白的热稳定性,在一定程度上支持了脯氨酸法则,如Matthews 等[8]将β-转角的丙氨酸定点突变为脯氨酸后提高了噬菌体T4 溶菌酶的热稳定性,但需要更多实验依据来验证脯氨酸的普适性。
基于前期研究工作并经BRENDA 数据库搜索挑选了5 个可能耐温、耐酸的寡聚-1,6-葡糖苷酶基因,分别是凝结芽孢杆菌(Bacillus coagulans)ATCC 7050中的malL BF29_2011(BC1)和malL BF29_2004(BC2)、枯草芽孢杆菌(Bacillus subtilis)168 中的 malL yvdL BSU34560(BS1)和yugT BSU31290(BS2)以及嗜热葡萄糖苷地衣芽孢杆菌(Bacillus thermoglucosidasius)KP 1006 中的malL(KP)。其中Bacillus coagulansATCC 7050 适 合 的 生 长 温 度 为37~50 ℃,BC1 和BC2 的脯氨酸摩尔分数分别为4.32% 和4.80%;Bacillus subtilis168 适合生长温度为37 ℃,BS1 和BS2 的脯氨酸摩尔分数分别为4.10% 和4.33%,Bacillus thermoglucosidasiusKP 1006 适 合 生 长 温 度 为55~60 ℃,KP 的脯氨酸摩尔分数为5.69%。可见KP 的脯氨酸摩尔分数最高,BC1、BC2、BS1 和BS2 的脯氨酸摩尔分数较为接近,其中BS1 的脯氨酸摩尔分数最低。
寡聚-1,6-葡糖苷酶属于α-淀粉酶GH13 家族,其结构与其他α-淀粉酶结构相似,其在CSR V 中的序列是QPDLN[9-10],是能够区分GH13 家族中的寡聚-1,6-葡糖苷酶和普鲁兰酶的关键区域[11]。对比BC1、BC2、KP、BS1、BS2 在CSR V 以及CSR Ⅱ的氨基酸序列,BC2 在CSR V 的 序 列 是MPDLN,BC2 和BS2 在CSR Ⅱ的序列中也含有中介酶特异性残基,可推断BC2 以及BS2 基因所表达的酶是中介酶。
目前关于寡聚-1,6-葡萄糖苷酶的研究,主要是将来源于蜡样芽胞杆菌、枯草芽孢杆菌等的寡聚-1,6-葡糖苷酶在大肠杆菌[12]、酿酒酵母毕赤酵母中[13]进行异源表达。寡聚-1,6-葡糖苷酶在大肠杆菌中的表达水平较低,因此蛋白纯化难度较高。随着基因工程的发展,大肠杆菌pET 表达系统开始得到广泛应用,它是一种可以使用乳糖或乳糖类似物进行诱导的高效表达系统,同时可以为外源目的基因带上纯化标签进行融合表达,是一种强大有效、应用极广的克隆及表达重组蛋白的系统[14]。其中,pET-22b(+)是大肠杆菌在pET 表达系统中常用的一种高表达载体,且带有T7 启动子、His 亲和标签以及多克隆位点,可以在宿主E. coliBL21(DE3)中高效表达不同来源的寡聚-1,6-葡糖苷酶,并满足蛋白纯化和酶活性研究的需求。
本文对不同来源的寡聚-1,6-葡糖苷酶进行酶学性质的特性比较研究,可为今后乳酸发酵用凝结芽孢杆菌的基因工程改造和高效菌株融合筛选奠定基础,并有效降低乳酸发酵后期的残糖浓度。
1 实验部分
1.1 原料和试剂
Bacillus coagulansATCC 7050,E. coliBL21(DE3),E. coliDH5α:均由本实验室保藏;Bacillus subtilis168:美国ATCC 细胞库;Bacillus thermoglucosidasiusKP 1006:中国普通微生物菌种保藏管理中心;pET-22b(+):由本实验室保藏;酵母膏、蛋白胨、琼脂:生化试剂,上海凌峰化学试剂有限公司;异丙基-β-D-硫代半乳糖苷(IPTG):生化试剂,上海碧云天有限公司;pNPG:w> 99%,西格玛奥德里奇(上海)贸易有限公司;限制性内切酶:宝日医生物技术有限公司;细菌基因DNA 抽提试剂盒、AxyPrep DNA 凝胶回收试剂盒:爱思进生物技术有限公司;One Step Cloning Kit:南京诺唯赞生物科技股份有限公司;PAGE 凝胶快速制备试剂盒(10%):上海雅酶生物医药科技有限公司;Ni-NTA 6FF 蛋白纯化预装柱(5 mL):上海翊圣生物科技有限公司。
1.2 测试与表征
高速冷冻离心机(德国Hermle 5 418):4 ℃离心;超声破碎仪(美国Qsonica Q500):工作时间10 min,超声3 s,暂停7 s,振幅34%;蛋白电泳槽(BIO-RAD Laboratories 165-800):浓缩胶操作电压80 V,分离胶操作电压120 V;核酸定量仪(Thermo Scientific ND2000/2000c):在280 nm 下检测核酸浓度,在205 nm下检测蛋白浓度;96 孔酶标仪(Thermo Scientific Varioskan lux):在405 nm 下检测对硝基苯酚的浓度。
1.3 实验步骤
1.3.1 培养基配制 LB(Luria-Bertani) 液体培养基(g/L)[15]:蛋白胨10,酵母膏5,氯化钠10,pH 为7.0;LB 固体培养基:在液体培养基基础上再添加18 g/L的琼脂,用于E. coliDH5α、E. coliBL21(DE3)、Bacillussubtilis168、Bacillus thermoglucosidasiusKP 1006 的培养。将LB 培养基用盐酸溶液调节pH 为5.0,用于Bacillus coagulansATCC 7050 的培养。
1.3.2 菌体培养 按照Bacillus coagulansATCC 7050 的培养温度为50 ℃,Bacillus thermoglucosidasiusKP 1006 的培养温度为55 ℃,Bacillus subtilis168、E. coliDH5α、E. coliBL21(DE3)的培养温度为37 ℃进行培养。首先将冻存于-80 ℃的细菌融化后,在无抗性LB 固体平板上划线倒置培养12~14 h,挑取单菌落接种于4 mL液体LB 培养基中,220 r/min 条件下振荡培养。
1.3.3 构建不同来源寡聚-1,6-葡糖苷酶表达系统
(1)提取Bacillus coagulansATCC 7050、Bacillus subtilis168、Bacillus thermoglucosidasiusKP 1006 基因组。将3 株菌在LB 液体培养基中培养至光密度(OD600)值达到1~2,再取2 mL菌液使用Takara 细菌基因组DNA 小量纯化试剂盒提取基因组,具体操作按试剂盒内说明书进行。
(2)聚合酶链式反应(PCR) 扩增目的基因。分别以3 株菌的基因组为模板,利用PhantaTM高保真DNA 聚合酶扩增出BC1、BC2、BS2、BS1 和KP 5 个基因(BC1(NedI)-F/BC1(HindIII)-R、BC2(NedI)-F/BC2(HindIII)-R、BS1(NedI)-F/BS1(HindIII)-R、BS2(NedI)-F/BS2(HindIII)-R、KP(NedI)-F/ KP(HindIII)-R),引物具体碱基序列见表1。PCR 扩增条件:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火10 s,72 ℃延伸1.5 min,进行35 个循环;72 ℃彻底延伸5 min。PCR 扩增产物经1%(质量分数,下同)琼脂凝胶电泳鉴定为目的基因后,使用Axygen 胶回收试剂盒进行片段回收。

表1 不同来源寡聚-1,6-葡糖苷酶基因PCR 扩增上下游引物设计Table 1 Primers of different oligo-1,6-glucosidase genes for PCR amplification
(3)构建表达载体。将质粒pET-22b(+)用NedI和HindIII 两种限制性酶双酶切,经1%琼脂凝胶电泳鉴定后,使用Axygen 胶回收试剂盒进行片段回收,得到目的基因片段和载体酶切片段。使用ClonExpress®试剂盒进行重组连接,挑取阳性转化子送上海生工生物工程股份有限公司测序。
1.3.4 重组蛋白异源表达及制备样品 采用热激法将经过测序验证碱基序列正确的重组质粒转化到E. coliBL21(DE3)中获得相应重组菌。挑取单菌落于10 mL含50 μg/mL 氨苄的LB 液体培养基中,37 ℃、220 r/min振荡培养12~14 h 至OD600达到4 左右时,按照2.5%的接种量接种至LB 液体培养基中,使得初始OD600为0.1,于37 ℃、220 r/min 条件下振荡培养1.5 h 至OD600达到0.5~0.8,加入IPTG(终浓度为0.3 mmol/L),于20 ℃、220 r/min 条件下诱导表达重组蛋白。将菌液倒入预冷离心管中取样,8 000g、4 ℃下离心收集菌体,用去离子水和1×PBS(磷酸盐缓冲液)各清洗一次,最后用1×PBS 缓冲液重悬菌体,置于冰上进行超声破碎,至液体澄清透明则破碎完全。破碎后样品于8 000g、4 ℃下离心15 min 后分别收集上清和沉淀,上清液为蛋白表达液,沉淀用1×PBS 缓冲液重悬,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)检测重组蛋白的表达情况。
1.3.5 重组蛋白分离纯化 重组蛋白带有His 亲和标签,使用Ni-NTA 蛋白纯化预装柱进行纯化。低咪唑上样,再用浓度为100、150、200、250 mmol/L 的咪唑依次梯度洗脱,确定最适浓度咪唑洗脱的方式进行纯化。纯化蛋白超滤浓缩后经SDS-PAGE 分析,并使用核酸定量仪在205 nm 处测定蛋白浓度。
1.3.6 寡聚-1,6-葡糖苷酶活性检测 通过酶标仪检测pNPG 在寡聚-1,6-葡糖苷酶作用下水解生成的pNP 在405 nm下的吸光度来测定寡聚-1,6-葡糖苷酶的酶活。分为实验组和对照组,每个反应按200 μL体积加样,并做3 个平行。实验组先加入131.4 μL浓度为50 mmol/L 的pNPG 缓冲液,再加入11.5 μL蛋白溶液,在特定温度下孵育一定时间后加入57.1 μL浓度为0.3 mol/L 的Na2CO3溶液终止反应,测定405 nm处的吸光度。对照组则加入高温灭活后的蛋白溶液。一个酶活单位(1U)定义为在最适条件下,1 min内水解产生1 mmol pNP 的酶量。
1.3.7 不同来源寡聚-1,6-葡糖苷酶酶学特性
(1)最适pH 及pH 稳定性。将不同来源寡聚-1,6-葡糖苷酶分别置于不同pH 和缓冲液(pH 4.0~6.0,100 mmol/L CH3COOH-CH3COONa 缓冲液;pH 6.0~8.0,100 mmol/L Na2HPO4-NaH2PO4缓 冲 液;pH 7.0~9.0, 50 mmol/L Tris-HCl 缓 冲 液) 配 制的pNPG 溶液中检测酶活,并分别置于各自最适pH 的缓冲液中,4 ℃静置,在3、6、9、12、15 h 取样检测残余酶活。
(2)最适温度及热稳定性。在各自最适pH 下,测定不同来源寡聚-1,6-葡糖苷酶在30~64 ℃的活性。在最适条件下孵育一定时间后,测定在最适条件下的残余酶活。
(3)离子对酶活影响。参考培养基常用添加成分选取测试离子,检测Ni+、Zn2+、Cu2+、Co2+、Ca2+、Mg2+、K+、 N H+4对于酶活的影响,分别在缓冲体系中添加NiSO4、ZnSO4、CuSO4、CoCl2、CaCl2、MgSO4、KCl、(NH4)2SO4溶液(终浓度为5 mmol/L),以不添加金属离子的体系作为参照,在最适条件下测定酶活。
(4)测定酶动力学参数。在各自最适条件下,测定酶在不同浓度(0.46、0.92、1.84、2.76、3.68、4.60 mmol/L)pNPG 底物下产生pNP 的速率,利用Microsoft Excel 2016 基于Michaelis-Menten 公式进行非线性规划求解,得到动力学参数Vmax和Km,转换数Kcat根据公式Kcat=Vmax/[E]求解(其中[E]为酶的浓度),催化效率根据Kcat/Km计算获得[16]。
(5)分析底物特异性。参考乳酸发酵液中的残糖成分选取测试对象。用缓冲液配制质量浓度均为2 g/L 的麦芽糖、异麦芽糖、蔗糖、乳糖、海藻糖以及可溶性直链淀粉的底物溶液,通过检测水解产物葡萄糖的浓度来分析不同来源寡聚-1,6-葡糖苷酶的底物特异性。
2 结果与讨论
2.1 不同来源寡聚-1,6-葡糖苷酶基因克隆
以各细菌的基因组为模板,根据基因组序列分别设计相应的引物扩增目的基因。BC1、BC2 扩增长度为1 665 bp 和1 689 bp,KP 扩增长度为1 686 bp,BS1、BS2 扩增长度为1 683 bp 和1 662 bp。质粒pET-22b(+)经NedI 和HindIII 限制性内切酶双酶切后得到线性片段,片段长度为5 382 bp。各片段的1%琼脂糖凝胶电泳结果如图1 所示,可见长度符合预期。

图1 BC1、BC2、KP、BS1、BS2 基因PCR(a)和pET-22b(+)双酶切(b)结果Fig. 1 Results of PCR amplification of the BC1, BC2, KP, BS1 and BS2 gene (a) and double enzyme digestion of pET-22b(+) (b)
线性化质粒载体和扩增目的基因片段经一步克隆酶连接后转化至E.coliDH5α 中,并涂布于含有氨苄(50 μg/mL)的抗性平板上。挑取转化子菌斑,用pET-22b(+)质粒上选择的克隆位点上下游引物YZF/YZ-R(序列见表1)进行菌落PCR 验证阳性转化子。阳性转化子进行进一步的测序验证,若测序序列与插入目的基因序列一致则表明重组质粒构建成功。
2.2 不同来源寡聚-1,6-葡糖苷酶异源表达与纯化
图2 所示为5 种寡聚-1, 6-葡糖苷酶表达情况及纯化结果。由图2(f)可见,E. coliBL21(DE3)和含空载质粒pET-22b(+) 的菌表达的蛋白大致相同,在IPTG 诱导前后总蛋白没有差异,且在66.2 kDa 大小附近没有明显条带,说明宿主菌本身和含有空载质粒的菌株不表达重组蛋白。
将构建好的pET-BC1、pET-BC2、pET-KP、pETBS1 和pET-BS2 分别转入到E. coliBL21(DE3) 中获得各个转化菌株,并进行IPTG 诱导表达。各重组菌在IPTG 诱导前和诱导后取样,菌体经超声破碎后获得总蛋白液,离心后获得上清液和沉淀,进行SDSPAGE 蛋白凝胶电泳分析。
比较对照组和各重组菌,以及各重组菌IPTG 诱导前的菌体总蛋白(图2(a)~2(e) Lane 1)和诱导后的总蛋白(图2(a)~2(e) Lane 2),各重组菌诱导后的总蛋白中含有目的重组蛋白(BC1:66.2 kDa;BC2:

图2 5 种寡聚-1,6-葡糖苷酶表达及纯化Fig. 2 Expression and purification of five oligo-1,6-glucosidases
66.6 kDa;KP:67.7 kDa;BS1:67.3 kDa;BS2:65.3 kDa),说明诱导表达成功,且在沉淀和上清液中都存在目的重组蛋白。上清液流经镍柱后,目的重组蛋白亲和吸附于镍柱上,依次用含100、150、200、250 mmol/L咪唑的洗脱液进行洗脱,在含100 mmol/L 咪唑的洗脱液中有较多杂蛋白(图2(a)~2(e) Lane 5),在含150 mmol/L 咪唑的洗脱液中得到单一的纯化蛋白(见图2(a)~2(e) Lane 6),将用含150 mmol/L 咪唑的洗脱液洗脱并超滤浓缩得到的目的重组蛋白进行酶学特性检测。
2.3 不同来源寡聚-1,6-葡糖苷酶酶学特性
2.3.1 最适pH 及pH 稳定性 在pH 4.0~9.0 范围内,5 种寡聚-1,6-葡糖苷酶的pH-相对酶活曲线如图3 所示。当pH=4.0 时,5 种寡聚-1,6-葡糖苷酶的相对酶活都在20%~30% 之间,酶活较低。当pH=5.0 时,BC1、BC2、KP 的相对酶活为100%。当pH=6.0 时,BS1、BS2 的相对酶活(CH3COOH-OH3COONa 缓冲液中)达到100%。随着pH 的升高,各个寡聚-1,6-葡糖苷酶的相对酶活都显著下降。BC1、BC2、KP 的最适pH 为5.0,BS1、BS2 的最适pH 为6.0。因此,5 种寡聚-1,6-葡糖苷酶在碱性环境下酶活较低,都属于酸性酶。
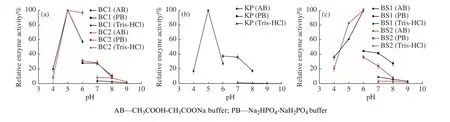
图3 5 种寡聚-1,6-葡糖苷酶的最适pHFig. 3 Optimum pH of five oligo-1,6-glucosidases
值得注意的是,在pH 6.0 情况下, BC1、BC2、BS1 和BS2 在CH3COOH-CH3COONa 缓冲液中的相对酶活高于在Na2HPO4-NaH2PO4缓冲液中的相对酶活;在pH 7.0~8.0 情况下,5 种寡聚-1,6-葡糖苷酶在Na2HPO4-NaH2PO4缓冲液中的相对酶活高于在Tris-HCl 缓冲液中的相对酶活,说明Na2HPO4-NaH2PO4缓冲液较CH3COOH-CH3COONa 缓冲液对酶活有一定抑制作用,而Tris-HCl 缓冲液较Na2HPO4-NaH2PO4缓冲液对酶活的抑制作用更强。
5 种寡聚-1,6-葡糖苷酶在各自最适pH 下,孵育不同时间后测定其pH 稳定性,孵育时间-相对酶活曲线如图4 所示。 KP 在孵育3~6 h 后相对酶活迅速下降至47%,在孵育15 h 后相对酶活下降至27%。随着孵育时间的延长,BC1、BC2、BS1、BS2 的相对酶活均缓慢下降,孵育15 h 后相对酶活分别降至80%、64%、79%、67%,说明这4 种酶的pH 稳定性高于KP。

图4 5 种寡聚-1,6-糖苷酶在各自最适pH 下的稳定性Fig. 4 Stability of five oligo-1,6-glycosidases at their optimum pH
2.3.2 最适温度及热稳定性 在30~64 ℃温度范围内,5 种寡聚-1,6-糖苷酶的温度-相对酶活曲线如图5所示。BC1 和BC2 从30 ℃开始随着温度升高相对酶活逐渐增加,56 ℃为最适反应温度,此时相对酶活达到最高,在60 ℃ BC1 和BC2 仍分别有74%和94%相对酶活。KP 从48 ℃升温到52 ℃时相对酶活大幅提升,60 ℃为其最适反应温度,相对酶活达到最高,在64 ℃仍有78% 的相对酶活。BS1、BS2 的最适温度均为43 ℃,随着温度继续升高相对酶活迅速降 低。综 上,BC1、BC2、KP 为 嗜 热 性 酶,BS1、BS2 为嗜温性酶。

图5 5 种寡聚-1,6-葡糖苷酶最适温度Fig. 5 Optimum temperature of five oligo-1,6-glucosidases
5 种寡聚-1,6-葡糖苷酶在各自最适条件下孵育不同时间后测定其热稳定性,孵育时间-相对酶活曲线如图6 所示。BS1 在43 ℃孵育2 min 时相对酶活急速下降,孵育20 s 时相对酶活迅速降至50%。BC1在孵育1 min 时相对酶活降至50% 以下,BC2 在孵育1.5 min 时相对酶活降至50%以下。BC1、BC2 和BS1 在孵育5 min 时都几乎失活。相比之下,BS2 在孵育0.5 h 时相对酶活降至35%,孵育2 h 时相对酶活几乎为0。KP 在孵育0.5 h 时仍有60%以上的相对酶活,随后酶活随孵育时间的延长而缓慢降低,孵育2 h 时相对酶活降至31%,表现出了较高的热稳定性。

图6 5 种寡聚-1,6-葡糖苷酶在各自最适温度下的热稳定性Fig. 6 Thermostability of five oligo-1,6-glucosidases at their optimum temperatures
Suzuki 等[4]在深入研究比较了来源于不同芽孢杆菌的寡聚-1,6-葡糖苷酶的氨基酸组成、结构参数和热稳定性后提出了脯氨酸法则,即增加氨基酸序列中脯氨酸残基的摩尔分数可以提高蛋白质的热稳定性。5 种寡聚-1,6-葡糖苷酶的脯氨酸摩尔分数及热稳定性关系如表2 所示。由表2 可见,KP 的脯氨酸摩尔分数最高,其最适温度及热稳定性明显高于其他寡聚-1,6-糖苷酶。BC1、BC2 及BS1 的脯氨酸摩尔分数较低,相应的热稳定性也较低,其中BC1 的相对酶活衰减速度明显快于其他酶,符合脯氨酸法则对这些酶的热稳定性的预测。
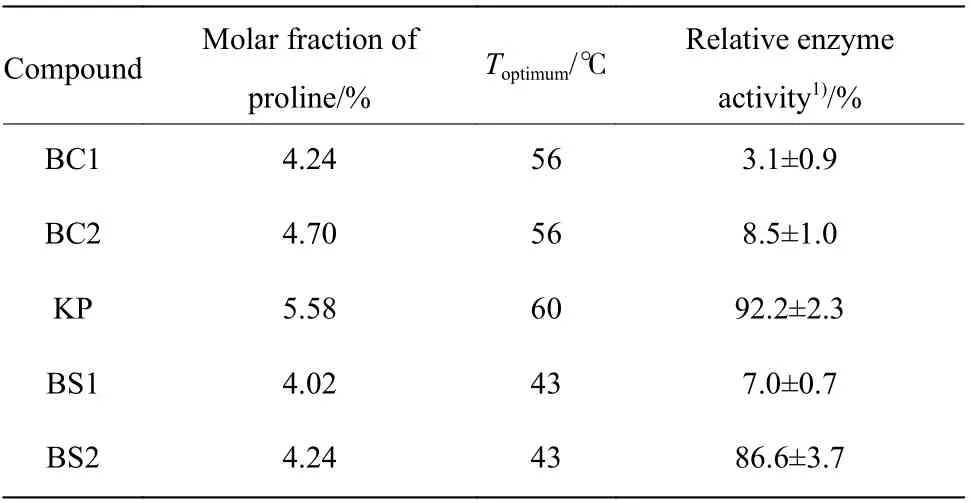
表2 5 种寡聚-1,6-葡糖苷酶的脯氨酸摩尔分数与热稳定性Table 2 Proline molar fraction and thermostability of five oligo-1,6-glucosidases

Zn2+对这5 种寡聚-1,6-葡糖苷酶都有强烈的抑制作用,其中使BS2 的相对酶活降低了99.32%。Zn2+被报道对许多酶的活性均具有抑制作用[17-19],可能是因为Zn2+易与蛋白酶亲和而改变酶的构象,从而抑制了酶的活性[20]。除Zn2+以外,Ni+也有普遍的抑制作用,其作为重金属离子的作用可能与Zn2+相似[21]。Cu2+对5 种寡聚-1,6-葡糖苷酶都呈现出强烈的抑制作用,但由于Cu2+在反应体系中产生沉淀会影响酶活的检测,其抑制程度不能精确确定。
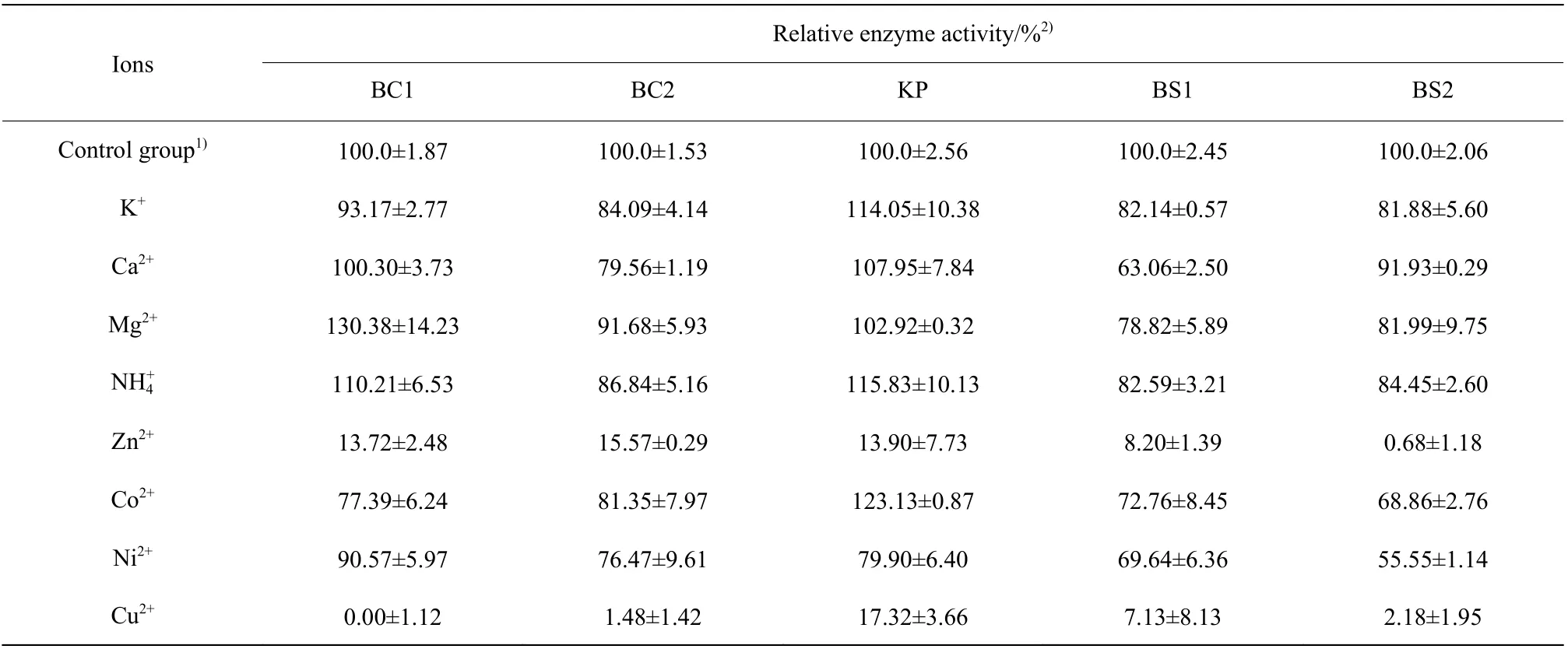
表3 离子对5 种寡聚-1,6-葡糖苷酶相对酶活的影响Table 3 Effects of ions on relative enzyme activities of five oligo-1,6-glucosidases

2.3.5 底物特异性 在凝结芽孢杆菌利用玉米粉水解液进行乳酸发酵过程中,发酵后期发酵液中的菌体难以利用的残糖主要有异麦芽糖(含α-1,6-糖苷键)、蔗糖(含α-1,2-糖苷键)、麦芽糖(含α-1,4-糖苷键)以及海藻糖(含α-1,1-糖苷键)[3]。因此选取以上发酵液残糖中含量较高的糖类,同时还选取了乳糖(含β-1,6-糖苷键)以及可溶性直链淀粉(含α-1,4-糖苷键)作为底物来测定分析底物的特异性。如表5 所示,5 种寡聚-1,6-葡糖苷酶水解其他底物时的酶活相对于水解pNPG 时的酶活较低。BC1、BC2、KP、BS1 对异麦芽糖都有水解活性,只有BS2 未检测到该活性。其中BC1 对异麦芽糖的水解活性最高,酶活达到了(12.82±0.08)mmol/(min·g),其次是KP,酶活达到了(7.24±1.35)mmol/(min·g)。5 种寡聚-1,6-葡糖苷酶对麦芽糖都有催化水解的活性,其中BS2 催化水 解 麦 芽 糖 的 酶 活 高 达(4.11±0.04)mmol/(min·g)。此外,BC1、KP、BS1 还具备一定的催化水解蔗糖的活性。而5 种寡聚-1,6-葡糖苷酶都不具备催化水解乳糖、海藻糖及可溶性直链淀粉活性的性能。

表4 5 种寡聚-1,6-葡糖苷酶酶动力学参数Table 4 Enzyme kinetic parameters of five oligo-1,6-glucosidases
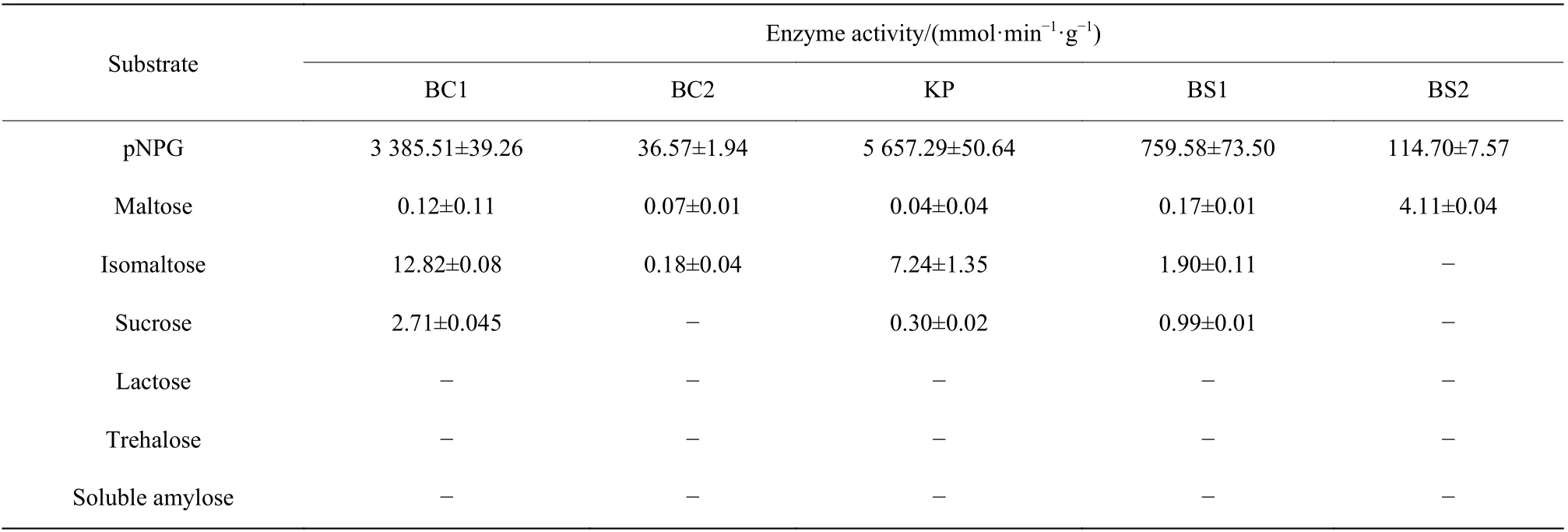
表5 5 种寡聚-1,6-葡糖苷酶的底物特异性Table 5 Substrate specificity of five oligo-1,6-glucosidases
3 结 论
(1)以pET-22b(+) 作为表达载体分别构建了来源 于Bacillus coagulansATCC 7050(BC1、BC2)、Bacillus thermoglucosidasiusKP 1006(KP)和Bacillus subtilis168(BS1、BS2)的5 个寡聚-1,6-葡糖苷酶基因的大肠杆菌表达系统,在E. coliBL21(DE3)中诱导表达,并利用镍柱亲和层析方法进行纯化。纯化后5 种寡聚-1,6-葡糖苷酶BC1、BC2、KP、BS1、BS2对水解pNPG 的酶活分别达到了(3 385.51 ± 39.26)、(36.57 ± 1.94)、(5 657.29 ± 50.64)、(759.58 ± 73.50)、(114.70 ± 7.57) mmol/(min·g)。

