基于Smad通路研究软肝丸对TGF-β1诱导的肝星状细胞的影响*
2021-07-23吕莹郝尧坤张照兰
吕莹,郝尧坤,张照兰
河南中医药大学第一附属医院,河南 郑州 450000
肝纤维化是由慢性肝损伤引起的病理状态。慢性肝炎、胆汁淤积、酒精或药物刺激均可引起肝损伤,并进一步激活肝损伤修复过程,引起肝纤维化,进而可发展为肝硬化,最终诱发肝癌发生[1-2]。软肝丸是鳖甲、龟板、穿山甲、当归、生牡蛎、桃仁、鸡内金、甘草等组成的复方制剂。研究表明,软肝丸可有效地促进肝纤维化逆转、改善门脉高压进而延缓肝硬化发展[3]。肝星状细胞(hepatic stellate cells,HSCs)是肝纤维化进展的关键因素,肝损伤可诱导HSCs增殖、活化并分泌大量细胞外基质(extracellular matrix,ECM)[4]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是活化的HSCs分泌的成纤维细胞因子,其可诱导HSCs分化为成肌纤维细胞促进肝纤维化形成[5]。研究发现,软肝颗粒对肝纤维化大鼠TGF-β1/Smads通路具有调控作用[6],但作用的分子机制尚不清楚。因此,本研究通过体外细胞实验探讨软肝丸含药血清对TGF-β1诱导人HSCs LX-2增殖、凋亡、纤维化及Smad通路相关蛋白表达的影响,进一步揭示其抗肝纤维化的潜在分子机制。
1 材料
1.1 动物与细胞SD雄性大鼠,体质量(260±20)g,购于上海凯学生物科技有限公司,合格证号:SYXK(沪)2015-0016。人HSCs系LX-2购于武汉普诺赛生命科技公司。
1.2 药物与试剂软肝丸由鳖甲、龟板、穿山甲、当归、生牡蛎、桃仁、鸡内金、甘草等组成,批号:豫药制字Z20120712(郑),专利号:ZL201310443782.1)。TGF-β1(美国Sigma公司,货号:GF346);细胞计数试剂盒(cell counting kit 8,CCK-8)、膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)双染法凋亡检测试剂盒(北京索莱宝生化公司,货号分别为:CA1210、CA1020-20);TUNEL试剂盒(美国Roche公司,货号:11684817910);总RNA快速提取试剂盒、逆转录试剂盒、SYBR Premix ExTaqTM(大连Takara公司,货号分别为:9108/9109、RR047A、DRR820A);兔源Ⅰ型胶原(collagenⅠ,Col-Ⅰ)、兔源Col-Ⅲ、兔源结缔组织生长因子(connective tissue growth factor,CTGF)、兔源纤连蛋白(fibronectin,FN)、兔源α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、兔源β-肌动蛋白(β-actin)、羊抗兔IgG二抗抗体(上海艾博抗生物公司,货号分别为:ab34710、ab7778、ab227180、ab2413、ab5694、ab8227、ab205718)。
1.3 仪器ELx80型酶标仪(美国BioTek公司);ckx53ipc型荧光显微镜(日本Olympus公司);7500型荧光定量PCR仪(美国ABI公司)。
2 方法
2.1 软肝丸含药血清制备将20只大鼠随机分为4组,即对照组及低、中、高浓度软肝丸(4.25 g·kg-1、8.5 g·kg-1、17 g·kg-1)组大鼠给予相应药物,对照组给予同体积生理盐水,连续给药3 d,末次灌胃1 h后,腹主动脉取血。1 500 r·min-1离心15 min,将同组血清混匀,56℃水浴30 min,孔径为0.22μm过滤器过滤除菌,分装后-20℃保存备用[7]。
2.2 细胞分组和细胞培养LX-2细胞采用高糖杜尔伯格伊戈尔培养基(dulbecco′s modified eagle medium,DMEM)在37℃、含5%CO2的培养箱中培养,培养液中补充10%的胎牛血清。当细胞基本融合为一层时进行消化和传代,选择对数生长期细胞进行实验。空白组:用80%DMEM培养基+20%对照血清;TGF-β1组:用含10μg·L-1TGF-β1[8]+80%DMEM培养基+20%对照血清;低浓度含药血清组:用10μg·L-1TGF-β1+80%DMEM培养基+20%低浓度软肝丸含药血清(0.17μg·L-1);中浓度含药血清组:用10μg·L-1TGF-β1+80%DMEM培养基+20%中浓度软肝丸含药血清(0.34μg·L-1);高浓度含药血清组:用10μg·L-1TGF-β1+80%DMEM培养基+20%高浓度软肝丸含药血清(0.68μg·L-1),每孔重复3次。共培养24 h。
2.3 CCK-8法检测细胞活力每组取3×103个细胞加入96孔板,孵育24、48、72 h后,每孔加入10μL的CCK-8试剂,培养箱继续孵育2 h,每孔重复3次,用酶标仪检测各孔450 nm处光密度(optical density,OD)值。
2.4 流式细胞术和TUNEL法检测细胞凋亡根据2.2培养细胞,分别用流式细胞术和TUNEL法检测细胞凋亡。TUNEL法:将培养的细胞制片,40 ng·L-1多聚甲醛和体积分数80%乙醇固定后用磷酸盐缓冲液洗片3次。吸水纸吸干玻片上水分,滴加反应液37℃孵育1 h。终止反应后进行TUNEL反应混合液标记,再次洗涤后进行酶标反应和染色,荧光显微镜下观察细胞染色情况。凋亡细胞显示出黄绿色荧光,蓝色荧光为核染色。
凋亡指数(%)=凋亡细胞个数/总细胞个数×100%
流式细胞术法:将各组细胞制备5×104mL-1的细胞悬液,取100μL细胞悬液加入流式管,按照Annexin V-FITC/PI试剂盒分别加入5μL的Annexin V-FITC和PI。避光反应10 min后补加400μL的结合缓冲液上机检测细胞凋亡情况。
2.5 RT-qPCR法检测Col-Ⅰ、Col-Ⅲ、CTGF、FN以及α-SMA mRNA表达将2.2培养的细胞,用总RNA快速提取试剂盒提取各组细胞总RNA,使用逆转录试剂盒合成互补DNA(complementary DNA,cDNA),采用SYBR®PremixExTaqTMII进行RT-qPCR。反应体系为包含2×SYBR Premix ExTaqTM10μL,上游引物0.4μL,下游引物0.4μL,50×ROX ReferenceDye 4μL,cDNA模板2μL,补加灭菌蒸馏水至总体为20μL。反应条件95℃预变性30 s;95℃变性5 s,60℃退火/延伸35 s,共40个循环。2-ΔΔCt法分析mRNA表达量。引物序列(5′-3′)如下:内参β-actin上游GGAGATTACTGCCCTGGCTCCTA,下游GACTCATCGTACTCCTGCTTGCTG;Col-Ⅰ上游TCAGGGGCGAAGGCAACAGT,下游TTGGGATGGAGGGAGTTTACACGA;Col-Ⅲ上游CGTCCTGCAGGTAACAGTGGTTC,下游TGCTCCAGTTAGCCCTGCAA;α-SMA上游CTAAGGCCAACCGGGAGAAA,下游CCAGAGTCCAGCACAATACCA;CTGF上游TCACTGACCTGCCTGTAG,下游GCTGAGTCTGCTGTTCTG;FN上游CATTCAACAAG AAACCACT,下游TCTGTCACTTCCACAAACT。
2.6 Western blot法检测Col-Ⅰ、Col-Ⅲ、CTGF、FN、α-SMA及Smad通路相关蛋白表达将2.2培养细胞,放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)法获得细胞总蛋白,等量蛋白样品经聚丙烯酰胺凝胶电泳分离,随后转移到硝酸纤维素膜上。膜封闭后,室温下加入特异性一抗溶液孵育膜2 h,再加入酶标二抗孵育膜1 h,增强型化学发光显色试剂显影。Image J软件分析蛋白条带灰度值。以目的蛋白和内参β-actin比值表示对应蛋白表达量。
2.7 统计学方法采用SPSS 19.0进行统计学分析,数据以均数±标准差(±s)表示。采用单因素方差分析和SNK-q检验分析多组间差异。P<0.05为差异具有统计学意义。
3 结果
3.1 软肝丸含药血清对TGF-β1诱导肝星状细胞增殖的影响与空白组比较,TGF-β1组肝星状细胞活力明显升高(P<0.05);与TGF-β1组比较,低、中、高浓度含药血清组肝星状细胞活力明显降低(P<0.05)。见表1。
表1 软肝丸含药血清抑制TGF-β1诱导肝星状细胞增殖 (±s)

表1 软肝丸含药血清抑制TGF-β1诱导肝星状细胞增殖 (±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
?
3.2 软肝丸含药血清对TGF-β1诱导肝星状细胞凋亡的影响与空白组比较,模型组肝星状细胞凋亡率明显降低(P<0.05);与模型组比较,软肝丸低、中、高浓度肝星状细胞凋亡率明显升高(P<0.05)。见图1、表2。
表2 软肝丸含药血清促进TGF-β1诱导肝星状细胞凋亡 (±s)
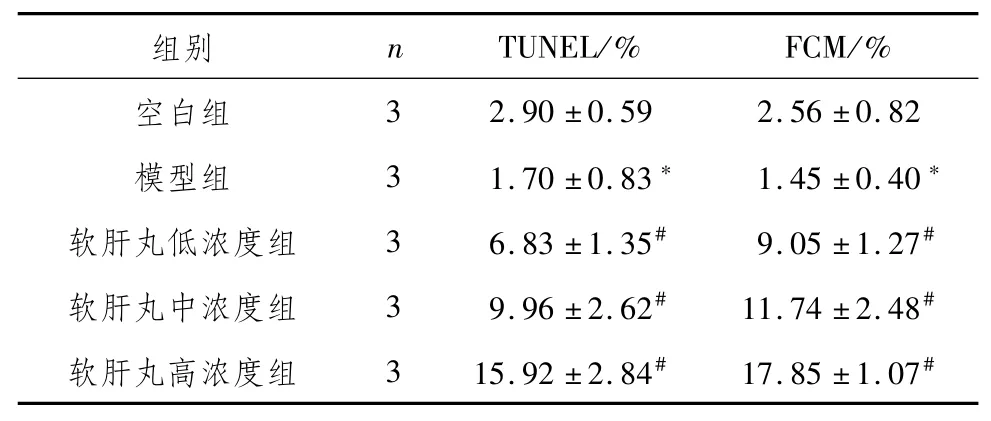
表2 软肝丸含药血清促进TGF-β1诱导肝星状细胞凋亡 (±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
?
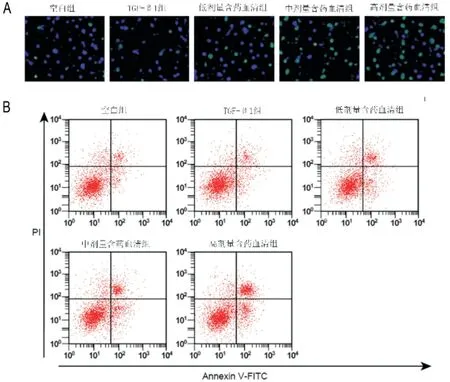
图1 检测软肝丸含药血清对TGF-β1诱导肝星状细胞凋亡的影响
3.3 软肝丸含药血清对TGF-β1诱导肝星状细胞Col-ⅠmRNA、Col-ⅢmRNA、CTGFmRNA、FNmRNA及α-SMAmRNA的影响与空白组比较,模型组肝星状细胞Col-ⅠmRNA、Col-ⅢmRNA、CTGFmRNA、FNmRNA及α-SMAmRNA水平均明显升高(P<0.05);与模型组比较,软肝丸低、中、高浓度组肝星状细胞Col-ⅠmRNA、Col-ⅢmRNA、CTGFmRNA、FNmRNA及α-SMAmRNA水平均明显降低(P<0.05)。见表3。
表3 软肝丸含药血清抑制TGF-β1诱导肝星状细胞Col-ⅠmRNA、Col-ⅢmRNA、CTGF mRNA、FN mRNA及α-SMA mRNA水平 (±s)

表3 软肝丸含药血清抑制TGF-β1诱导肝星状细胞Col-ⅠmRNA、Col-ⅢmRNA、CTGF mRNA、FN mRNA及α-SMA mRNA水平 (±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
?
3.4 软肝丸含药血清对TGF-β1诱导肝星状细胞Col-、Col-Ⅲ、CTGF、FN及α-SMA蛋白的影响与空白组比较,模型组肝星状细胞Col-Ⅰ、Col-Ⅲ、CTGF、FN及α-SMA蛋白表达均明显升高(P<0.05);与模型组比较,软肝丸低、中、高浓度组肝星状细胞Col-Ⅰ、Col-Ⅲ、CTGF、FN以及α-SMA蛋白表达均明显降低(P<0.05)。见表4、图2。
表4 软肝丸含药血清抑制TGF-β1诱导肝星状细胞Col-Ⅰ、Col-Ⅲ、CTGF、FN及α-SMA蛋白表达(±s)
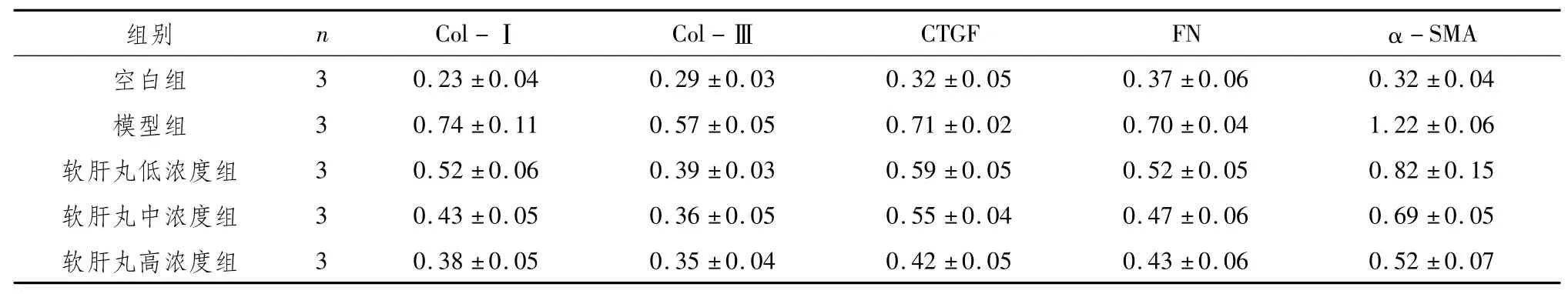
表4 软肝丸含药血清抑制TGF-β1诱导肝星状细胞Col-Ⅰ、Col-Ⅲ、CTGF、FN及α-SMA蛋白表达(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
?
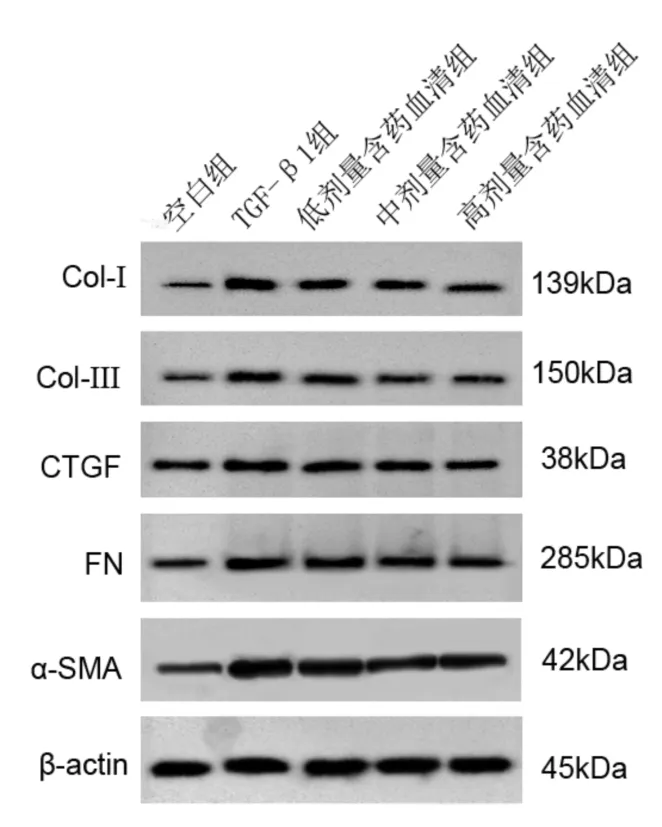
图2 肝星状细胞Col-Ⅰ、Col-Ⅲ、CTGF、FN及α-SMA蛋白表达图
3.5 软肝丸含药血清对TGF-β1诱导肝星状细胞Smad通路蛋白的影响与空白组比较,模型组肝星状细胞p-Smad2/3蛋白表达明显升高,Smad7蛋白表达明显降低(P<0.05);与模型组比较,软肝丸低、中、高浓度组肝星状细胞p-Smad2/3蛋白表达显著降低,Smad7蛋白表达明显升高(P<0.05)。见表5、图3。
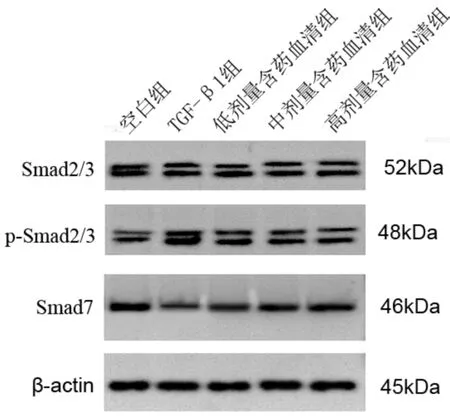
图3 肝星状细胞Smad2/3、p-Smad2/3和Smad7蛋白表达
表5 软肝丸含药血清抑制TGF-β1诱导肝星状细胞p-Smad2/3蛋白和促进Smad7蛋白表达(±s)

表5 软肝丸含药血清抑制TGF-β1诱导肝星状细胞p-Smad2/3蛋白和促进Smad7蛋白表达(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
?
4 讨论
HSCs在肝纤维化发病机制中起核心作用,肝损伤可诱导HSCs从静止状态转化为激活状态,HSCs通过分泌基质金属蛋白酶(matrix metalloproteinase,MMP)组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMP)抑制MMP活性,引起ECM积聚并产生白细胞介素6(interleukin 6,IL-6)、IL-8等促炎性细胞因子及TGF-β等促纤维化因子进一步激活HSC,促进分化为成肌纤维细胞并迁移至损伤部位合成Col-Ⅰ、α-SMA促进肝纤维化形成[9-10]。本研究中TGF-β1显著诱导LX-2细胞增殖及HSCs活化标志物α-SMA表达,抑制细胞凋亡,并促进Col-Ⅰ、Col-Ⅲ、CTGF、FN等纤维化标志物产生,这与杨淑娟等[11]的检测结果一致,提示LX-2细胞体外纤维化模型构建成功。
药理研究表明,鳖甲可改善肝炎、肝硬化患者临床症状,延缓病情的发展;龟甲具有免疫增强和抗氧化作用[12-13]。穿山甲具有降低血液黏度、抗炎、抗癌、消痈及镇痛的作用[14]。当归具有抑制血小板聚集、促进造血功能[15]。牡蛎可保护肝细胞膜免受脂质过氧化损伤,抑制肝细胞凋亡[16]。桃仁提取物通过促进Ⅰ型和Ⅲ型胶原降解进而具有抗肝纤维化作用[17]。鸡内金可调节消化液分泌、提高消化酶活性,减少肝及肠系膜中脂肪堆积[18]。软肝丸全方配伍严谨,具有软坚散结、活血化瘀、益气养血功效,在临床用于治疗肝纤维化、肝硬化[19-20]。马素平等[21]研究显示,服用软肝丸可提高乙肝肝硬化患者人血白蛋白和胆碱酯酶水平、改善肝脏储备功能,并降低门脉高压症。本研究探讨软肝丸抗纤维化作用潜在机制发现,软肝丸含药血清可促进LX-2细胞凋亡,这与孟胜喜等[7]研究发现一致。此外,软肝丸含药血清明显阻止TGF-β1诱导的LX-2细胞增殖和活化。在正常肝脏中HSCs可通过调节ECM合成和降解可维持ECM沉积平衡,而HSCs过度激活将导致ECM大量沉积,最终导致肝组织结构破坏和功能障碍[22]。FN在胶原沉积中具有重要作用。CTGF是一种富含半胱氨酸的基质细胞蛋白参与细胞增殖、分化、黏附、血管生成及组织纤维化等生理病理过程,通过抑制CTGF表达可抑制HSCs表型转换进而缓解肝纤维化进展[23-24]。丹防胶囊通过降低肝组织中α-SMA、COL-Ⅰ、COL-Ⅲ蛋白表达,对大鼠肝纤维化有一定的保护作用[25]。与上述研究一致,本研究软肝丸含药血清可有效抑制TGFβ1诱导细胞中Col-Ⅰ、Col-Ⅲ、FN和CTGF蛋白表达,提示软肝丸含药血清可抑制TGF-β1诱导后LX-2细胞纤维化。综上所述,软肝丸含药血清通过抑制LX-2细胞增殖、活化、ECM合成并诱导细胞凋亡进而发挥抗纤维化作用。
Smad蛋白是TGF-β1的关键细胞内效应因子,Smad2和Smad3具有促肝纤维化作用,而Smad7具有保护作用[26-27]。研究表明,丹酚酸B通过抑制丝裂原活化蛋白激酶(MAPK)介导的Smad2/3磷酸化表现出显著的抗纤维化作用[28]。二氢杨梅素通过抑制Smad2/3磷酸化可抑制HSCs活化从而抑制ECM产生[29]。本研究软肝丸含药血清可显著降低TGF-β1诱导后p-Smad2/3表达,升高Smad7蛋白表达,提示软肝丸含药血清可能通过调控Smad信号通路影响LX-2细胞增殖、活化和凋亡而发挥抗纤维化作用。
综上所述,软肝丸可抑制TGF-β1诱导的肝星状细胞增殖、活化和纤维化,促进细胞凋亡,其机制可能与调控Smad通路有关。这丰富了软肝丸在肝纤维化中的保护作用,为其在预防或逆转肝纤维化应用奠定坚实基础。
