Cu2+共存对磺胺嘧啶在土壤中吸附的影响
2021-07-23徐子文董梦阳刘喜娟邵翼飞吕十全胡树翔许玉芝胡欣欣刘爱菊
徐子文,董梦阳,刘喜娟,邵翼飞,吕十全,胡树翔,许玉芝,胡欣欣,刘爱菊*
Cu2+共存对磺胺嘧啶在土壤中吸附的影响
徐子文1,董梦阳1,刘喜娟1,邵翼飞1,吕十全1,胡树翔1,许玉芝2,胡欣欣2,刘爱菊2*
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255091;2.山东理工大学资源与环境工程学院,山东 淄博 255091)
选取土壤环境中检出率高的铜和磺胺类抗生素为目标污染物,采用批次平衡试验法研究了在Cu2+共存时,磺胺嘧啶 (SDZ) 在pH值、离子浓度、有机质含量、颗粒粒径等因子影响下的吸附特征,并对吸附前后的土样进行傅里叶红外光谱(FT-IR)表征.结果表明,在不同pH值环境中,Cu2+显著提高了SDZ的吸附量;Cu2+和Ca2+均能与SDZ通过络合反应和离子桥作用促进SDZ的土壤吸附;有机质对SDZ的土壤吸附的影响与共存Cu2+浓度密切相关;Cu2+对黏粒吸附SDZ的影响较小;FT-IR分析表明,土壤对SDZ-Cu的吸附以物理吸附为主,并伴随氢键作用、表面络合、π-π共轭等作用.Cu2+可显著增加SDZ在土壤中持留能力,降低其环境迁移的风险.
磺胺嘧啶;土壤;铜;吸附;影响因素
抗生素因能在低浓度下抑制或杀灭病原微生物,被广泛应用于医疗、畜牧业和水产养殖业.据统计,我国的抗生素消耗量已达到16.28万t,其中有约52%用于畜牧业[1].但因其在生物体内难以彻底代谢,大量残余抗生素及其代谢产物通过动物排泄、生产过程及废弃物排放等方式进入环境.研究表明,约有30%~90%的抗生素母体及其代谢产物会经动物的粪便和尿液排出体外[2-3],并随着畜禽粪便的农用、污水灌溉等过程进入土壤环境[4-6].虽然抗生素在环境中的实际残留期较短,但由于其在农业生产活动中施入土壤的频率较高,这在一定程度上维持抗生素在土壤中污染的“假持久性”[7],导致了土壤抗生素污染的生态风险.
近年来,Cu、Zn等重金属也在畜禽养殖业中广泛应用,导致土壤中重金属、抗生素及其代谢活性产物的积累越来越严重.同时,土壤中的抗生素、重金属元素交互作用问题备受关注.有关抗生素与重金属在土壤及土壤组分中的行为研究已有很多.如Morel等[8]研究发现,磺胺甲噁唑(SMX, Sulfamethoxazole)与Cu2+的结合能力虽然非常弱,但在Cu2+存在时,其在土壤中的吸附能力则显著增加,并由此提出了SMX-Cu-土壤三元配合物假说. Wu[9]在研究磺胺类抗生素与Cu2+在羟基化或非羟基化的碳纳米管上的共吸附现象时,发现了SMX-Cu-纳米碳管三元配合物.而土壤pH值、离子强度、有机质等均可影响土壤的吸附解吸行为.因此,本研究以磺胺嘧啶(SDZ)为研究对象,研究不同环境因素下Cu2+共存对SDZ在土壤中吸附的影响,以期为土壤抗生素与重金属复合污染的风险评价及修复提供科学依据.
1 材料与方法
1.1 试验材料与试剂
SDZ(分析纯)购自上海源叶生物技术有限公司;腐殖酸,分析纯,购自国药集团化学试剂有限公司;甲醇(Sigma,USA)色谱纯;其余试剂都为分析纯,实验用水皆为超纯水.
供试土样采自湖北襄阳的水稻田土壤,土壤采集后冷藏条件下运至室内,避光风干,过2mm筛后,采用常规方法测定其理化性质.土样基本理化性质如表1所示,测定方法参照文献[10].

表1 供试土壤基本理化性质
1.2 土壤样品预处理
1.2.1 土壤背景溶液配制 用超纯水配制0.05mol/ L氯化钙溶液作为土壤背景溶液;同时,利用该背景溶液配制浓度为100mg/L的SDZ工作液、1g/L的氯化铜溶液、10g/L的腐殖酸溶液, 4℃贮存待用.
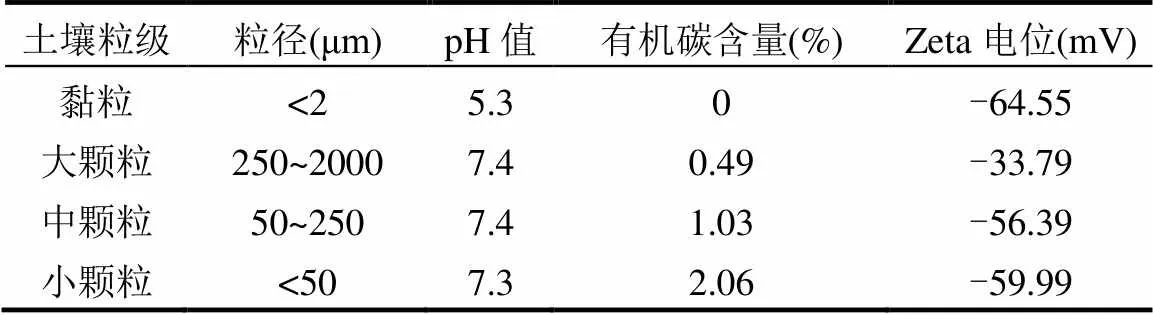
表2 不同粒级土壤理化性质
1.2.2 不同土壤组分的制备 取100g过2mm筛的土样置于由60目(250µm)和300目(50µm)筛组成的套筛上湿筛,获取>250µm的大颗粒团聚体,50~ 250µm为中颗粒团聚体,<50µm为小颗粒团聚体;分别将3个粒级的土样在40℃烘箱烘干后,磨细过1mm筛,装袋备用.采用H2O2法去除土壤有机质制备土壤黏粒组分[10].不同土壤组分的基本理化性质见表2,其测定方法参照文献[10].
1.3 试验设计
1.3.1 SDZ土壤吸附试验 精确称取1.00g土壤于50mL玻璃离心管中,按照水土比20:1(:)依次加入土壤背景溶液、适量的SDZ工作溶液和氯化铜溶液,使SDZ浓度为2mg/L,充分振荡混合后,将土壤悬浊液置于(25±2)℃条件下恒温振荡,振荡频率250次/min;振荡结束后,取一定量的土壤悬浊液,4000r/min离心10min,上清液过0.45µm滤膜(CA,Whatman),用HLPC-UV(Agilent 1100series,USA)测定SDZ浓度.每个试验处理重复3次.
1.3.2 Cu2+共存影响试验 设计了不同浓度Cu2+共存时,介质溶液pH值、离子强度、有机质含量、土壤粒径等因素对SDZ土壤吸附的影响.其中,Cu2+的添加浓度分别为200,500mg/L,其余试验设计同1.3.1中 SDZ土壤吸附试验.
为表征Cu2+共存对SDZ吸附的影响机制,采用傅里叶变换红外光谱(FT-IR, Nicolet 5700, Thermo Electron)法,分别对Cu2+添加和未添加处理中SDZ在不同土壤组分中吸附特征进行表征.为保证良好FTIR的信号强度,各吸附处理中SDZ添加浓度增加至100mg/L,Cu2+添加浓度为500mg/L.
1.4 SDZ的高效液相色谱分析及其土壤吸附的FT-IR表征
高效液相色谱法分析SDZ: 色谱柱为Eclipse XDB-C18柱(150mm´4.6mm,5μm);进样量为10µL,柱温30℃,采用乙腈:水=20:80(体积比)作为流动相,流速为1mL/min,检测波长为270nm,溶液中抗生素的检出限为0.01mg/L.
傅里叶变换红外光谱(FT-IR):称取吸附前后的干燥样品和无水KBr,按重量比1:100混合,碾磨后压片,在傅里叶红外光谱仪上测定.扫描范围为4000~ 400cm–1,分辨率为4cm–1,扫描次数为16次.
1.5 数据分析
用Origin 9.0进行SDZ吸附量的数据分析和图形绘制、Excel 2010 软件对试验数据进行分析处理.数据处理过程中使用的统计检验方法有方差分析(ANOVA).
2 结果与讨论
2.1 pH值、离子浓度的影响
土壤pH值是影响污染物在土壤环境中迁移转化的主要环境因子.Park等[11]实验表明,磺胺类药物在土壤系统中的迁移取决于酸碱度.研究表明[12-13], SDZ在环境中的形态分布与介质环境pH值密切相关.考虑土壤pH值的自然变化范围,以pH=5.0、7.0、9.0为例,研究了不同浓度的Cu2+共存时,SDZ在土壤中的吸附变化(图1).
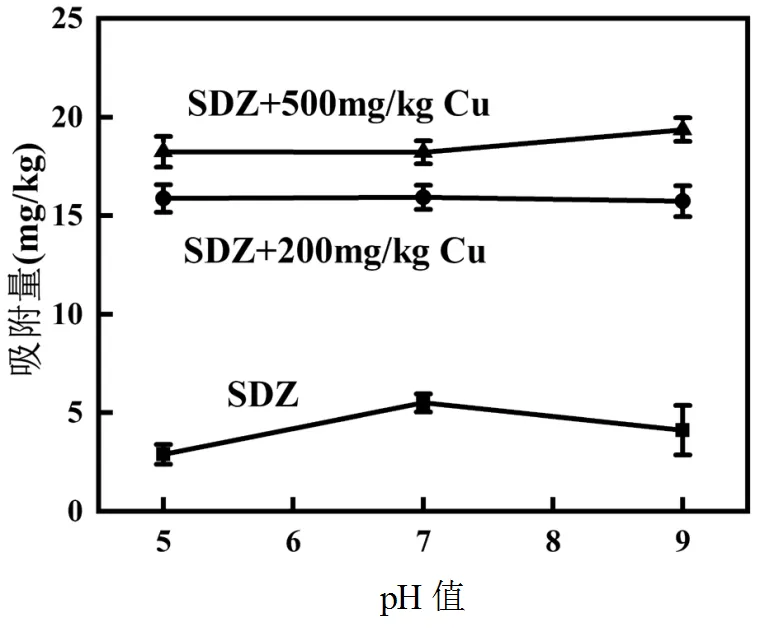
在试验pH值范围内,单一SDZ在土壤中的吸附受环境pH值条件影响较大,其吸附量随pH值的增加呈现先增加后减少的变化趋势,在pH=7时,吸附量最大.在SDZ-Cu体系中,随着pH值的增加,SDZ的吸附量上升;在相同pH值条件下,SDZ的吸附量显著高于SDZ单一体系,且吸附量随着Cu2+浓度的增加而增加,pH=9时,吸附量最大.由此可知,Cu2+的存在显著促进了SDZ在土壤中的吸附,改变了土壤的吸附行为.这是由于pH值条件的改变引起了SDZ形态的变化.研究表明[12-13],由于磺胺类抗生素的酸碱两性特征,其主导存在形态随pH值的变化而变化,pH<2.0,SDZ以阳离子态SDZ+存在,pH值增大,中性SDZ0形态逐渐增加,当pH值增加到4.0,SDZ0占主导,pH>7.0时,则主要以阴离子态SDZ-形态存在.而土壤胶体表面主要带负电荷,在pH=5的条件下, SDZ以中性SDZ0的形式存在,在土壤吸附中主要通过疏水作用和范德华力发生作用[14];当pH值增加到7及以上(pH=9)时,去质子态SDZ-占主导,与土壤中的负离子产生静电力排斥,理论上吸附量应当减少[15],而实验结果显示吸附量增大.可能是因为,阴离子形态的SDZ与Cu2+及背景溶液中的Ca2+结合形成更易吸附的铜络合物,发生络合作用而导致吸附量有一定程度的增加[16].在pH=9时,SDZ以SDZ-的形式存在,与土壤中的负离子形成更大的静电力排斥,不利于吸附的进行[32],导致SDZ的吸附量降低;而加入Cu2+后,SDZ-可以与溶液中的Cu2+相互作用形成更易吸附的铜络合物;或者由于加入的Cu2+作为离子桥通过“桥”键合效应生成与土壤具有较强的亲和力的配体,增加了SDZ在土壤表面的吸附[16-17].这在一定程度上表明,Cu2+共存可显著增加SDZ在土壤中的持留能力,降低其环境迁移的风险.
介质环境中的离子强度是影响SDZ土壤吸附作用的重要因素.阳离子的存在可能会与SDZ竞争吸附位点或形成亲水性更强的复合物从而抑制吸附,也可能与SDZ发生络合作用形成更易吸附的络合物从而促进吸附[18].如图1所示,随着介质溶液离子强度的增加,单一SDZ在土壤中的吸附量逐渐上升.Cu2+共存体系中,SDZ土壤吸附受介质离子强度的影响更为显著.这表明在离子强度相同的环境介质中,Cu2+共存仍然对土壤吸附SDZ具有显著的促进作用;且仍表现出随着离子强度的增加,SDZ吸附量增加的趋势.尽管在SDZ+Cu500mg/L的体系中,0.1mol/L离子强度下,SDZ的吸附量呈现下降的趋势,但其吸附量仍显著高于SDZ在单一体系的吸附量.分析其原因,可能是在试验pH值下SDZ主要以阴离子形态和中性形态存在,与Ca2+之间存在较强的静电吸附作用,易生成络合物,而被共同吸附在土壤表面[19];也可能是Ca2+作为“离子桥”为SDZ提供了新的吸附位点[7],使Ca2+离子强度的增加,促进了SDZ在土壤固相上的吸附.另一种可能的解释是“盐析”效应导致SDZ在盐溶液中的溶解度降低,从而沉淀到土壤表面[20-21].因此,Cu2+共存时,Cu2+和Ca2+均能与SDZ发生络合反应和离子桥作用,进而促进其土壤吸附;但共存的阳离子会与Cu2+竞争吸附位点[22],进而减弱Cu2+对SDZ吸附的影响.在Cu2+浓度较低的条件下,吸附位点较多,吸附方式主要是专性吸附,不存在离子竞争吸附点位;高浓度时由于阳离子在竞争吸附点位的重叠,从而降低了各离子的吸附量[23],进而影响了因离子络合作用产生的SDZ土壤吸附,相应的降低了Cu2+对SDZ土壤吸附的促进作用.
2.2 土壤有机质含量的影响
土壤有机质是土壤组分中对抗生素吸附贡献最大的组分[24].土壤有机质含各种各样的功能基团,特别是羧基、酚羟基、羰基、氨基和甲氧基等,可通过范德华力、氢键、配位交换、离子交换等方式与土壤中重金属离子、有机污染物等结合成复合物[25-26],进而影响污染化合物在土壤中迁移行为.比较了Cu2+共存与否,有机质含量变化对SDZ土壤吸附的影响,结果见图2.在单一SDZ体系中,SDZ的吸附量随土壤中有机质含量的增加而升高,二者呈正相关关系,表明有机质含量增加可有效促进SDZ在土壤固相中的吸附;而Cu2+加入后,有机质含量增加对SDZ土壤吸附的促进作用更加显著;但在500mg/L Cu2+共存体系中,有机质添加量为1.0~ 5.0g/kg处理中,SDZ的吸附量虽较单一体系中吸附量显著增加,但仍低于其在Cu2+浓度为200mg/L体系中的吸附量;且在有机质添加量为5.0g/kg处理中,SDZ吸附量迅速降低,甚至显著低于其在SDZ单一体系中的吸附量.分析其原因,可能是由于有机质中含有复杂的官能团,能与中性分子状态的SDZ的功能基团相互作用,形成络合物或螯合物进而吸附SDZ[13].当Cu2+共存时,其与SDZ产生共吸附作用形成络合物,该络合物较SDZ本身具有更多的正电荷,更有利于在带负电荷的有机质表面吸附[27].此外,在有机质已经吸附了 Cu2+的点位上,Cu2+作为离子桥,增加了SDZ的累积吸附点位,促进其吸附[7].研究表明[21,28],土壤组分中有机质可专性吸附金属离子,且土壤有机质中有大量的酸性功能团、较高的阳离子交换量,能通过表面配位、离子交换和表面沉淀等方式增加土壤对重金属的吸附能力.因此在Cu2+及有机质浓度较高的体系中,Cu2+占据了大量的吸附位点导致SDZ吸附量降低[29].可见有机质含量低的土壤,对SDZ的吸附性能较差,使SDZ随环境迁移而污染地下水;而有机质含量较高且存在一定量Cu2+的土壤,对SDZ的持留能力强,能降低其环境迁移风险;但同时也对土壤及其中的微生物存在较大潜在危害.

2.3 土壤颗粒粒径的影响
由图3可见,SDZ的吸附量与土壤粒径大小呈正相关,土壤粒径越大越易吸附,去除有机质的黏粒中吸附量最少,这说明有机质组分对土壤吸附SDZ的贡献远远超过了黏土矿物.大颗粒和中颗粒的吸附量差别较小,但在小颗粒中,吸附量降低明显,在黏粒中吸附量极低.Cu2+显著促进了SDZ在4种土壤颗粒中的吸附,但对土壤黏粒中吸附的促进作用相对较低.分析其原因,可能是由于颗粒较大的土壤中含有较高的有机质,有利于SDZ在土壤固相中的吸附;当Cu2+加入后,土壤中的有机质和抗生素通过形成有机质-铜-抗生素三元络合[30],有效促进了SDZ在土壤中的吸附.Cu2+在土壤中的吸附受土壤有机质及pH值含量等因素的制约[31],黏粒的pH值和有机质含量均低于其他颗粒组分,导致Cu2+对黏粒中抗生素吸附的协同促进作用较低.
2.4 吸附机理
为说明Cu2+共存对SDZ在土壤中的吸附机制的影响,采用FTIR技术手段分析了Cu2+共存与否时,黏粒、小颗粒、中颗粒、大颗粒及全土吸附SDZ前后的红外光谱吸收特征,结果如图3所示.
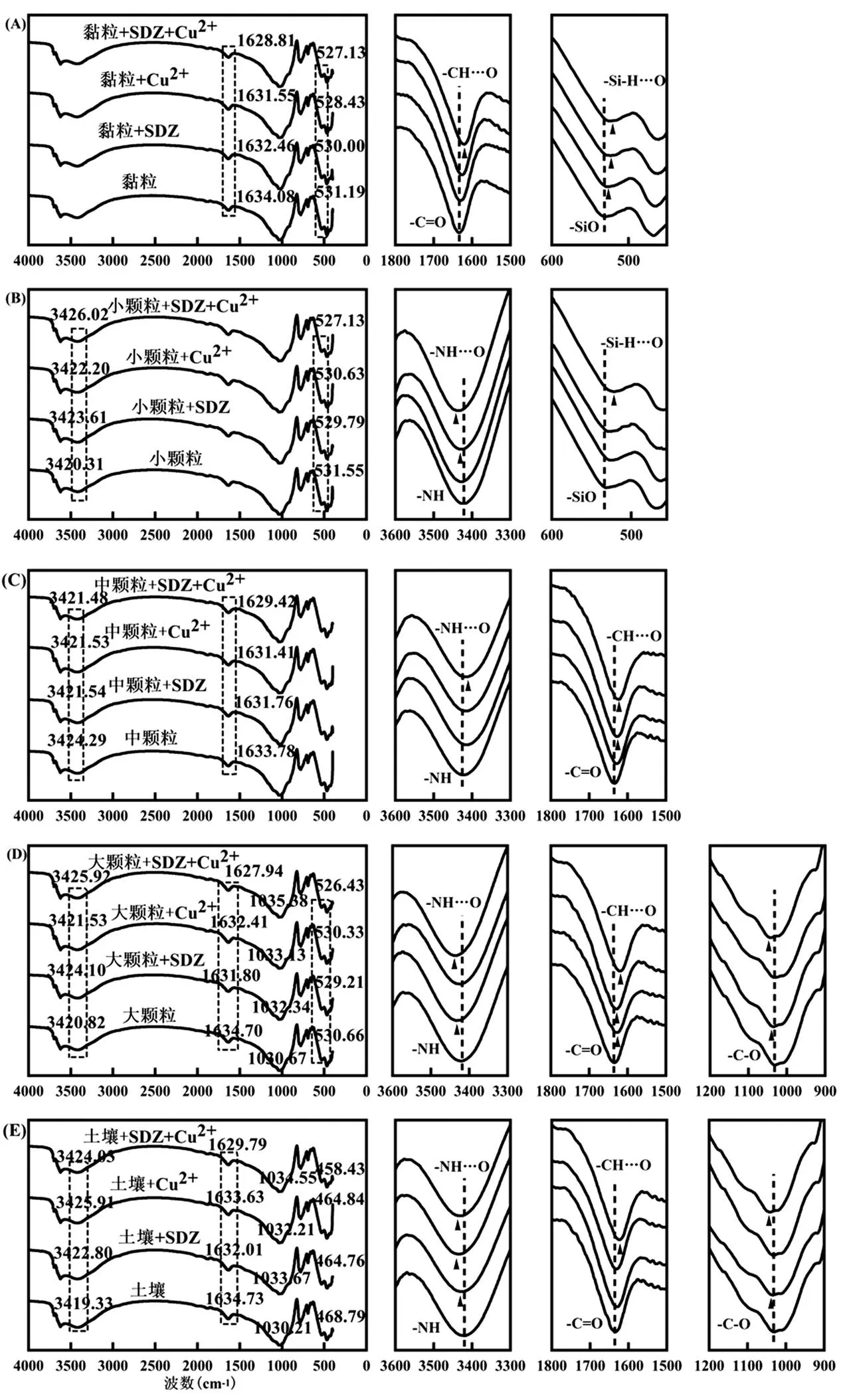
图3 不同颗粒粒径反应前后的FTIR图谱
由图3可见,未吸附SDZ的5种颗粒分别在3200~3500cm-1处形成分子间氢氧键(-O-H)伸缩振动吸收峰,在1630~1680cm-1处形成羧基结构的(-C=O)吸收峰,在1000~1260cm-1处形成醇类的(-C-O)吸收峰,在520~535cm-1处的形成氢键吸收峰.不同土壤颗粒与SDZ反应后均无新的特征峰形成.
与未吸附处理相比,黏粒在吸附SDZ后,在1634.08cm-1处羰基结构的(-C=O)吸收峰发生红移,且在SDZ-Cu共吸附处理中,红移程度明显变大;同时,黏粒在531.19cm-1也发生红移(图3A).由图3B可知,小颗粒在吸附SDZ、Cu2+后,在531.55cm-1发生红移;在3420.31cm-1发生蓝移,且在SDZ-Cu共同吸附后蓝移程度变大.相比之下,中颗粒吸附SDZ、Cu2+后,在1633.78cm-1处发生红移,与其在黏粒吸附特征相似,在3424.29cm-1处发生蓝移又与其在小颗粒上的吸附特征相似(图3C).说明随着颗粒组分构成的复杂化,SDZ在土壤中的吸附机制也逐渐多元化.与其他颗粒组分相似,大颗粒在吸附SDZ后,在530.66, 1634.70, 3420.82cm-1处,形成吸收峰(图3D);且在1030.67cm-1处吸收峰明显蓝移,SDZ的酮基与土壤中的羧基发生表面络合反应可能是引起该颗粒在1030.67cm-1处蓝移的主要因素[7];而且Cu2+共存时,此处吸收峰蓝移程度明显变大,由此可推测Cu2+参与了SDZ与土壤颗粒之间的结合反应.全土吸附SDZ后,其特征吸收峰则在3419.33, 1030.21cm-1发生蓝移,在468.79, 1634.73cm-1处发生红移(图3E).这与其在大颗粒吸附特征峰的变化相似.这进一步说明土壤颗粒变大,土壤的吸附位点增多,其吸附机制也多元化.
由各土壤颗粒吸收SDZ之后各特征吸收峰的偏移分析可知,SDZ中-N-H键的氢原子与土壤中的氧原子相互作用引发各颗粒组分上的氢氧键在3200~3500cm-1处吸收峰发生蓝移[7];而各颗粒吸收SDZ后在1630cm-1处的伸缩振动可能是由氢键作用造成的,也可能由于在pH值为6.8的背景环境下,SDZ存在部分中性分子,其苯环结构能与土壤中的苯环和羧基通过π-π共轭形成吸附[32];说明SDZ可能通过氢键作用或π-π共轭键作用吸附于土壤颗粒上.在1030.67cm-1处吸收峰的蓝移,说明SDZ可通过酮基与土壤中的羧基发生表面络合反应形成土壤吸附[7],Cu2+共存时蓝移增加,说明Cu2+参与络合反应并生成土壤-铜-抗生素三元络合物.同时, SDZ中450~550cm-1氨基的氢与土壤颗粒的Si-O结合形成了氢键也是SDZ吸附于土壤颗粒上的一种作用机制.此外,结合Cu2+共存时SDZ在土壤中的吸附量变化可知(图1~图2),SDZ在土壤中的吸附均以物理吸附为主,且伴有少量氢键吸附作用[13]、络合作用和π-π共轭作用,Cu2+共存时会通过络合作用形成Cu2+桥进而促进SDZ的土壤吸附.
3 结论
3.1 SDZ在土壤颗粒上吸附受pH值的影响较大,Cu2+共存可显著提高其土壤吸附量,同时降低了pH值对其土壤吸附的影响.Ca2+和Cu2+均可作为离子桥增加SDZ在土壤颗粒上吸附位点,但Ca2+浓度过大,会通过离子竞争吸附削弱Cu2+对SDZ土壤吸附的促进作用.在SDZ单一体系中,SDZ的土壤吸附量与土壤中有机质含量呈正相关;但在SDZ-Cu体系中,有机质对SDZ土壤吸附的促进作用主要取决于共存Cu2+浓度.
3.2 SDZ的吸附量与土壤粒径大小呈正相关,土壤粒径越大越易吸附,去除有机质的黏粒中吸附量最少;Cu2+显著促进了SDZ在4种土壤颗粒中的吸附,但对其在土壤黏粒中吸附的促进作用相对较低.
3.3 FTIR研究表明,SDZ在土壤颗粒上的吸附主要以物理吸附为主,伴随氢键作用、表面络合、π-π共轭等作用,Cu2+共存可通过促进吸附过程中的氢键作用、络合作用等促进SDZ在土壤中的吸附.
[1] Zhang Q Q, Guo Y G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: source analysis, multimedia modeling, and linkage to bacterial resistance. [J].Ecology Environment & Conservation, 2015,49(11):6772-82.
[2] 章 强,辛 琦,朱静敏,等.中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 2014,33(7):1075-1083.
Zhang Q, Xin Q, Zhu M, et al. The antibiotic contaminations in the main water bodies in China and the associated environmental and human health impacts [J]. Environmental Chemistry, 2014,33(7): 1075-1083.
[3] 王 冲,罗 义,毛大庆.土壤环境中抗生素的来源、转归、生态风险以及消减对策[J]. 环境化学, 2014,33(1):19-29.
Wang C, Luo Y, Mao D Q. Sources, fate, ecological risks and mitigation strategies of antibiotics in the soil environment [J]. Environmental Chemistry, 2014,33(7):19-29.
[4] 提清清,高增文,季慧慧,等.抗生素在土壤中的吸附行为研究进展[J]. 土壤, 2017,49(3):437-445.
Ti Q Q, Gao Z W, Ji H H, et al. Adsorption of antibiotics in soils: A review [J]. Soils, 2017,49(3):437-445.
[5] 赵方凯,杨 磊,乔 敏,等.土壤中抗生素的环境行为及分布特征研究进展[J]. 土壤, 2017,49(3):428-436.
Zhao F K, Yang L, Qiao M, et al. Environmental behavior and distribution of antibiotics in soils: A review [J]. Soils, 2017,49(3):428-436.
[6] 王 畅,李余杰,张 智,等.氟喹诺酮类抗生素在农业紫色土中的吸附研究[J]. 土壤, 2018,50(5):958-964.
Wang C, Li Y J, Zhang Z, et al. Sorption of fluoroquinolone antibiotics in agricultural purple soils [J]. Soils, 2018,50(5):958-964.
[7] Yang Z, Jia S Y, Zhang T T, et al. How heavy metals impact on flocculation of combined pollution of heavy metals-antibiotics: A comparative study. [J]. Separation and Purification Technology, 2015:269-.
[8] Guo X Y, Shen X F, Zhang M, et al. Sorption mechanisms of sulfamethazine to soil humin and its subfractions after sequential treatments. [J] Environmental Pollution, 2017,221:266-275.
[9] 王胜利,张俊华,刘金鹏,等.土壤吸附铜离子的研究进展[J]. 土壤, 2007,(2):209-215.
Wang S L, Zhang J H, Liu J P, et al. A Review of Studies on Sorption of Copper Ion in Soil [J]. Soils 2007,(2):209-215.
[10] D. Fernández-Calviño, P. Soler-Rovira, A. Polo, M. Arias-Estévez, et, al. Influence of humified organic matter on copper behavior in acid polluted soils [J]. Environmental Pollution, 2010,158(12):3634-3641.
[11] Chen K L, Liu L C, Chen W R. Adsorption of sulfamethoxazole and sulfapyridine antibiotics in high organic content soils. [J]. Environmental pollution. 2017,231(Pt 1):1163-1171.
[12] Pei Z G, Yang S, Li L Y, et al. Effects of copper and aluminum on the adsorption of sulfathiazole and tylosin on peat and soil. [J]. Environmental Pollution, 2014,184:579-585.
[13] 雷 燕.多胺交联吸附树脂对Cu(Ⅱ)和磺胺类抗生素的吸附特性及交互影响机制[D]. 重庆大学, 2018.
Lei Y. The coremoval properties and interaction mechnisms of Cu(Ⅱ) and sulfonamides onto a cross linked polymeric adsorbents modified by polyamine [D]. Chongqing University, 2018.
[14] Ureña-Amate M D, Socías-Viciana M, González-Pradas E, et al. Effects of ionic strength and temperature on adsorption of atrazine by a heat treated kerolite. [J]. Chemosphere, 2005,59(1):69-74.
[15] 张 娟.磺胺嘧啶与Cu在土壤中的吸附行为及其影响因素的研究[D]. 江苏科技大学, 2011.
Zhang J. Research on adsorption behavior of sulfonamides and Copper in soisl and impact factors on their adsorption [D]. Jiangsu University of Science and Technology, 2011.
[16] Wang Y S, Shan X Q, Feng M H, et al. Effects of copper, lead, and cadmium on the sorption of 2,4,6-trichlorophenol onto and desorption from wheat ash and two commercial humic acids. [J]. Environmental Science & Technology, 2009,43(15):5726-31.
[17] 张劲强,董元华.阳离子强度和阳离子类型对诺氟沙星土壤吸附的影响[J]. 环境科学, 2007,28(10):2383-2388.
Zhang J Q, Dong Y H. Influence of strength and species of cation on adsorption of norfloxacin in typical soils of china. [J]. Environmental Science, 2007,28(10):2383-2388.
[18] 王玉环,林 青,徐绍辉. Cu2+存在下腐殖酸对磺胺嘧啶吸附解吸的影响[J]. 环境科学研究, 2018,31(10):1795-1802.
Wang Y H, Lin Q, Xu S H. Effect of Cu2+species on the adsorption and desorption of sulfadiazine by humic acid [J]. Research of Environmental Sciences, 2018,31(10):1795-1802.
[19] 陈 姗,许 凡,张 玮,等.磺胺类抗生素污染现状及其环境行为的研究进展[J]. 环境化学, 2019,38(7):1557-1569.
Chen S, Xu F, Zhang W, et al. Research progress in pollution situation and environmental behavior of sulfonamides [J]. Environmental Chemistry, 2019,38(7):1557-1569.
[20] Huang W L, Peng P A, Yu Z Q, et al. Effects of organic matter heterogeneity on sorption and desorption of organic contaminants by soils and sediments. [J]. Applied Geochemistry, 2003,18(7):955-972.
[21] Morel M.C, Spadini L, Brimo K, et al. Speciation study in the sulfamethoxazole-copper-pH-soil system: implications for retention prediction. [J]. Science Total Environment, 2014,481:266-273.
[22] 张凤杰.铜在土壤上的吸附行为及共存污染物对其吸附的影响[D]. 大连理工大学, 2013.
Zhang F J. Sorption of copper on soil and the effects of the coexisted contaminants on the sorption of copper [D]. Dalian University of Technology, 2013.
[23] 赵震东.土壤组分对抗生素和重金属在土壤及生物炭上吸附的影响[D]. 浙江大学, 2019.
Zhao Z D. Effect of soil component on the adsorption of antibiotic and heavy metal on soil and biochar [D]. Zhejiang University, 2019.
[24] Zanaty R. Komy, Ali M. Shaker, Said E.M. Heggy, et al. Kinetic study for copper adsorption onto soil minerals in the absence and presence of humic acid. [J]. Chemosphere, 2014,99:117-124.
[25] Premasis S, Marc L, Sebastian Z, et al. Sorption and desorption of sulfadiazine in soil and soil-manure systems. [J]. Chemosphere, 2008,73(8):1344-1350.
[26] 张步迪,林 青,曹东平,等.磺胺嘧啶在土壤及土壤组分中的吸附/解吸动力学[J]. 土壤, 2018,50(5):949-957.
Zhang B D, Lin Q, Cao D P, et al. Sorption and desorption of sulfadiazine by soil and its components [J]. Soils, 2018,50(5):949-957.
[27] Jong Yol Park, Bernd Huwe. Effect of pH and soil structure on transport of sulfonamide antibiotics in agricultural soils. [J]. Environmental Pollution, 2016,213:561-570..
[28] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2000.
Lu R K. Methods for agricultural chemical analysis of soil [M]. Beijing: China agricultural science and technology press, 2000.
[29] 杨亚提,张 平.离子强度对恒电荷土壤胶体吸附Cu2+和Pb2+的影响 [J]. 环境化学, 2001,20(6):566-571.
Yang Y T, Zhang P. Ionic strength effects on Cu2+, Pb2+adsorption in constant charge soil colloids [J]. Environmental Chemistry, 2001,20(6): 566-571.
[30] Guo X T, Tu B, Ge J H, et al. Sorption of tylosin and sulfamethazine on solid humic acid. [J]. Journal of Environmental Sciences, 2016, 43(5):208.
[31] Wu D, Pan B, Wu M, et al. Co-adsorption of Cu and sulfamethoxazole on hydrolized and graphitized carbon nanotubes. [J]. Science Total Environment, 2012,428:247-252.
[32] 蒋煜峰,温 红,张 前,等.环丙沙星在黄土中的吸附机制及影响因素 [J]. 中国环境科学, 2019,39(10):4262-4269.
Jiang Y F, Wen H, Zhang Q, et, al. Adsorption mechanism and influencing factors of ciprofloxacin on loess [J]. China Environmental Science, 2019,39(10):4262-4269.
Effect of Cu2+coexistence on adsorption of sulfadiazine in soil.
XU Zi-wen1, DONG Meng-yang1, LIU Xi-juan1, SHAO Yi-fei1, LV Shi-quan1, HU Shu-xiang1, XU Yu-zhi2, HU Xin-xin2, LIU Ai-ju2*
(1.School of Agricultural Engineering and Food Science, Shandong University of Technology, Zibo 255091, China;2.School of Resources and Environment Engineering, Shandong University of Technology, Zibo 255091, China)., 2021,41(6):2773~2779
Copper (Cu) and Sulfadiazine (SDZ) were selected as target pollutants as their high detection rate in soil environment. The batch sorption methods were used to investigate effects of pH, ion concentration, organic matter content and particle size on SDZ adsorption to soil with Cu2+co-existing. The adsorption mechanism of SDZ in soil was characterized by FT-IR analysis. Co-existence of Cu2+significantly increased the adsorption amount of SDZ on soil even with different pH conditions. Both Cu2+and Ca2+could promote SDZ adsorption to soil particles by complexation and ion-bridge. The effect of organic matter on adsorption of SDZ on soil was greatly related to concentrations of the co-existing Cu2+. The adsorption of SDZ to soil clay was little influenced by the co-existing Cu2+. FT-IR analysis showed that the physical adsorption was the main mechanism of SDZ adsorption to soil, which was also accompanied by hydrogen bonding interactions, complexation and π-π conjugation. Cu2+can significantly increase the retention capacity of SDZ in soil and reduce its risk of environmental migration.
sulfadiazine;soil;copper;adsorption;influencing factors
X131.3
A
1000-6923(2021)06-2773-07
徐子文(1996-),女,山东青岛人,山东理工大学硕士研究生,主要从事土壤环境污染及修复研究.
2020-10-30
国家自然基金资助项目(41877122,41671322);山东省重点研发计划(2019GSF109058)
* 责任作者, 教授, aijvliu@sdut.edu.cn
