柚子全果果酒发酵工艺优化及其抗氧化活性、挥发性成分分析
2021-07-23谭敏华张巧苑于立梅曾晓房陈海光
谭敏华,张巧苑,于立梅,,曾晓房,陈海光
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.仲恺农业工程学院现代农业工程创新研究院,广东广州 510225;3.东莞海关综合技术中心,广东东莞 523073)
琯溪蜜柚有“天然罐头”之称,其果皮呈黄色,具有清甜微酸、瓤肉洁白等特点,在我国西周时期已有栽培,主要分布在东南沿海地区[1]。琯溪蜜柚不仅含有丰富的营养物质如矿物质、维生素等[2−3],还能增强人体免疫力和预防疾病的发生[4],是一种老少咸宜的保健食品。
柚子全果果酒是以柚子皮和瓤肉为原料经破碎等工序酿造而成的低度酒,含有多种抗氧化活性成分和挥发性风味物质,受到人们的青睐[5−6]。适量饮酒有益于人体健康,降低心血管疾病的发生[7−9]、抑制动脉平滑肌收缩[10]、促进血液循环和抗癌[11]等功效。随着发酵时间延长,果酒中的挥发性风味物质逐渐增多。香气成分的测定是柚子全果果酒在酿造过程中的重要指标之一,可直接反映出果酒品质的好坏,并影响消费者的选购心理。顶空固相微萃取和气质(Gas Chromatography Mass Spectrometer,GCMS)联用技术是目前应用于发酵果酒挥发性风味物质测定分析的主要方法[12]。
目前果酒的品种逐渐增多,但柚子酒相关的研究相对较少,多数柚子的加工中是以柚子肉为原料,柚子皮被舍弃。柚子皮中含有多种功效成分如柚皮苷等,具有较高的营养价值[13]。柚子皮在加工过程中常常被丢弃,这会对环境造成巨大的污染。此外,国内外关于柚子全果果酒的抗氧化性和香气成分鲜见报道。本研究以新鲜的柚子皮和瓤肉为原料,在单因素实验的基础上利用正交试验对其发酵工艺进行优化并测定成品酒的体外抗氧化活性和香气成分,为柚子酒工业化、规模化和标准化生产提供科学参考。
1 材料与方法
1.1 材料与仪器
福建琯溪蜜柚 购于广州华润超市;酿酒活性干酵母 购于安琪酵母旗舰店;1,1-二苯基-2-苦基肼基(DPPH)、氯化钠、食用小苏打、六水三氯化铁、七水硫酸亚铁、偏重亚硫酸钾、无水乙醇、冰乙酸、果胶酶(500U/mg)、三吡啶基三嗪(TPTZ)、醋酸钠、白砂糖、食盐、柠檬酸(食品级)购于广州硕玛实验室仪器有限公司;试剂均为分析纯。
WYT-J手持糖度计 成都豪创光电仪器有限公司;DFG-02.300 电热恒温鼓风干燥箱 黄石市恒丰医疗器械有限公司;PHB-3pH便携式pH计 上海三信仪表厂;HH-s4 数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;WYA-2W阿贝折射仪 上海精密科学仪器有限公司;UV759 紫外可见分光光度计 上海精密科学仪器有限公司;BSP-250 程控生化培养箱 上海博讯实业有限公司医疗设备厂;6890-5973N气相色谱质谱仪 美国Agilent科技有限公司;PDMS50 固相微萃取装置 深圳市东方蓝泰科技有限公司;57330-U萃取手柄 美国Supelco公司。
1.2 实验方法
1.2.1 柚子果酒加工工艺流程及操作要点 新鲜柚子→清洗→切粒→皮肉配比选定→脱苦→打浆→酶解处理→灭酶→添加SO2→调糖调酸→接种→发酵→过滤→陈酿→成品
操作要点:
清洗、切粒:新鲜柚子洗净后剥皮,去籽,取全肉,柚子皮削掉表面青皮留白皮,并将其切成1 cm3的颗粒,备用。
皮肉配比选定:选择三个具有代表性的比例,分别是①肉:皮=1:1、②肉:皮=1:2、③肉:皮=2:1,按以上比例加入等比例的蒸馏水混合进行酿造。发酵7 d时测定酒精度,选出最合适的皮肉配比进行发酵工艺优化实验。
脱苦:往柚子皮上撒5%食盐,反复揉搓后挤去汁液,重复三次,用蒸馏水将柚子皮中的盐分洗净,挤干,备用。
打浆:原料与纯净水等比例混合(m:V=1:1),放入打浆机中打成糊状,有利于下一步酶解[14]。
酶解与灭酶:往打浆后的原料中加入0.025%果胶酶,于40 ℃水浴锅中酶解2 h,并在90~95 ℃下灭酶5 min。
添加SO2:将全果发酵液与80mg/L偏重亚硫酸钾充分混合,搅拌均匀。
调糖:由于柚子全果含糖量不高,制得的原液含糖量较低(3%~4%),所以要根据酵母酿酒所需的糖度来进行发酵前的调配。向原液中加入精制白砂糖后充分搅拌使其完全溶解,使用手持糖度计测定其糖度,以确定是否达到发酵所需糖度。总糖含量计算公式如下:

式中,A为总糖质量分数(%),B为柚子汁的质量(g),C为糖的添加量(g),D为原柚子汁的含糖量(%)。
调pH:使用柠檬酸或小苏打将柚子原液的pH控制在3.0~5.0 之间,达到最好的发酵条件。
酵母活化与接种:取10%的活性干酵母加入到含糖量为4%的温水(34~40 ℃)中,混匀后静置,搅拌20~30 min后直接加入柚子原液进行发酵。
确定发酵时间:取600 mL发酵液于锥形瓶中在20 ℃条件下进行发酵,每隔1 d测定一次酒精度,直到所测数据趋于稳定时,方可确定发酵时间。
过滤:发酵结束后用滤布滤去酒渣,再将滤液离心取得上清液。
陈酿:离心后得到的上清液进行低温后发酵(15 ℃)。
1.2.2 单因素实验
1.2.2.1 含糖量对柚子全果果酒酒精度的影响 取200 mL柚子原液在温度20 ℃,含糖量分别为16%、18%、20%、22%、24%,偏重亚硫酸钾120 mg/L,酵母菌接种量1.0%,初始pH4.0 的条件下进行酿制,发酵7 d时测定酒精度。
1.2.2.2 偏重亚硫酸钾添加量对柚子全果果酒酒精度的影响 取200 mL柚子原液在温度20 ℃,含糖量20%,偏重亚硫酸钾分别为0、40、80、120、160 mg/L,酵母菌接种量1.0%,初始pH4.0 的条件下进行酿制,发酵7 d时测定酒精度。
1.2.2.3 酵母接种量对柚子全果果酒酒精度的影响 取200 mL柚子原液在温度20 ℃,含糖量20%,偏重亚硫酸钾120 mg/L,酵母菌接种量分别为0.4%、0.7%、1.0%、1.3%、1.6%,初始pH4.0 的条件下进行酿制,发酵7 d时测定酒精度。
1.2.2.4 初始pH对柚子全果果酒酒精度的影响 取200 mL柚子原液在温度20 ℃,含糖量20%,偏重亚硫酸钾120 mg/L,酵母菌接种量1.0%,初始pH分别为3.0、3.5、4.0、4.5、5.0 的条件下进行酿制,发酵7 d时测定酒精度。
1.2.3 正交试验 在单因素实验的基础上,选取含糖量、偏重亚硫酸钾添加量、酵母接种量和初始pH4 个因素,以酒精度为指标,进行正交试验设计以确定柚子全果果酒的最佳发酵工艺。正交试验因素水平如表1 所示。
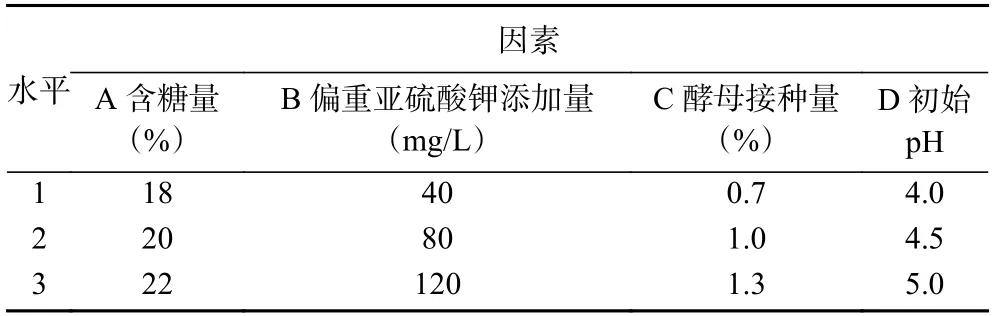
表1 正交试验因素水平设计Table 1 Orthogonal test factors level design
1.2.4 理化指标测定 乙醇体积分数的测定:酒精计;pH的测定:PHB-3pH便携式pH计;可溶性固形物的测定:手持糖度计。
1.2.5 体外抗氧化活性测定
1.2.5.1 DPPH自由基清除能力测定 参考Kilani等[15]的方法并稍作修改。柚子全果果酒是在含糖量22%,偏重亚硫酸钾分别为40 mg/L,接种量1.0%,初始pH 4.0 的条件下制作的。取0.2 mL柚子全果果酒加入4 mL 0.1 mmol/L DPPH溶液在常温暗处反应30 min测517 nm的吸光度A1,从发酵第1~9 d每隔2 d测一次吸光度A1。以0.2 mL 50%乙醇代替样品为对照,测517 nm的吸光度A2。以无水乙醇为空白。按式(1)计算DPPH·清除率:

1.2.5.2 铁离子还原能力测定 参照Iris等[16]的方法并稍作修改。柚子全果果酒是在含糖量22%,偏重亚硫酸钾分别为40 mg/L,接种量1.0%,初始pH 4.0 的条件下制作的。取2.5 mL TPTZ(10 mmol/L)、2.5 mL FeCl3·6H2O(20 mmol/L)和25 mL pH3.6 醋酸缓冲液(0.3 mol/L)充分混匀得到FRAP溶液,在37 ℃恒温水浴锅中贮藏备用。取3mL FRAP溶液加入3 mL超纯水和0.1 mL柚子全果果酒充分混合后于37 ℃水浴锅中避光放置5 min,以超纯水代替柚子全果果酒为空白,从发酵第1~9 d每隔2 d测一次吸光度(593 nm)。以FeSO4·7H2O为标品制作标曲:y=0.0071x+0.0692(R2=0.9988),根据标曲计算硫酸亚铁的浓度(mmol/L)。
1.2.6 香气成分分析
1.2.6.1 香气成分的富集 柚子全果果酒是在含糖量22%,偏重亚硫酸钾分别为40 mg/L,接种量1.0%,初始pH 4.0 的条件下制作的。取7 mL柚子全果果酒和1 g NaCl于15 mL顶空瓶中,用萃取头(57330-U)在40 ℃下吸附45 min,解析5 min,进行分析。
1.2.6.2 气相色谱-质谱条件 色谱柱:HP-5MS色谱柱(19091S-413,30 m×0.25 mm,0.25 μm);载气He;进样口温度250 ℃;程序升温:35 ℃保持2 min,以5 ℃/min升至50 ℃,再以6 ℃/min升至110 ℃,最后以8 ℃/min升至230 ℃,保持5 min;柱流量0.8 mL/min;不分流进样;质量扫描范围50~550 amu;离子源温度250 ℃;电离方式EI;电子能量70 eV;传输线温度250 ℃。
1.3 数据处理
2 结果与分析
2.1 发酵时间的确定
由图1 可知,随着发酵时间延长,柚子全果果酒的酒精度先上升后趋于平缓,在第7 d达到了13%vol。在第7~9 d时,柚子全果果酒的酒精趋于平缓,可能是酵母菌在发酵过程中逐渐衰老,使得糖的转化率逐步下降,导致果酒的酒精度增加渐缓。故可以确定柚子全果果酒的发酵时间为7 d。
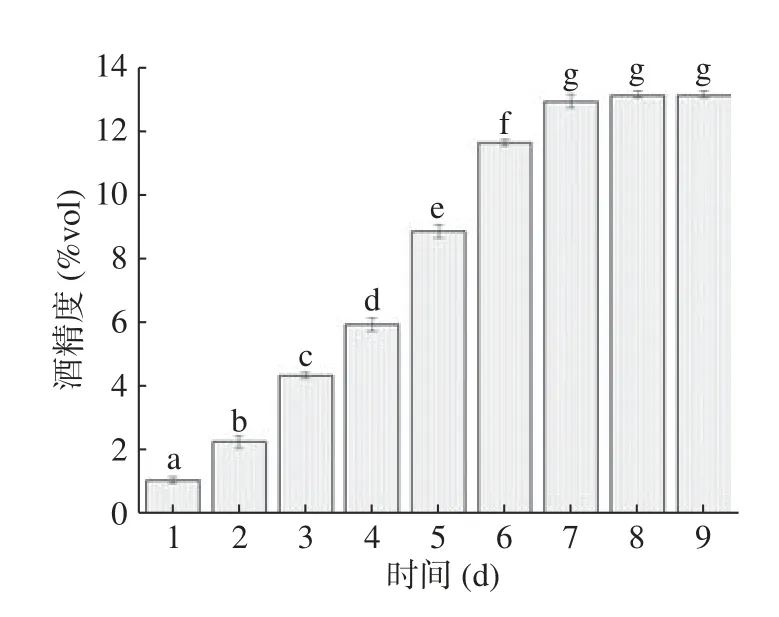
图1 柚子全果果酒在发酵过程中酒精度的变化Fig.1 Changes in alcohol content of grapefruit whole fruit wine during fermentation
2.2 单因素实验结果
2.2.1 含糖量对柚子全果果酒酒精度的影响 由图2可知,随着含糖量增加,柚子全果果酒的酒精度逐渐升高后趋于平缓,在20%时达到了13.4%vol,说明当含糖量偏高时,发酵液中酵母菌将部分糖醇化,使多余糖分无法被消耗变成酒精,导致果酒中残留总糖过多,造成品质下降。此结果与于斌等[17]研究含糖量对沙果果酒发酵中酒精度变化的结果相似。因此,含糖量选择为20%。

图2 含糖量对柚子全果果酒酒精度的影响Fig.2 The effect of sugar content on the alcohol content of grapefruit whole fruit wine
2.2.2 偏重亚硫酸钾添加量对柚子全果果酒酒精度的影响 果酒制作过程中添加偏重亚硫酸钾能产生SO2,对果酒的抗氧化、澄清、增酸、护色和抑菌起着重要作用。由图3 可知,随着偏重亚硫酸钾添加量的增加,柚子全果果酒的酒精度先升高后下降,在80 mg/L时达到了13.3%vol。当偏重亚硫酸钾添加量为80~160 mg/L时,柚子全果果酒的酒精度有所下降,可能是添加偏重亚硫酸钾后产生SO2过多不利于酵母菌利用糖类发酵生成酒精[5]。此结果与王娅玲等[18]研究SO2添加量对木奶果果酒发酵中酒精度变化的结果相似。因此,偏重亚硫酸钾添加量选择为80 mg/L。
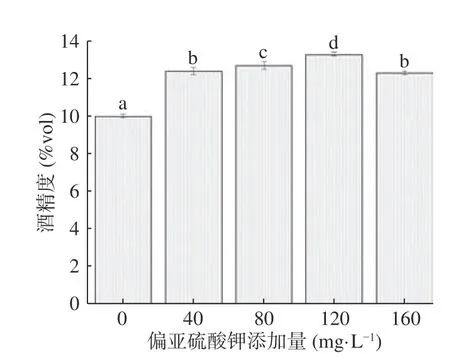
图3 偏重亚硫酸钾对柚子全果果酒酒精度的影响Fig.3 Effect of potassium bisulfite on the alcohol content of grapefruit whole fruit wine
2.2.3 接种量对柚子全果果酒酒精度的影响 由图4可知,随着酵母接种量的增加,柚子全果果酒的酒精度先升高后下降,在1.0%时达到了14.2%vol。当接种量为1.0%~1.6%时,柚子全果果酒的酒精度有所下降,可能是接种量过多,大量微生物代谢会消耗部分糖分,造成发酵液中糖分不足,导致果酒中乙醇体积分数下降[19−20];或代谢产物持续累积抑制了酵母菌的生长,加快酵母菌的衰老,造成果酒中酒精度下降[21−22]。此结果与王孝荣等[5]研究酵母接种量对草莓果酒发酵中酒精度变化的结果相似。因此,酵母接种量选择为1.0%。

图4 接种量对柚子全果果酒酒精度的影响Fig.4 Effect of inoculation amount on the alcohol content of grapefruit whole fruit wine
2.2.4 初始pH对柚子全果果酒酒精度的影响 由图5 可知,随着初始pH增加,柚子全果果酒的酒精度逐渐升高后趋于平缓,在4.5 时达到了14.2%vol。当初始pH为4.5~5.0 时,柚子全果果酒的酒精度趋于平缓,可能是酵母菌的最适pH在4.5~5.0 之间,酵母菌稳定生长,果酒中的糖被醇化,使果酒中的酒精度趋于稳定,有利于维持果酒的发酵和成品质量[23−24]。因此,初始pH选择为4.5。

图5 初始pH对柚子全果果酒酒精度的影响Fig.5 Effect of initial pH on the alcohol content of grapefruit whole fruit wine
2.3 正交试验结果
以酒精度为指标,采用L9(34)正交试验方法,确定柚子全果果酒的最佳发酵工艺。正交试验设计及结果见表2。

表2 正交试验设计及结果Table 2 Orthogonal test design and results
由表2 可知,影响柚子全果果酒发酵工艺的因素依次是A>D>B>C,即影响柚子全果果酒发酵工艺的因素依次为含糖量、初始pH、偏重亚硫酸钾添加量、酵母接种量。由表3 可知,因素A为差异显著因素(P<0.05),因素B、C、D为差异不显著因素(P>0.05),此结果与直观分析结果一致。最佳发酵工艺分别为A3B1C2D1和A3B2C2D1,即含糖量22%,偏重亚硫酸钾添加量分别为40、80 mg/L,酵母接种量1.0%,pH4.0,在此条件下柚子全果果酒的酒精度分别为14.4%vol和14.2%vol。因此柚子全果果酒的最优发酵工艺为A3B1C2D1,对应柿子全果果酒酒精度为14.4%vol。

表3 方差分析表Table 3 Analysis of variance table
2.4 体外抗氧化活性分析
2.4.1 DPPH自由基清除能力分析 由图6 可知,随着发酵时间延长,柚子全果果酒中DPPH·清除能力逐渐下降后趋于平缓。发酵时间到第9 d时,DPPH·清除率下降了5.01%,发酵到第7 d时基本达到稳态。分析原因有以下三个方面:第一,活性酵母在发酵过程中产生次级代谢产物,同时其细胞壁吸附了果酒中的抗氧化物质[25]。第二,在微生物酶催化下,柚子细胞壁会分解生成蛋白质、糖苷等物质,使DPPH自由基清除率下降。第三,果酒发酵过程中的pH、温度、酒精度等均可影响DPPH自由基清除率[26],导致果酒在发酵过程中多酚和黄酮类化合物含量下降,使其抗氧化活性下降[27]。

图6 柚子全果果酒DPPH·清除率的动力学反应Fig.6 Kinetic reaction of DPPH free radical scavenging rate from grapefruit wine
2.4.2 铁离子还原能力分析 由图7 可知,随着发酵时间延长,柚子全果果酒中FRAP值逐渐下降后趋于平缓,在第1 d时达到了164.39 mmol Fe2+/L。分析原因可能是果酒中各种活性成分在发酵阶段不断被浸出,使其抗氧化活性较强。发酵时间到第9 d时,铁离子还原能力下降了13.99 mmol Fe2+/L,发酵到第7 d时基本达到稳态。分析原因有以下三个方面:第一,果酒在过滤时与氧气充分接触,其抗氧化活性成分在发酵阶段被氧化,造成铁离子还原能力下降[28];第二,单体酚和酚酸等抗氧化物质在发酵阶段参与了果酒中尚未结束的生化反应,不断合成、分解产生花色苷衍生物和结合态酚酸衍生物,使其抗氧化能力下降[29−30];第三,果酒在密闭环境中进行发酵,氧气几乎完全消耗,使抗氧化能力趋于稳定。
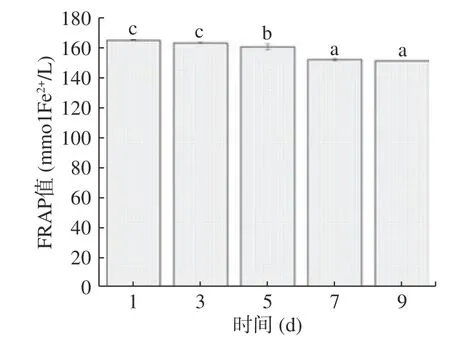
图7 柚子全果果酒铁离子还原能力的动力学反应Fig.7 Kinetic reaction of iron reduction ability from grapefruit whole fruit wine
2.5 香气成分分析
图8 为柚子全果果酒香气物质的GC-MS分析离子流色谱图,各组分鉴定的结果如表4 所示。由表4 可知,采用顶空固相微萃取结合气质联用技术初步鉴定出柚子全果果酒的香气物质有23 种。其中,相对含量>1%的香气物质为:苯乙醇(22.54%)、醋酸(9.10%)、辛酸乙酯(8.90%)、3-甲基-1-丁醇乙酸酯(13.01%)、芳樟醇(8.83%)、癸酸乙酯(8.04%)、乙醇(3.21%)、9-溴壬酸乙酯(2.59%)、3-甲基丁醇(1.61%)、正己酸乙酯(20.29%)、乳酸乙酯(2.02%)、1-甲氧基-2-丁醇(1.25%)。康明丽等[31]研究柑橘果酒的挥发性风味物质,发现苯乙醇、辛酸乙酯、癸酸乙酯和正己酸乙酯等为果酒作出主要贡献。苯乙醇为柚子果酒提供清甜的玫瑰花香,不仅能够杀菌,还能用于制作香精香料[32]。大多数酯类物质具有花果香味或浓郁的酒香味,如辛酸乙酯、癸酸乙酯和正己酸乙酯分别为柚子果酒提供酒香味、椰子香和水果香[31]。

图8 柚子全果果酒香气物质的GC-MS分析离子流色谱图Fig.8 GC-MS analysis ion chromatogram of aroma substances from grapefruit whole fruit wine

表4 柚子全果果酒中主要香气成分Table 4 Main flavor compounds from grapefruit whole fruit wine
通过对柚子全果果酒的香气成分分析,共鉴定出酯类化合物10 种,醇类化合物9 种、酸类化合物4 种。酯类的相对含量为58.36%;醇类的相对含量为40.69%;酸类的相对含量为11.38%。
3 结论
以瓤肉和柚子皮为原料酿制果酒,不仅能够增加柚子的附加值,还能避免资源浪费问题。利用正交试验对4 个因素进行优化分析,获得最优发酵参数为:含糖量22%,偏重亚硫酸钾添加量40 mg/L,酵母接种量1.0%,pH4.0,在此条件下柚子全果果酒的酒精度为14.4%vol。DPPH自由基清除率和铁离子还原能力结果表明随着发酵时间延长,柚子全果果酒的体外抗氧化能力逐渐下降。采用顶空固相微萃取结合GC-MS技术分析柚子全果果酒的香气成分,初步鉴定出23 种香气物质,其中酯类化合物的种类和相对含量分别占总香气物质的43.48%和58.36%。
