柴胡皂甙D对于人类肝癌细胞自噬水平的影响及其分子机制研究
2021-07-22纪梅芳许惠春
纪梅芳,许惠春
(厦门大学附属第一医院,福建 厦门 361000)
原发性肝癌在临床被诊断时多数患者处于中晚期,失去手术治疗的机会[1]。因此,发现对人体正常组织损伤小的有效药物已成为肝癌治疗的关键。细胞自噬是在能量贫乏、外界刺激等压力下,为了维持细胞的稳态,机体通过降解细胞内变性、损伤、衰老的细胞器回收利用营养物质,实现细胞自身代谢需要和细胞器的更新。细胞自噬一方面促进细胞死亡,另一方面能够促进细胞的存活。大多数文献认为自噬可抑制肿瘤的形成[2-3]。在肿瘤早期,自噬能限制肿瘤中的坏死与炎症,从而间接抑制肿瘤细胞的转移。因此,对于细胞自噬的相关研究,有助于深入了解肿瘤的发病机制,指导临床诊疗。柴胡皂苷是中药柴胡的主要成分,其成分中药理活性最大的即柴胡皂苷D(SSD)[4]。其可以调节免疫因子,对于抗炎、抗病毒、护肝等均有显著作用,毒副作用小[5-6]。本文目的在探讨柴胡皂甙D(SSD)对人肝癌细胞自噬水平的影响,为肝癌治疗提供借鉴。
1 材料和方法
1.1 研究材料
人肝癌细胞系PLC、MHCC-97H、SMMC-7721以及Huh7均购自美国模式培养物集存库(ATCC)。
1.2 实验方法
1.2.1 实验分组
所有细胞分三组,对照组、SSD组、SSD+自噬抑制剂3-MA组。对照组不做任何处理。SSD组的细胞采用20 mM的SSD处理48小时。SSD+自噬抑制剂3-MA组的细胞同时采用20 mM的SSD和10 mM 的3-MA处理48小时。
1.2.2 MTT法检测SSD对于肝癌细胞体外增殖的影响
将对数生长期的人肝癌细胞系PLC、MHCC-97H、SMMC-7721和Huh7常规消化、离心并重新悬浮以制备单细胞悬浮液。将细胞以5×103细胞/孔的密度接种到96孔细胞培养板中。将其置于37°C和5% CO2细胞培养箱中过夜。第二天,从培养皿中取出培养基,向培养基100μL中添加20 mM SSD。常规培养72小时后,向每个培养皿中添加20μL MTT(5 mg/mL)。常规培养4小时后,加入150μL二甲基亚砜溶液以吸收上清液,并在无光条件下休克10分钟。将96孔培养板置于微孔板读取器中,检测每个孔在490 nm处的吸光度值。
1.2.3 克隆形成试验
将对数生长期的人肝癌细胞系PLC、MHCC-97H、SMMC-7721和Huh7常规消化、离心并重新悬浮以制备单细胞悬浮液。以1×103细胞/孔的密度,将细胞接种到6孔细胞培养板中,并在37℃的5% CO2细胞培养箱中过夜。第二天,从孔中取出培养基,并向培养基中添加20 mM SSD 100μL。常规培养持续2周,每3天更换一次液体。将培养基从孔中吸出,用4%多聚甲醛固定15分钟,用0.1%结晶紫染色5分钟。用去离子水冲洗后,用数码相机记录细胞克隆,并进行定量(Bio-RAD),克隆形成率(%)=药物处理组克隆数/对照组克隆数×100%。
1.2.4 流式细胞术检测细胞凋亡
将对数生长期的人肝癌细胞系PLC、MHCC-97H、SMMC-7721和Huh7常规消化、离心并重新悬浮以制备单细胞悬浮液。以2×105细胞/孔的密度,将细胞接种到6孔细胞培养板中,并在37℃的5% CO2细胞培养箱中过夜。第二天,更换含有20 mM SSD的培养基,用胰蛋白酶消化细胞,离心,并在常规培养24小时后收集。用PBS洗涤细胞两次,然后用250μL的结合缓冲液悬浮,并将细胞浓度调整为1×106细胞/mL。
1.2.5 肝癌细胞p-AKT、p-AMPK、LC3-Ⅱ蛋白质免疫印迹(Western Blot)
加热融化试剂盒三种试剂,在冰上充分混合。血浆蛋白提取的适宜试验剂量;加入PMSF(1∶10)。在最初的5分钟内,PMSF增加了核蛋白提取试剂的用量。用EDTA溶液消化PBS 6cm培养皿(90%密度)中的细胞,并将细胞吹倒。离心速度为12000 RPM,离心管控制几分钟。每52μL细胞用PMSF细胞质试剂沉淀520μL,最大速度和严重电击5秒,细胞沉淀完全悬浮和分散,冰浴10min;B高速下5秒最大振动26μL,冰浴1分钟,4℃下12000g离心5分钟;立即排空预冷EP管(避免接触从细胞质蛋白质中提取的沉淀物),以获得。取等量样品,与5份样品X缓冲液混合,煮沸5分钟,在冰水中快速冷却。通过电泳分离10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶,并将蛋白质分离方法转移到聚偏氟乙烯膜上。将聚偏氟乙烯薄膜浸入密封溶液中,并在室温下密封1小时。取下封闭的PVDF膜,用小袋冲洗,并在4摄氏度的夜间温度下培养。冲洗3次。将PVDF膜转移到含有两种电抗的小袋中,并在室温下孵育。清洗三次后,将PVDF膜置于塑料膜上,取适量ECL试剂5分钟,将凝胶成像分析仪置于成像系统中。
1.3 统计学分析
2 结果
2.1 SSD抑制肝癌细胞的增殖
SSD干预48小时后,与对照组相比,人类肝癌细胞PLC、MHCC-97H、SMMC-7721和Huh7细胞的活性分别下降(19.49±2.92)%、(45.41±7.95)%、(53.84±5.53)%和(64.04±4.36)%,差异显著(P<0.05)。SSD+3-MA组细胞活性与对照组无显著性差异(P>0.05)。这些结果表明,SSD可以显著抑制肝癌细胞的活性,这种抑制是通过诱导肝癌细胞自噬来实现的。见图1。
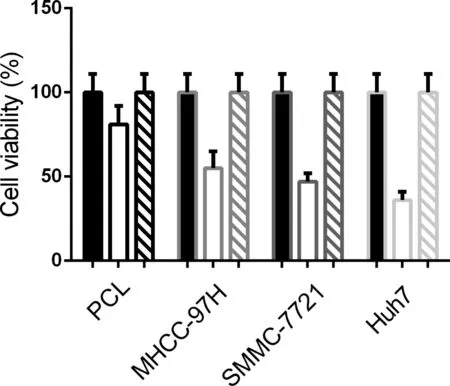
图1 SSD抑制肝癌细胞的增殖
2.2 SSD抑制肝癌细胞的克隆形成
SSD处理2周后,与对照组相比,人类肝癌细胞PLC、MHCC-97H、SMMC-7721和Huh7细胞克隆数分别减少(57.11±6.55)%、(47.23±5.15)%、(51.45±5.56)%和(45.45±6.75)%(P<0.05)。SSD+3-MA组克隆数与对照组无显著性差异(P>0.05)。这些结果表明,SSD能显著抑制HCC细胞的克隆形成,这种抑制是通过诱导HCC细胞自噬来实现的。见图2。
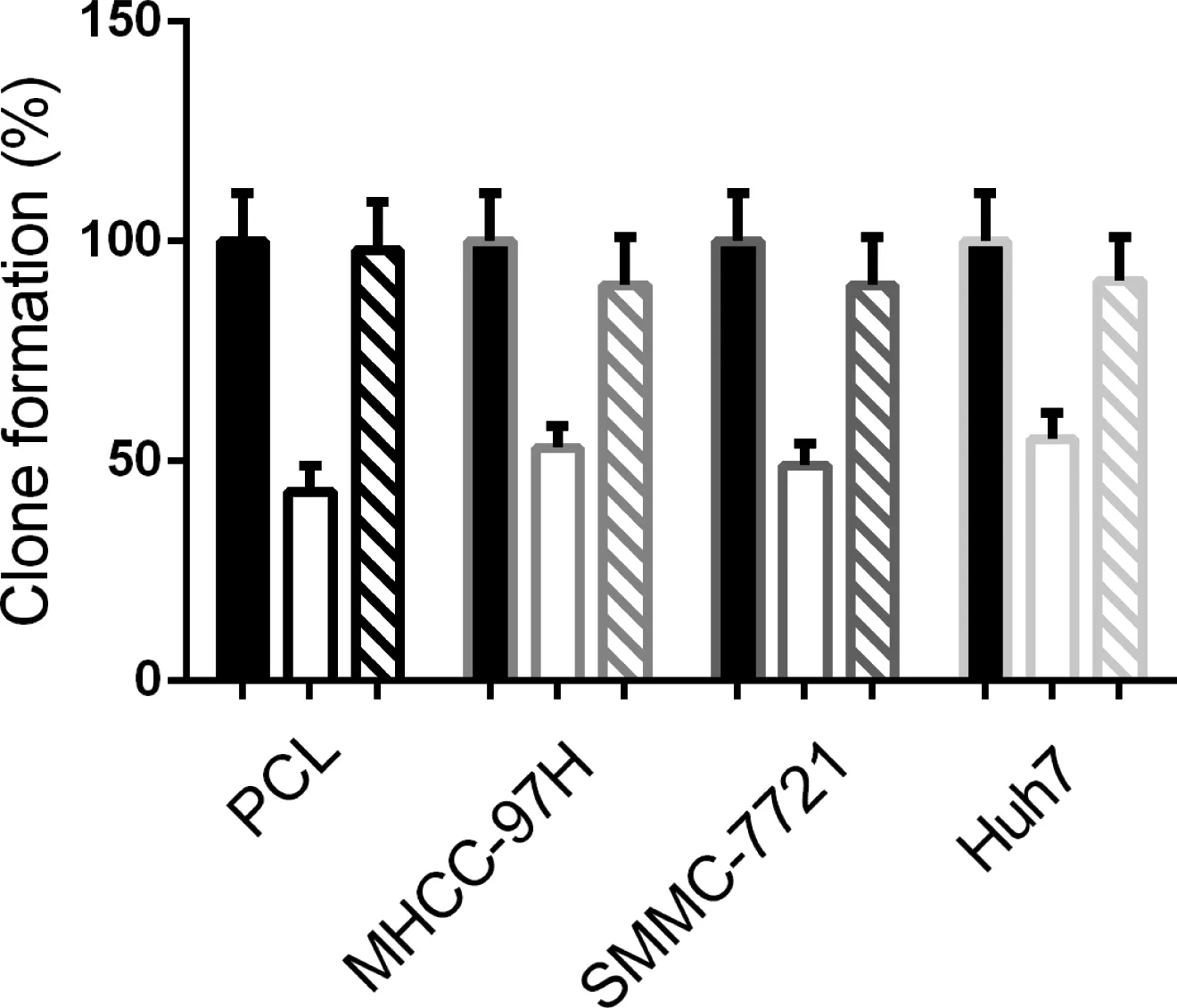
图2 SSD抑制肝癌细胞的克隆形成
2.3 SSD诱导肝癌细胞发生凋亡
数据显示,PLC、MHCC-97H、SMMC-7721和Huh7细胞的凋亡率分别为(11.67±1.17)%、(17.54±1.83)%、(15.45±1.55)%、(15.54±1.57)%,与对照组相比差异显著(P<0.05)。SSD+3-MA组细胞凋亡率与对照组差异不显著(P>0.05)。这些结果表明,SSD可以诱导肝癌细胞凋亡,这种诱导是通过诱导肝癌细胞自噬来实现的。见图3。
2.4 SSD诱导肝癌细胞中自噬小体的形成
经过SSD处理后,PLC、MHCC-97H、SMMC-7721以及Huh7的细胞中自噬小体大量增加。而对照组细胞和SSD+3-MA组的细胞的细胞并未出现自噬小体。见图4。
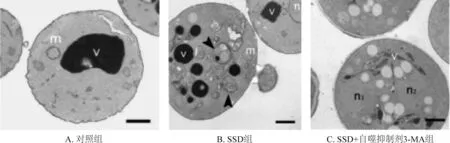
图4 SSD诱导肝癌细胞中自噬小体的形成
2.5 SSD通过AMPK/mTOR信号传导通路促进肝癌细胞自噬
estern blot显示,SSD处理后p-AKT不表达,而p-AMPK蛋白表达增加。见图5。
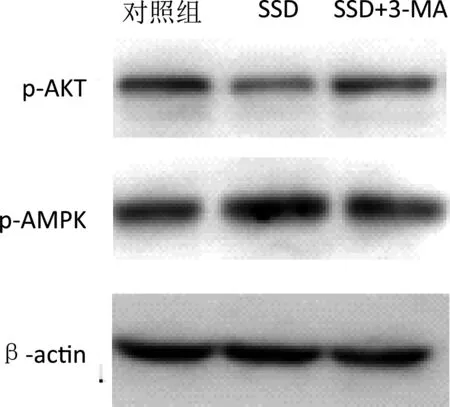
图5 Western-blot条带图
3 讨论
肝癌比较隐匿,发现确诊时多为晚期,严重威胁人类生命健康[7-8]。柴胡在中医中有着悠久的使用历史,性微寒,有疏肝解郁、升阳益气之功效。柴胡中的SSD具有免疫调节、抗炎、保肝、抗病毒、抗肿瘤等药理作用,毒副作用小。SSD作为一种毒副作用小的中药提取物,在原发性肝癌的防治方面取得了显著的成就[9]。
本研究选择人肝癌细胞系PLC、MHCC-97H、SMMC-7721和Huh7作为体外细胞实验的细胞模型,采用SSD进行干预。结果显示,SSD干预48小时后,细胞活性显著低于对照组(P<0.05),证实SSD在体外可以抑制这4个HCC细胞的增殖,这与SSD在其他肿瘤细胞中的结果一致[10]。此外,在加入自噬S抑制剂3-MA后,对照组和对照组之间的细胞活性没有显著差异(P>0.05),表明SSD的抑制作用是通过诱导HCC细胞自噬实现的。此外,本研究还进一步研究了SSD对肝癌细胞克隆形成的影响。SSD治疗2周后,PLC、MHCC-97H、SMMC-7721和Huh7细胞克隆数明显少于对照组(P<0.05)。这些结果表明,SSD能显著抑制HCC细胞的克隆形成,而SSD+3-MA组的克隆形成数量与对照组无显著差异(P>0.05),表明这种抑制是通过诱导HCC细胞自噬实现。
本研究显示SSD组与对照组相比,PLC、MHCC-97H、SMMC-7721和Huh7细胞的凋亡率差异有统计学意义(P<0.05)。这些结果表明,SSD在诱导细胞凋亡方面作用显著,从而抑制肝癌细胞增值[11]。此外,SSD+3-MA组的细胞凋亡率与对照组差异不明显(P>0.05)。这些结果表明,SSD通过诱导肝癌细胞自噬来以致细胞凋亡。此外,本研究还通过电子显微镜研究了SSD对肝癌细胞自噬体的影响。结果表明,与对照组和SSD+3-MA组相比,SSD组自噬体数量显著增加,提示SSD能显著诱导肝癌细胞自噬。研究显示[12]AMPK通过磷酸化自噬基因Beclin1的丝氨酸93、96位点从而影响VPS34的活性。本研究结果提示,SSD通过AMPK/mTOR信号传导来诱导肝癌细胞自噬。
综上所述,SSD通过AMPK/mTOR信号传导通路而达成的来诱导肝癌细胞自噬,促进癌细胞凋亡,对肝癌的临床治疗有借鉴意义。
