外排转运蛋白对异莨菪亭体内处置的调控机制研究
2021-07-21应梦迪谢雨珊朱丽君王立萍区晓君刘中秋
应梦迪,谢雨珊,朱丽君,王立萍,区晓君,刘中秋
广州中医药大学中药学院,国际中医药转化医学研究所,广东 广州 510006
异莨菪亭,又名6-羟基-7-甲氧基香豆素,主要分布于木犀科植物苦枥白蜡树Fraxinus rhynchophyllaHance、白蜡树F.chinensisRoxb.、尖叶白蜡树F.szaboanaLingelsh.的树皮中,是中药秦皮的主要活性成分之一[1-2]。异莨菪亭具有较好的抗氧化、抗炎、抗癌和抗病毒等活性[3-6],易被葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGTs)如UGT1A10、UGT1A9和UGT1A6等催化代谢生成异莨菪亭葡萄糖醛酸苷[7],但异莨菪亭在体内的暴露形式、处置特征及相关调控机制鲜有研究,其成药性数据及特征尚不清晰。乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)和多药耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)是三磷酸腺苷(adenosine triphosphate,ATP)结合盒转运蛋白家族成员,是影响药物体内处置以及药理作用的关键因素[8-9]。目前BCRP和MRP2对异莨菪亭体内处置的影响及调控机制尚不清楚。因此,本研究采用外排转运蛋白基因敲除小鼠模型,探讨BCRP和MRP2对异莨菪亭及其葡萄糖醛酸化代谢产物体内处置的影响及调控机制。
1 材料
1.1 动物
雄性FVB背景Bcrp1-/-小鼠和Mrp2-/-小鼠购自上海南方模式生物科技有限公司,动物合格证号分别为99612800000279、99612800000278。雄性野生型FVB小鼠来源于杂合Bcrp1-/-小鼠或Mrp2-/-小鼠亲代的野生型子代,Bcrp1-/-/Mrp2-/-小鼠由纯合Bcrp1-/-小鼠和Mrp2-/-小鼠杂交获得,采用PCR-STR技术对实验动物进行基因分型。实验动物周龄为6~8周,饲养于温度(25±2)℃、相对湿度50%~60%的SPF级动物房中。动物实验经广州中医药大学动物伦理委员会批准(批准号2020R0005、2020R0006)。
1.2 药品与试剂
异莨菪亭(质量分数≥98%,批号3620)购自上海诗丹德标准技术服务有限公司,其化学结构见图1;内标华法林(质量分数≥98%,批号012801MT-AC)购自美国AccuStandard公司;尿苷二磷酸葡萄糖醛酸(批号SLBW7477)、β-葡萄糖醛酸苷酶(批号069M4017V)、葡萄糖二酸单内酯(批号0000028759)、丙甲菌素(批号118M4018V)、Hank’s平衡溶液(HBSS,批号SLBL7680V)、HEPES缓冲液(批号SLCF4739)购自美国Sigma-Aldrich公司;乙腈、甲醇、甲酸购自德国Merck公司。

图1 异莨菪亭化学结构Fig.1 Structure of isoscopoletin
1.3 仪器
6460超高效液相色谱与质谱联用仪(UHPLC-MS/MS)、6540超高效液相色谱-四极杆飞行时间串联质谱(UHPLC-Q-TOF/MS)、1200高效液相色谱仪(美国Aglient公司);5810R冷冻高速离心机(德国Eppendorf公司);电子分析天平(北京赛多利斯科学仪器有限公司);WS27-2型恒温水浴摇床、真空干燥仪(美国Thermo Fisher Scientific公司);XW-80A型涡旋混合仪(上海沪西分析仪器厂);Benchmark Plus酶标仪(美国Bio-Rad公司)。
2 方法
2.1 异莨菪亭-6-O-β-葡萄糖醛酸苷(isoscopoletin-6-O-β-glucuronide,I-6-G)的制备与鉴定
由于无I-6-G商业化对照品,本研究采用酶催化法合成代谢物I-6-G,其化学结构见图2[10]。葡萄糖醛酸化孵育体系含50 mmol/L磷酸盐缓冲液、5 mmol/L尿苷二磷酸葡萄糖醛酸、5 mmol/L氯化镁溶液、25 μg/mL丙甲菌素、10 mmol/L葡萄糖二酸单内酯、1 mg/mL肝微粒体及80 mmol/L异莨菪亭,将以上试剂混合均匀,于37 ℃水浴中孵育18 h,加入100 μL乙腈溶液,涡旋3 min,14 000 r/min离心30 min,取上清,经HPLC分离收集I-6-G。采用UHPLC-Q-TOF/MS鉴定I-6-G,并通过转换因子确定I-6-G的浓度。
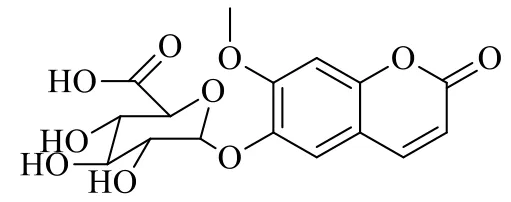
图2 I-6-G的化学结构Fig.2 Structure of I-6-G
2.2 UHPLC-MS/MS分析方法
2.2.1 色谱条件 Aglient Zorbax SB-C18色谱柱(100 mm×3 mm,1.8 mm),流动相为0.1%甲酸水溶液(A)和乙腈(B),梯度洗脱:0~1.5 min,10%B;1.5~3.0 min,10%~50% B;3.0~4.0 min,50%~100% B;4.0~5.0 min,100%~10% B。柱温为37 ℃;体积流量为0.4 mL/min;进样量为2 μL。
2.2.2 质谱条件 电喷雾离子源正离子模式(ESI+);多重反应监测(multiple reaction monitoring,MRM)模式扫描;毛细管电压为4.0 kV;干燥气温度为300 ℃;喷嘴电压为500 V;鞘气温度为350 ℃;氮气体积流量为5 mL/min;鞘气体积流量为12 mL/min;用于定量分析的离子对和碰撞能分别为异莨菪亭(m/z193.0→133.0,20 eV)、I-6-G(m/z369.0→193.0,15 eV)、华法林(m/z309.0→163.2,20 eV)。
2.3 方法学考察
根据文献方法[11],对小鼠血浆中异莨菪亭和I-6-G的定量分析方法进行专属性、线性范围、准确度和精密度、提取回收率和基质效应、稳定性考察。
2.3.1 样品处理 小鼠断尾采血,收集于肝素钠离心管中,6000 r/min离心8 min,取上层血浆,于-20 ℃保存备用。取10 μL血浆样品加入10 μL 50%乙腈,再加入180 μL含20 nmol/L华法林的乙腈溶液,涡旋3 min,14 000 r/min离心10 min,吸取上清于真空干燥仪干燥;加入80 μL 50%乙腈复溶,涡旋3 min,14 000 r/min离心30 min,取上清进行UHPLC-MS/MS分析。
2.3.2 专属性 异莨菪亭、I-6-G和华法林的总离子流图见图3,I-6-G、异莨菪亭和华法林的出峰时间分别为3.5、4.1、5.0 min。待测组分及内标之间的分离效果较好,峰形理想且不受内源性物质等其他成分的干扰。

图3 空白血浆 (A),空白血浆加入异莨菪亭、I-6-G和华法林 (B),ig异莨菪亭后的血浆样品 (C) 的总离子流图Fig.3 Total ion chromatogram of blank plasma (A), blank plasma spiked with isoscopoletin, I-6-G and warfarin (B)and mouse plasma sample after ig isoscopoletin (C)
2.3.3 线性范围 配制一系列浓度的异莨菪亭和I-6-G混合对照品溶液,取10 μL,加入10 μL空白血浆,按“2.3.1”项下方法处理。以各成分与内标峰面积比值为横坐标(Y),各成分浓度为纵坐标(X),进行线性回归分析,求得的回归方程即为标准曲线,根据信噪比为10计算各成分的定量限。异莨菪亭与I-6-G的标准曲线、相关系数、线性范围及定量限见表1。

表1 异莨菪亭和I-6-G在小鼠空白血浆中的标准曲线、相关系数、线性范围和定量限Table 1 Standard curves, correlation coefficients, linear ranges, and limit of quantitation of isoscopoletin and I-6-G in plasma of mice
2.3.4 精密度与准确度 取10 μL空白血浆,分别制备浓度为5 000.00、625.00、39.06 nmol/L的异莨菪亭和浓度为2 000.000、250.000、15.625 nmol/L的I-6-G混合对照品溶液作为高、中、低浓度的质控样品,按“2.3.1”项下方法处理,各浓度样品平行制备6份,样品分别在1 d内测定3次和连续测定3 d,考察日内、日间精密度及准确度。如表2所示,高、中、低浓度质控样品的日内、日间精密度均小于7%,准确度为88%~111%,符合生物样品测定要求。
表2 异莨菪亭和I-6-G的日内、日间精密度和准确度 (±s , n=6)Table 2 Precision and accuracy of intra-day and inter-day of isoscopoletin and I-6-G (±s , n=6)
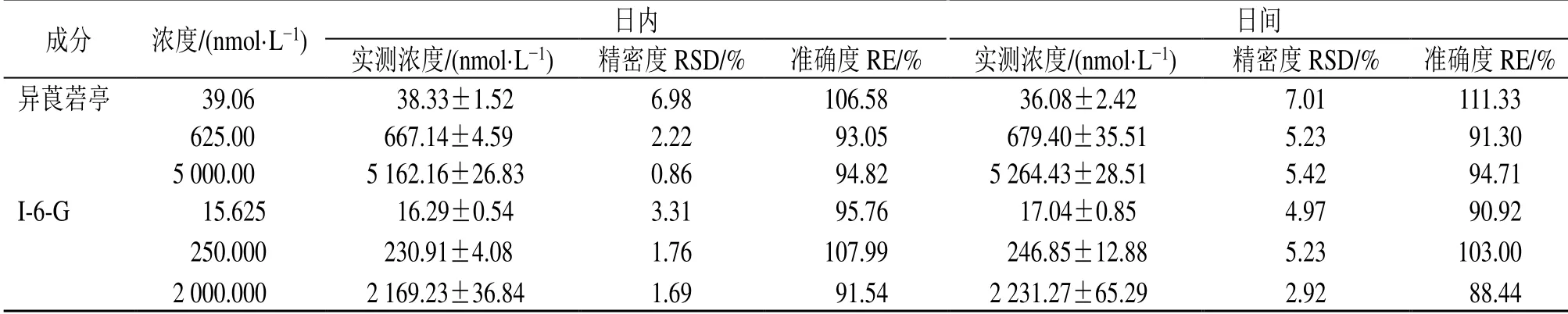
表2 异莨菪亭和I-6-G的日内、日间精密度和准确度 (±s , n=6)Table 2 Precision and accuracy of intra-day and inter-day of isoscopoletin and I-6-G (±s , n=6)
成分 浓度/(nmol·L-1) 日内 日间实测浓度/(nmol·L-1) 精密度RSD/% 准确度RE/% 实测浓度/(nmol·L-1) 精密度RSD/% 准确度RE/%异莨菪亭 0039.060 38.33±1.52 6.98 106.58 36.08±2.42 7.01 111.33 0625.000 667.14±4.59 2.22 93.05 679.40±35.51 5.23 91.30 5 000.000 5 162.16±26.83 0.86 94.82 5 264.43±28.51 5.42 94.71 I-6-G 0015.625 16.29±0.54 3.31 95.76 17.04±0.85 4.97 90.92 0250.000 230.91±4.08 1.76 107.99 246.85±12.88 5.23 103.00 2 000.000 2 169.23±36.84 1.69 91.54 2 231.27±65.29 2.92 88.44
2.3.5 提取回收率与基质效应 取高、中、低浓度质控样品,按“2.3.1”项下方法处理,各浓度样品平行制备6份,进样得到各成分与内标峰面积比值(P1);取10 μL空白血浆,加入180 μL含20 nmol/L华法林的乙腈溶液,涡旋3 min,再加入10 μL高、中、低浓度混合对照品溶液,按“2.3.1”项下方法处理,进样得到各成分与内标峰面积比值(P2);取10 μL高、中、低浓度混合对照品溶液,加入10 μL 50%乙腈溶液,按“2.3.1”项下方法处理,进样得到各成分与内标峰面积比值(P3)。以P1与P2比值计算提取回收率,P1与P3比值计算基质效应。如表3所示,异莨菪亭和I-6-G的测定受生物基质干扰较小,提取回收率稳定,符合样品测定要求。
表3 异莨菪亭和I-6-G在小鼠血浆中的提取回收率和基质效应 (±s , n=6)Table 3 Recovery and matrix effect of isoscopoletin and I-6-G in plasma of mice (±s , n=6)

表3 异莨菪亭和I-6-G在小鼠血浆中的提取回收率和基质效应 (±s , n=6)Table 3 Recovery and matrix effect of isoscopoletin and I-6-G in plasma of mice (±s , n=6)
成分 浓度/(nmol·L-1) 提取回收率 基质效应平均值/% RSD/% 平均值/% RSD/%异莨菪亭 39.06 82.67 6.02 111.58 1.40 625.00 82.31 10.21 107.09 1.89 5 000.00 94.38 6.25 107.49 2.13 I-6-G 15.625 81.36 5.74 105.76 4.44 250.000 87.56 6.40 103.61 3.65 2 000.000 102.41 3.22 109.76 2.57
2.3.6 稳定性 取高、中、低浓度质控样品,分别按“2.3.1”项下方法处理,每份样品平行制备6份,分别于室温放置4 h后考察短期稳定性,于-20 ℃冰箱放置14 d后考察长期稳定性,从-20 ℃至室温反复冻融3次考察冻融稳定性。小鼠血浆中的异莨菪亭和I-6-G在不同处理条件下的稳定性数据见表4,表明本实验中的生物样品短期稳定性、长期稳定性和冻融稳定性良好,满足生物样品分析条件。
表4 小鼠血浆中异莨菪亭和I-6-G的稳定性 ()Table 4 Stability of isoscopoletin and I-6-G in plasma of mice ()
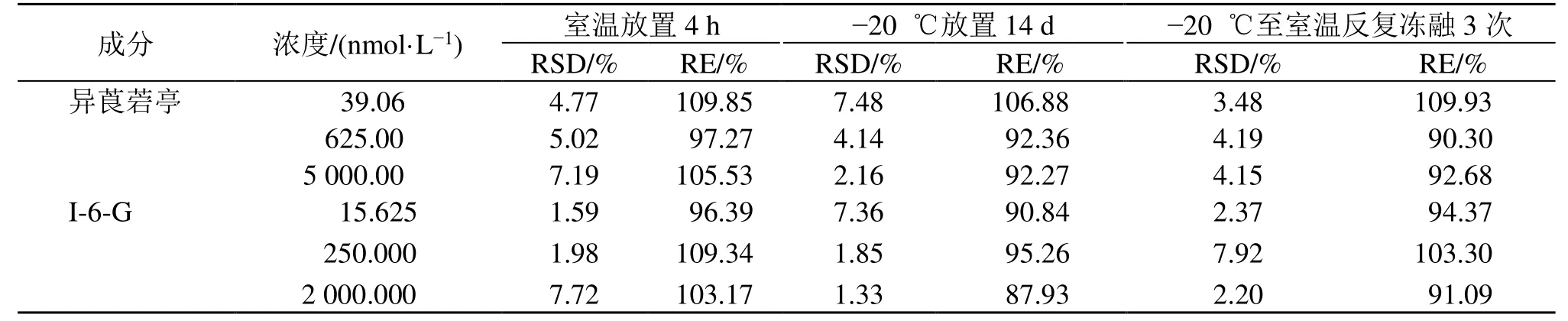
表4 小鼠血浆中异莨菪亭和I-6-G的稳定性 ()Table 4 Stability of isoscopoletin and I-6-G in plasma of mice ()
成分 浓度/(nmol·L-1) 室温放置4 h -20 ℃放置14 d -20 ℃至室温反复冻融3次RSD/% RE/% RSD/% RE/% RSD/% RE/%异莨菪亭 39.06 4.77 109.85 7.48 106.88 3.48 109.93 625.00 5.02 97.27 4.14 92.36 4.19 90.30 5 000.00 7.19 105.53 2.16 92.27 4.15 92.68 I-6-G 15.625 1.59 96.39 7.36 90.84 2.37 94.37 250.000 1.98 109.34 1.85 95.26 7.92 103.30 2 000.000 7.72 103.17 1.33 87.93 2.20 91.09
2.4 异莨菪亭在小鼠体内的药动学研究
野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠分别ig异莨菪亭(2 mg/kg)或尾iv异莨菪亭(1 mg/kg),分别于给药后0、3、5、10、15、20、30、60、120、240、360、480 min断尾采血收集于肝素钠离心管中,按“2.3.1”项下方法处理,取上清进行UHPLC-MS/MS分析。药动学参数采用WinNonlin®3.3非房室模型拟合。
2.5 异莨菪亭在体肠灌流研究
采用小鼠在体单向肠灌流模型,模拟异莨菪亭的肠道处置过程。小鼠在体单向肠灌流手术操作参照本课题组前期研究[12]。含40 μmol/L异莨菪亭的HBSS缓冲液以10 mL/h恒速灌流十二指肠和结肠,预灌流30 min后,每15分钟于十二指肠和结肠出口处收集灌流液。实验结束后测量每个肠段的长度,并收集血浆和胆汁。取50 μL灌流液样品加入450 μL含20 nmol/L华法林的乙腈溶液,涡旋3 min后,14 000 r/min离心30 min,取上清进样UHPLCMS/MS分析。采用重量法计算异莨菪亭在小肠和结肠的表观渗透系数(P*eff)。
P*eff=(1-Cm/Co)/4Gz
其中Cm和Co分别代表肠腔入口和出口药物浓度,Gz是与流量、肠道的长度和扩散系数有关的转换参数
2.6 异莨菪亭在小鼠肝微粒体和小肠微粒体中的酶动力学研究
小鼠肝微粒体和小肠微粒体的制备及浓度测定参照本课题组前期研究[13]。肝微粒体质量浓度为0.025 mg/mL,小肠微粒体质量浓度为0.05 mg/mL,底物异莨菪亭浓度为0.1~5.2 μmol/L。底物分别与肝微粒体和小肠微粒体于37 ℃水浴锅恒温孵育10 min后,加入100 μL含20 nmol/L华法林的乙腈溶液,涡旋3 min,14 000 r/min离心30 min,取上清进行UHPLC-MS/MS分析。使用GraphPad Prism 5软件计算异莨菪亭的酶动力学参数,以代谢速率与底物浓度的比值(V/C)为横坐标,代谢速率(V)为纵坐标,做Eaide-Hofstee图,判断异莨菪亭在小鼠肝微粒体和小肠微粒体中的代谢动力学模型。
3 结果
3.1 I-6-G的鉴定
异莨菪亭经肝微粒体代谢后,可检测到1个单葡萄糖醛酸化代谢物。如图4所示,通过UHPLC-Q-TOF/MS负离子模式检测,发现该代谢物的准分子离子峰为m/z367.066 7[M-H]-,伴随有特征碎片离子m/z191.034 5,即丢失1分子葡萄糖醛酸残基(-176),与理论m/z367.067 1的误差为1.09,推测该代谢物为I-6-G。

图4 I-6-G的提取离子流质谱图Fig.4 Extracted ion chromatogram of I-6-G
3.2 异莨菪亭和I-6-G在小鼠体内的药动学
ig异莨菪亭(2 mg/kg)后,异莨菪亭和I-6-G在野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠体内的药-时曲线见图5,药动学参数见表5。异莨菪亭在体内吸收迅速,吸收后被快速代谢成I-6-G,在血浆中主要以I-6-G的形式暴露。异莨菪亭在野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠的生物利用度分别为7.85%、3.54%、5.76%、10.27%。与野生型FVB小鼠相比,Bcrp1-/-小鼠体内异莨菪亭的表观分布容积(Vd)和清除率(CL/F)分别下降了67.02%、58.54%(P<0.05);Mrp2-/-小鼠体内异莨菪亭的药-时曲线下面积(AUC0~t)和达峰浓度(Cmax)分别增加了2.8、3.0倍,CL/F下降了78.8%(P<0.05、0.001);Bcrp1-/-/Mrp2-/-小鼠体内异莨菪亭的AUC0~t增加了5.6倍,CL/F下降了86.8%(P<0.05、0.01)。与野生型FVB小鼠相比,Bcrp1-/-小鼠体内I-6-G的AUC0~t和半衰期(t1/2)分别增加了0.6、4.1倍(P<0.05);Mrp2-/-小鼠体内I-6-G的AUC0~t和Cmax分别增加了1.0、1.2倍(P<0.001);Bcrp1-/-/Mrp2-/-小鼠体内I-6-G的AUC0~t、Cmax和t1/2分别增加了8.2、3.5、1.6倍(P<0.01、0.001)。
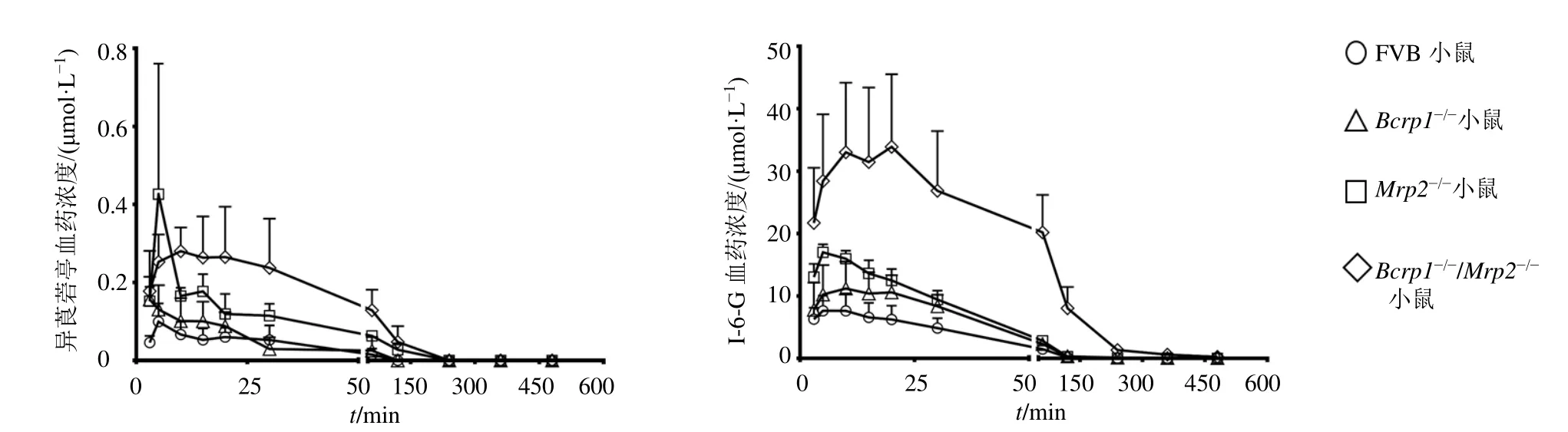
图5 小鼠ig异莨菪亭后,异莨菪亭及I-6-G的血药浓度-时间曲线 (±s , n=6)Fig.5 Plasma drug concentration-time curve of isoscopoletin and I-6-G in mice after ig isoscopoletin (±s , n=6)
表5 小鼠ig异莨菪亭后异莨菪亭及I-6-G的药动学参数 (±s , n=6)Table 5 Pharmacokinetic parameters of isoscopoletin and I-6-G in mice after ig isoscopoletin (±s , n=6)
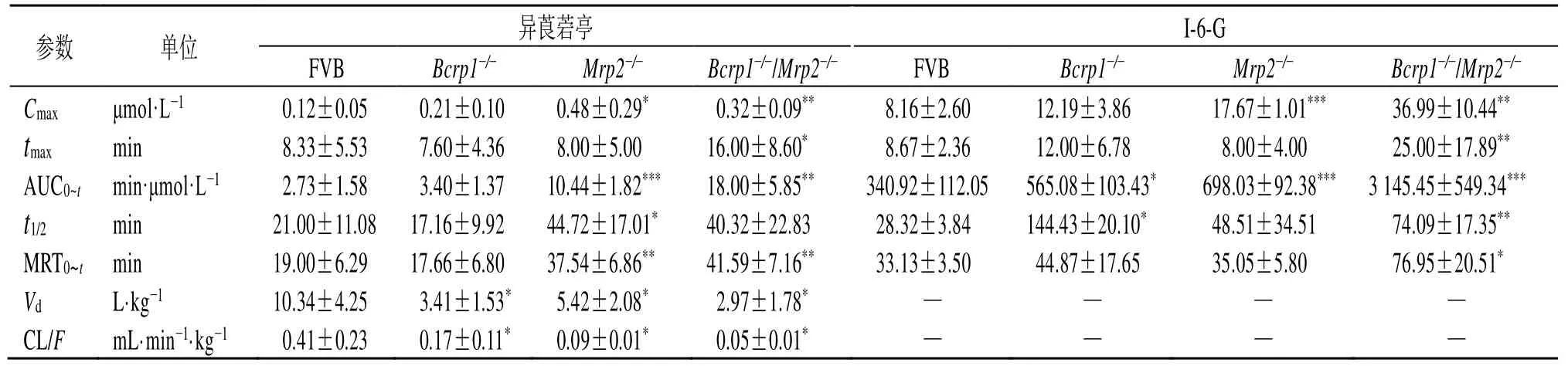
表5 小鼠ig异莨菪亭后异莨菪亭及I-6-G的药动学参数 (±s , n=6)Table 5 Pharmacokinetic parameters of isoscopoletin and I-6-G in mice after ig isoscopoletin (±s , n=6)
与FVB野生型小鼠比较:*P<0.05 **P<0.01 ***P<0.001*P < 0.05 **P < 0.01 ***P < 0.001 vs FVB mice
参数 单位 异莨菪亭 I-6-G FVB Bcrp1-/- Mrp2-/- Bcrp1-/-/Mrp2-/- FVB Bcrp1-/- Mrp2-/- Bcrp1-/-/Mrp2-/-Cmax μmol·L-1 0.12±0.05 0.21±0.10 0.48±0.29* 0.32±0.09** 8.16±2.60 12.19±3.86 17.67±1.01*** 36.99±10.44**tmax min 8.33±5.53 7.60±4.36 8.00±5.00 16.00±8.60* 8.67±2.36 12.00±6.78 8.00±4.00 25.00±17.89**AUC0~t min·μmol·L-1 2.73±1.58 3.40±1.37 10.44±1.82*** 18.00±5.85** 340.92±112.05 565.08±103.43* 698.03±92.38*** 3 145.45±549.34***t1/2 min 21.00±11.08 17.16±9.92 44.72±17.01* 40.32±22.83 28.32±3.84 144.43±20.10* 48.51±34.51 74.09±17.35**MRT0~t min 19.00±6.29 17.66±6.80 37.54±6.86** 41.59±7.16** 33.13±3.50 44.87±17.65 35.05±5.80 76.95±20.51*Vd L·kg-1 10.34±4.25 3.41±1.53* 5.42±2.08* 2.97±1.78* — — — —CL/F mL·min-1·kg-1 0.41±0.23 0.17±0.11* 0.09±0.01* 0.05±0.01* — — — —
尾iv异莨菪亭(1 mg/kg)后,异莨菪亭和I-6-G在野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠体内的药-时曲线见图6,药动学参数见表6。与野生型FVB小鼠相比,Bcrp1-/-小鼠体内异莨菪亭的Vd下降了75%(P<0.05);Mrp2-/-小鼠体内异莨菪亭的AUC0~t和CL/F分别增加了4.0、1.5倍(P<0.01、0.001);Bcrp1-/-/Mrp2-/-小鼠体内异莨菪亭的AUC0~t和CL/F分别增加了3.8、2.5倍(P<0.05、0.001)。与野生型FVB小鼠相比,Bcrp1-/-小鼠体内I-6-G的AUC0~t增加了2.1倍(P<0.01);Mrp2-/-小鼠体内I-6-G的t1/2增加了0.2倍(P<0.001);Bcrp1-/-/Mrp2-/-小鼠体内I-6-G的AUC0~t增加了9.1倍(P<0.01)。
表6 小鼠iv异莨菪亭后异莨菪亭及I-6-G的药动学参数 (±s , n=6)Table 6 Pharmacokinetic parameters of isoscopoletin and I-6-G in mice after iv isoscopoletin (±s , n=6)

表6 小鼠iv异莨菪亭后异莨菪亭及I-6-G的药动学参数 (±s , n=6)Table 6 Pharmacokinetic parameters of isoscopoletin and I-6-G in mice after iv isoscopoletin (±s , n=6)
与FVB野生型小鼠比较:*P<0.05 **P<0.01 ***P<0.001*P < 0.05 **P < 0.01 ***P < 0.001 vs FVB mice
参数 单位 异莨菪亭 I-6-G FVB Bcrp1-/- Mrp2-/- Bcrp1-/-/Mrp2-/- FVB Bcrp1-/- Mrp2-/- Bcrp1-/-/Mrp2-/-AUC0~t min·μmol·L-1 21.21±5.80 56.60±36.74 105.85±39.22** 103.06±74.10* 296.45±65.97 934.68±256.56** 326.83±59.37 3 006.22±944.97**t1/2 min 12.93±8.32 5.38±4.12 25.16±8.06* 12.76±5.01 25.27±0.87 32.28±5.41* 30.85±2.07*** 24.39±1.96 MRT0~t min 5.10±1.31 4.16±1.09 26.64±9.63* 12.74±5.52* 33.17±1.53 37.98±6.73 41.33±4.83** 49.30±10.36*Vd L·kg-1 0.44±0.25 0.11±0.11* 0.20±0.10 0.14±0.10* — — — —CL/F mL·min-1·kg-1 0.002±0.001 0.013±0.008 0.005±0.002*** 0.007±0.004*** — — — —
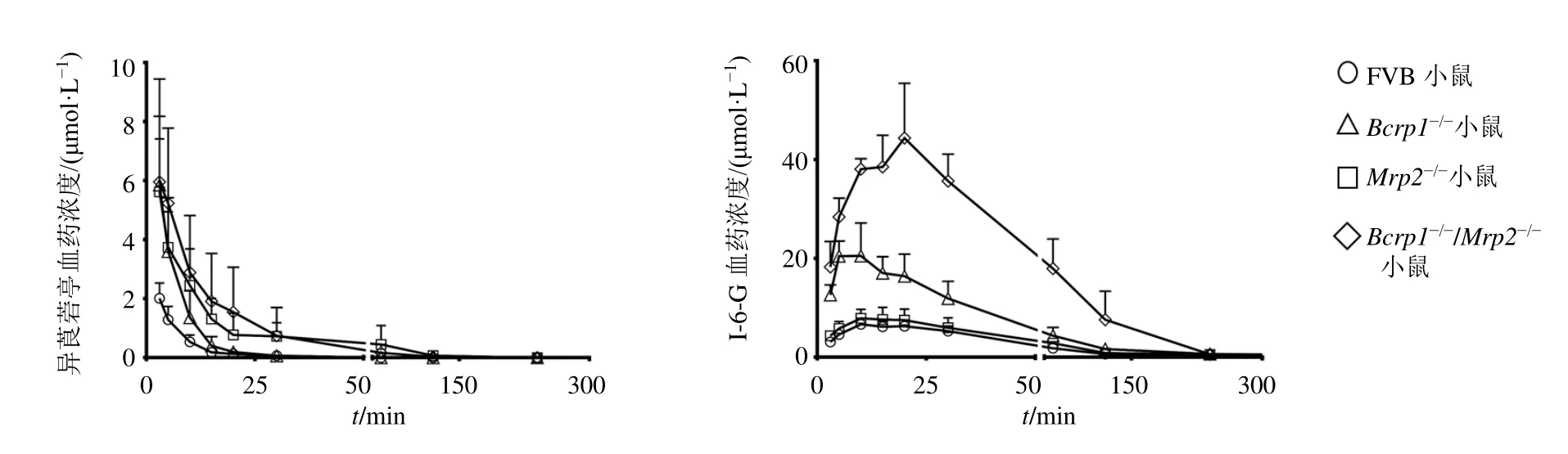
图6 小鼠iv异莨菪亭,异莨菪亭及I-6-G的血药浓度-时间曲线 (±s , n=6)Fig.6 Plasma drug concentration-time curve of isoscopoletin and I-6-G in mice after iv isoscopoletin (±s , n=6)
3.3 异莨菪亭在体肠灌流研究
异莨菪亭在小鼠十二指肠段和结肠段吸收和代谢特征如图7所示,异莨菪亭在野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠十二指肠段和结肠段的P*eff均高于1,表明异莨菪亭小鼠肠道内的吸收较好。异莨菪亭在十二指肠段的P*eff高于结肠段,表明异莨菪亭在十二指肠段的吸收优于结肠段。相比于野生型FVB小鼠,Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠体内I-6-G外排入十二指肠肠腔的量下降了55.7%~58.4%(P<0.05、0.01);Bcrp1-/-/Mrp2-/-小鼠胆汁中异莨菪亭和I-6-G的累积量分别降低了90.3%、79.1%,Mrp2-/-小鼠胆汁中I-6-G的累积量下降了90.1%(P<0.05);Bcrp1-/-小鼠血浆中异莨菪亭的暴露量增加了3.5倍;Bcrp1-/-/Mrp2-/-小鼠血浆中异莨菪亭和I-6-G的暴露量分别增加了1.3、0.7倍(P<0.05)。

图7 异莨菪亭在小鼠肠灌流模型的吸收与代谢的特征 (±s , n=5)Fig.7 Absorption and metabolism of isoscopoletin in mouse intestinal perfusion model (±s , n=5)
3.4 异莨菪亭在小鼠肝微粒体和小肠微粒体中的葡萄糖醛酸化代谢特征
异莨菪亭经野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠肝微粒体和小肠微粒体孵育后,代谢生成I-6-G。如图8所示,野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠肝微粒体介导的异莨菪亭葡萄糖醛酸化反应均符合米氏方程,由小肠微粒体介导的异莨菪亭葡萄糖醛酸化反应均符合底物抑制方程。如表7所示,相比于野生型FVB小鼠,Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠肝微粒体中I-6-G的清除率(CLint)均无统计学差异,小肠微粒体中I-6-G的CLint均增加了0.8倍(P<0.05),表明外排转运蛋白BCRP和MRP2的缺失对异莨菪亭在小鼠体内的葡萄糖醛酸化反应速率影响较小。
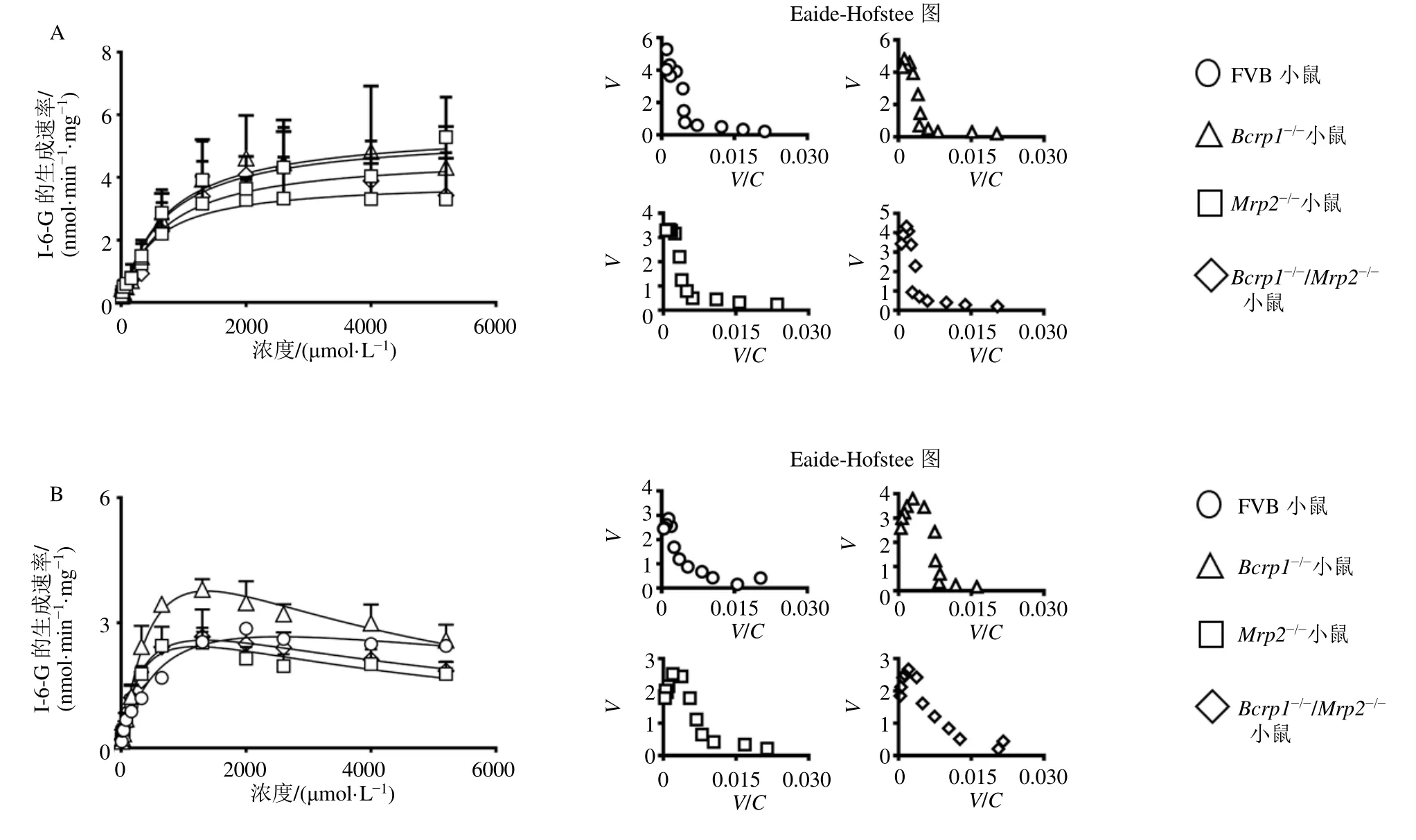
图8 异莨菪亭在小鼠肝微粒体 (A) 和小肠微粒体 (B) 中的酶动力学曲线 (±s , n=3)Fig.8 Enzyme kinetics of isoscopoletin in mouse liver microsomes (A) and intestinal microsomes (B) (±s , n=3)
表7 异莨菪亭在小鼠肝微粒体和小肠微粒体中的酶动力学参数 (±s , n=3)Table 7 Enzyme kinetics parameters of isoscopoletin in mouse liver microsomes and intestine microsomes (±s , n=3)
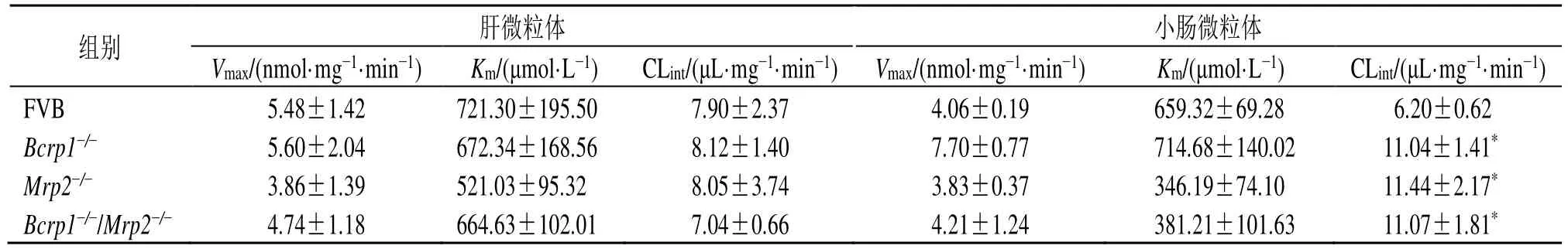
表7 异莨菪亭在小鼠肝微粒体和小肠微粒体中的酶动力学参数 (±s , n=3)Table 7 Enzyme kinetics parameters of isoscopoletin in mouse liver microsomes and intestine microsomes (±s , n=3)
与FVB野生型小鼠比较:*P<0.05*P < 0.05 vs FVB mice
组别 肝微粒体 小肠微粒体Vmax/(nmol·mg-1·min-1) Km/(μmol·L-1) CLint/(μL·mg-1·min-1) Vmax/(nmol·mg-1·min-1) Km/(μmol·L-1) CLint/(μL·mg-1·min-1)FVB 5.48±1.42 721.30±195.50 7.90±2.37 4.06±0.19 659.32±69.28 06.20±0.62 Bcrp1-/- 5.60±2.04 672.34±168.56 8.12±1.40 7.70±0.77 714.68±140.02 11.04±1.41*Mrp2-/- 3.86±1.39 521.03±95.32 8.05±3.74 3.83±0.37 346.19±74.10 11.44±2.17*Bcrp1-/-/Mrp2-/- 4.74±1.18 664.63±102.01 7.04±0.66 4.21±1.24 381.21±101.63 11.07±1.81*
4 讨论
异莨菪亭是中药秦皮的主要活性成分之一,具有多种药理活性,目前关于异莨菪亭在体内的处置特征及调控机制尚不清楚。本研究开展了小鼠药动学实验、在体肠灌流实验和酶动力学实验,发现异莨菪亭在小鼠血浆中主要以葡萄糖醛酸化代谢产物I-6-G的形式暴露,外排转运蛋白BCRP和MRP2对异莨菪亭及I-6-G的体内处置具有调控作用。
ig异莨菪亭后在体内吸收迅速,tmax且消除半衰期短,在野生型FVB小鼠、Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠血浆中I-6-G的AUC0~t显著高于异莨菪亭的AUC0~t,表明异莨菪亭可以以原型形式透过细胞膜,进而在体内发生广泛的葡萄糖醛酸化代谢。ig或尾iv异莨菪亭后,与野生型FVB小鼠相比,Mrp2-/-小鼠体内异莨菪亭的AUC0~t显著增加(P<0.01、0.001),而Bcrp1-/-小鼠体内异莨菪亭的AUC0~t无显著性差异,表明异莨菪亭的体内暴露主要由MRP2介导;Bcrp1-/-小鼠和Mrp2-/-小鼠体内I-6-G的AUC0~t与野生型FVB小鼠相比均显著增加(P<0.05、0.01、0.001),表明I-6-G的外排受BCRP和MRP2调控,且BCRP和MRP2对I-6-G的外排作用相当。在Bcrp1-/-/Mrp2-/-小鼠体内,异莨菪亭和I-6-G的AUC0~t与野生型FVB小鼠相比均显著增加(P<0.05、0.01、0.001),且增加倍数远大于单敲除小鼠与野生型FVB小鼠的差异。以上结果表明,BCRP和MRP2对异莨菪亭及其代谢物I-6-G药动学特征的影响呈协同互补的关系。外排转运蛋白BCRP和MRP2在肠和肝细胞的顶侧面均有表达,对底物的外排呈相互协调和合作互补的作用[14-16]。当BCRP和MRP2同时敲除后,他们之间的协同互补关系被打破,与Bcrp1-/-小鼠和Mrp2-/-小鼠相比,异莨菪亭和I-6-G受到的外排作用更小。
小鼠灌流异莨菪亭后,异莨菪亭在十二指肠段和结肠段的吸收程度较好(P*eff>1),且不受外排转运蛋白BCRP或MRP2的影响,表明被动转运可能是异莨菪亭通过细胞膜的主要形式。小鼠肠上皮细胞中I-6-G外排入十二指肠肠腔的量高于外排入结肠肠腔的量,可能是由于十二指肠上皮细胞和结肠上皮细胞中UGT酶和外排转运蛋白(BCRP和MRP2)表达程度的不同引起的[17-18]。与野生型FVB小鼠相比,敲除外排转运蛋白BCRP和MRP2后,I-6-G外排入十二指肠肠腔和胆汁的量均显著下降(P<0.05、0.01),表明外排转运蛋白BCRP和MRP2参与I-6-G的外排。异莨菪亭酶动力学结果显示,与野生型FVB小鼠相比,Bcrp1-/-小鼠、Mrp2-/-小鼠和Bcrp1-/-/Mrp2-/-小鼠肝微粒体中I-6-G的CLint无统计学差异,小肠微粒体中I-6-G的CLint均增加了0.8倍(P<0.05),表明外排转运蛋白BCRP和MRP2的缺失对异莨菪亭在小鼠体内的葡萄糖醛酸化反应速率影响较小。
利益冲突所有作者均声明不存在利益冲突
