融合魏斯氏菌对单增李斯特菌生物膜形成的影响
2021-07-21杜宏吕欣然崔晓玲高永悦白凤翎仪淑敏励建荣郭晓华谢晶
杜宏,吕欣然,崔晓玲,高永悦,白凤翎*,仪淑敏,励建荣,郭晓华,谢晶
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州121013;2.山东美佳集团有限公司,山东日照276800;3.上海海洋大学食品学院,上海201306)
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM),简称单增李斯特菌,是一种兼性厌氧型、无芽孢、革兰氏阳性短杆菌[1]。该菌能在低温环境中生长,是冷藏食品中常见的一种食源性致病菌[2],广泛存在于肉制品、水产品、果蔬制品和奶制品等产品中。在食品加工过程中,能够定植在生产设备和食品表面形成生物膜、不易被彻底灭活从而造成产品腐败或引起食源性疾病[3-4]。单增李斯特菌感染多数出现在新生婴儿、老人及孕妇等免疫缺陷人群,致死率高达20%~30%[5]。
生物膜(bioflim,BF)是指通过附着在有生命或无生命生物体表面的细胞外聚合物结合在一起的细胞,这种细胞需通过细胞间的相互作用而聚集,形成稳定的多细胞簇[6-7]。研究发现,超声波处理和外加电场等物理方法可有效避免细菌耐药性,但是不能完全消除或减少生物膜的黏附[8];用次氯酸钠、过氧乙酸等化学消毒剂可有效清除生物膜[9],但是清除效率与其浓度有很大关系,易造成化学残留等问题;添加肉桂醛、丁香酚等植物提取物可有效抑制单增李斯特菌生物膜的形成[10],但植物提取物存在原材料成本高、提取工艺复杂等问题。
乳酸菌(lactic acid bacteria,LAB)是利用外界环境中碳水化合物代谢产生乳酸的一类细菌的统称。LAB代谢产生有机酸、过氧化氢、细菌素等物质对腐败菌、致病菌及其生物膜的形成有一定的抑制作用[11]。KANG等[12]发现2株来源于儿童唾液的食寇魏斯氏菌(Weissella cibaria)CMS1和CMS3能够显著抑制变异链球菌生物膜的形成。刘文婷等[13]发现由植物乳杆菌(Lactobacillus plantarum)B23产生的细菌素Lac-B23对荧光假单胞菌具有明显的抑制作用,并且对生物膜的网络结构具有明显的破坏作用。本文从东北传统酸菜分离筛选出对单增李斯特菌具有拮抗作用的低温型乳酸菌,分析其对单增李斯特菌生物膜形成和形态结构的影响,为研发生物制剂控制食品中单增李斯特菌提出一条新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
单增李斯特菌(Listeria monocytogenes ATCC 9115):渤海大学食品科学与工程学院微生物学与分子生物学实验室保藏; 乳酸菌菌株 Z01、Z03、Z04、Z05、Z06、Z07、K03、K04、S01、S02、S03、S04:分离自锦州恒隆实业有限公司东北传统酸菜产品。
1.1.2 培养基及生化试剂
MRS琼脂培养基、LB琼脂培养基、MRS肉汤、LB肉汤:北京奥博星生物技术有限公司;乳酸菌生化鉴定管:杭州天和微生物试剂有限公司;细菌基因组DNA快速抽提试剂盒、DNA marker-D、Taq PCR Master mix:上海生工生物工程有限公司。
1.2 仪器与设备
DL-CJ-2N超净工作台:北京市东联哈尔仪器制造有限公司;GI54DS高压灭菌锅:致微仪器有限公司;SPX-250生化培养箱:宁波海曙赛福实验仪器厂;5804R高速冷冻离心机:德国艾本德公司;RE-2000A旋转蒸发器:上海亚荣生化仪器厂;DZF-6050型真空干燥箱:上海博讯实业有限公司医疗设备厂;BMM-408YS显微镜:上海浍统光学仪器有限公司;DYY-8C电泳仪:北京市六一仪器厂;Cheimdox XRS凝胶成像仪:美国Bio-Rad公司;IKA Vortex GENIUS 3振荡器:德国IKA公司;MS105UD电子分析天平:赛多利斯科学仪器(北京)有限公司;Czone 5F抑菌圈测量及菌落计数仪:杭州迅数科技有限公司;PE Victor X3酶标仪:美国珀金埃尔默公司。
1.3 方法
1.3.1 低温生长型乳酸菌的筛选
将从东北酸菜中分离的菌株以2.0%接种于MRS肉汤中,37℃培养12 h,重复3次。活化好的菌株接种于MRS肉汤中,10℃培养72 h,每隔24 h取样测定乳酸菌的OD595nm值。
1.3.2 拮抗性乳酸菌的筛选
将活化好的乳酸菌接种于MRS肉汤中,37℃培养 12 h后,8 000 r/min离心 10 min,上清液用 0.45 μm滤膜过滤除菌,获得乳酸菌无细胞上清液(cell free supernatants,CFS)。将单增李斯特菌以1.0%接种于LB肉汤中,37℃连续培养3代,菌悬液浓度调至106CFU/mL。参照文献[14]采用牛津杯打孔法对单增李斯特菌的抑菌活性进行测定。
1.3.3 单增李斯特菌细胞表面特性分析
1.3.3.1 表面疏水性
使用非极性溶剂十六烷测定细胞表面疏水性/亲水性。细菌细胞表面疏水性是决定细菌非特异性黏附到生物和非生物表面的最重要因素之一。将活化的单增李斯特菌菌悬液(50 mL)于4℃下7 000 r/min离心10 min,收集菌体沉淀,用0.85% NaCl洗涤两次重悬,测定OD595nm(A0)。取上述溶液3.0 mL加入0.5 mL十六烷,振荡 60 s,静置 15 min 后,测定其 OD595nm(A1),设置3个平行。黏附率计算公式如下。

1.3.3.2 自动聚集能力
将单增李斯特菌以1.0%接种于LB肉汤中,37℃培养24 h后,于10℃自然沉降24 h,对照组利用无菌接种棒搅拌30 s。取200 μL溶液于96孔板,分别测定OD595nm,细胞自动聚集率计算公式如下。

式中:B1为试验组OD595nm;B0为对照组OD595nm。
1.3.4 乳酸菌粗提物对单增李斯特菌生物膜的影响
1.3.4.1 乳酸菌粗提物的制备
取乳酸菌CFS(100 mL)置于分液漏斗中,分5次加入100 mL乙酸乙酯,混匀后静置5 min,待分层后收集有机相,将有机相于50℃下真空旋转蒸发有机溶剂,收集瓶中余液,真空冷冻干燥成粉末。
1.3.4.2 最小抑菌浓度(minimal inhibitory concentration,MIC)的测定
取单增李斯特菌培养液200 μL,接种到10 mL新鲜灭菌培养液中,加入不同浓度的乳酸菌粗提物100μL,使培养液中乳酸菌粗提物终浓度为2.0、4.0、8.0、16.0、32.0、64.0、128.0 mg/mL,同时设置空白对照。37℃振荡培养24 h后,确定抑制细菌生长的最小浓度。
1.3.4.3 乳酸菌粗提物对单增李斯特菌生长的影响
取单增李斯特菌培养液(50 μL)于5.0 mL灭菌LB培养液中,加入不同浓度的乳酸菌粗提物50 μL,使培养液中乳酸菌粗提物终浓度为0.5 MIC和1.0 MIC,以加菌液为对照组,37℃振荡培养24 h,每隔2 h测其OD595nm。
1.3.4.4 乳酸菌粗提物对单增李斯特菌生物膜黏附细菌的影响
参考林洋等[15]的方法,并稍作修改。将不锈钢切片(stainless steel,SS) 用无水乙醇浸泡30 min后无菌水冲洗,再用1.0 mol/L NaOH浸泡后无菌水冲洗,待干燥后,置于24孔板中。取10 μL过夜培养的单增李斯特菌菌悬液和1.0 mL灭菌LB肉汤加入含有切片的24孔板中,分别加入10 μL不同浓度的乳酸菌粗提物,使粗提物终浓度为0、0.5 MIC和1.0 MIC,37℃培养72 h。每隔12 h取出不锈钢切片置于10 mL无菌水的锥形瓶中(含有直径6 mm的玻璃珠)搅拌10 min,采用倾注法倒入LB培养基,37℃培养24 h,计算每平方厘米贴壁细胞数量。
1.3.4.5 乳酸菌粗提物对单增李斯特菌生物膜形成的影响
参照孙梦桐[16]的方法,在96孔板中每孔加入180 μL单增李斯特菌菌悬液和20 μL乳酸菌粗提物,对照用MRS肉汤。37℃培养24 h后,移出孔内培养液,用200 μL无菌水清洗3次~5次,再添加200 μL 0.4%结晶紫染色5 min,用无菌水清洗3次,置于60℃恒温干燥箱干燥10 min,每个孔中加入200 μL 95%乙醇,从孔中移出150 μL到另一96孔板内,用酶标仪测定OD595nm。

式中:ODc为单增李斯特菌菌悬液OD值;ODt为粗提物处理组的OD值。
1.3.4.6 乳酸菌粗提物对单增李斯特菌生物膜形态结构的影响
光镜观察:将无菌盖玻片(R=1.4 cm)置于24孔板中,孔内加入1 mL LB肉汤和10 μL单增李斯特菌悬液及100 μL不同浓度乳酸菌粗提物,37℃培养24 h后,用无菌水润洗盖玻片3次,0.4%结晶紫染色20 min,油镜下观察。
扫描电镜观察:前处理步骤同光镜观察(除染色外),而后4℃条件下用体积分数2.5%的戊二醛固定12 h。用无菌水洗去残留的戊二醛,再用40%、70%、90%、100%乙醇脱水处理各15 min,盖玻片真空干燥,喷金,扫描电镜观察。
1.3.5 乳酸菌的鉴定
1.3.5.1 生理生化反应
生理生化反应参照《常见细菌系统鉴定手册》[17]和《乳酸细菌分类鉴定及实验方法》[18]对乳酸菌菌株进行生理生化鉴定。
1.3.5.2 16S rDNA序列分析
16S rDNA序列分析参照文献[19],聚合酶链反应(polymerase chain reaction,PCR) 应用 25 μL 扩增反应体系:扩增引物为 27f:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-TACGGYTACCTTTGTTACGACTT-3′各1.0 μL,DNA 模板 1.0 μL,Taq PCR Master mix 12.5 μL,超纯水9.5 μL。 PCR扩增反应程序:94℃2 min,94℃ 1 min,60℃ 1 min,72℃ 90 s,循环 30次,4℃保温。PCR产物进行凝胶电泳并照相,将扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果与NCBI数据库进行BLAST同源性比对,MEGA5.0构建系统发育进化树。
1.3.6 数据处理与统计分析
每项试验重复3次,采用平均值±标准差处理数据。SPSS19.0进行数据分析和Origin 8.0绘图。
2 结果与讨论
2.1 低温生长型乳酸菌的筛选
温度是微生物生命活动中重要的环境因素,微生物必须通过基因调控和RNA的合成以适应环境温度[20]。图1为12株乳酸菌在10℃培养24 h后OD值变化结果。

图1 12株乳酸菌在不同时间下OD595nm测定结果Fig.1 Measurement OD595nmresults of 12 strains lactic acid bacteria at different times
结果表明,菌株Z01、K04的OD值显著性增加,表明菌株Z01和K04可以快速适应低温环境持续生长。菌株K03、S02、S03的OD值显著性降低,说明其在低温条件生长繁殖缓慢。其它菌株OD值未发生明显改变。48 h后12株乳酸菌OD值均显著性增加,表明低温条件下12株乳酸菌均可生长。培养72 h后OD值的增加量在0.06~0.23之间,其中菌株Z01增加量最大,该菌株能够更好地在低温条件下生长。
2.2 拮抗性乳酸菌的筛选
图2为乳酸菌对单增李斯特菌的抑菌结果。

图2 12株乳酸菌对单增李斯特菌抑制效果Fig.2 Inhibitory effect of 12 strains of lactic acid bacteria on Listeria monocytogenes
由图2可知12株乳酸菌对单增李斯特菌均有抑菌活性,抑菌圈直径在15.02 mm~19.79 mm之间,其中菌株Z01的抑菌圈直径为(19.79±1.21)mm,作用最强。综合低温性和抑菌活性,选择菌株Z01进行后续试验。
2.3 单增李斯特菌细胞表面特性
生物膜形成不仅取决于附着表面的性质,还取决于细菌细胞表面的特性。细胞表面疏水性和自动聚集能力可调节细胞间和细胞与表面的附着[21]。试验结果表明:单增李斯特菌对十六烷的黏附率和自动聚集率分别为(24.2±2.1)%和26.9%,说明该菌不具有显著的表面疏水性,具有较好的自动聚集能力,易在亲水性表面形成生物膜,因此选用亲水性不锈钢表面继续进行研究。
2.4 乳酸菌粗提物对生物膜形成的影响
2.4.1 对单增李斯特菌生长的影响
图3为菌株Z01不同浓度粗提物对单增李斯特菌生长的影响。

图3 不同菌株Z01粗提物浓度作用下单增李斯特菌生长曲线Fig.3 Growth curve of L.monocytogenes at different concentrations of strain Z01 crude extracts
由图3可以看出,乳酸菌粗提物对单增李斯特菌的MIC为16.0 mg/mL。对照组中单增李斯特菌生长呈正常趋势,在0~8 h内菌株快速增长,随着时间延长和营养物质的消耗,生长缓慢,进入稳定。当用浓度为0.5 MIC粗提物处理时,培养24 h后,单增李斯特菌的数量下降了29.24%。用浓度为1.0MIC粗提物处理时,单增李斯特菌被完全抑制。吕欣然等[22]研究发现,当用浓度为0.4MIC的植物乳杆菌DL3粗提物处理单增李斯特菌时,其可缩短目标菌的生长速率和生长周期,与本文研究结果相似。
2.4.2 对单增李斯特菌生物膜黏附作用的影响
生物膜的形成是一个动态过程,包括细菌起始黏附、生物膜发展和成熟扩散等阶段[23]。图4为乳酸菌粗提物影响单增李斯特菌生物膜黏附作用的生长曲线图。
细菌在生长繁殖的同时分泌大量胞外聚合物黏附细菌,对物体表面的黏附更为牢固,为生物膜形成初期。由图4可知,0~12 h不锈钢片上黏附的细菌菌落数呈对数增长,12 h~48 h黏附菌落数增长速度减慢。在此阶段,处理组中随着粗提物浓度增加,单增李斯特菌生长滞后,生物膜黏附细菌数量逐渐减少,显著抑制生物膜形成。在48 h~72 h细菌数量趋于稳定,生物膜形成基本处于成熟期。此时黏附细菌数随着粗提物浓度增加而显著减少,抑制生物膜的作用显著,表明生物膜的稳定性或覆盖率降低。该结果与杨维等[24]研究溴化呋喃酮对单增李斯特菌生物膜黏附作用的影响结果一致。

图4 菌株Z01粗提物作用下单增李斯特菌生物膜黏附细菌生长曲线Fig.4 Growth curve of adherent colonies in L.monocytogenes biofilm strain Z01 crude extracts
2.4.3 对单增李斯特菌生物膜抑制作用
2.4.3.1 96孔板法测定抑制率
菌株Z01粗提物浓度为0.5MIC、1.0MIC时,对单增李斯特菌生物膜抑制率分别为59.33%和77.77%,表明随着浓度升高,抑制作用增强。根据2.4.1中结果,当粗提物浓度升高时,对单增李斯特菌生长的抑制作用增强,所以可能是抑菌物质浓度提高,使得抑制生物膜作用随之增强。Camargo等[25]研究发现含有细菌素的乳酸菌无细胞上清液可以抑制单增李斯特菌生物膜的形成,而菌株Z01粗提物中何种物质抑制生物膜形成有待进一步确定。
2.4.3.2 光学显微镜及扫描电镜观察
菌株Z01粗提物对单增李斯特菌生物膜形态的作用结果如图5所示。
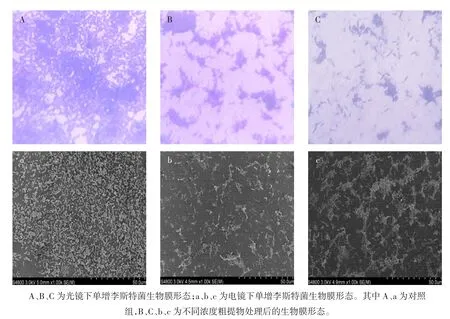
图5 菌株Z01粗提物对单增李斯特菌生物膜形态的影响Fig.5 Effect of crude extract of strain Z01 on the bio-film morphology of Listeria monocytogenes
结果表明,菌株Z01粗提物对单增李斯特菌生物膜形成具有显著抑制作用。对照组中菌体相互连接,形成成熟且致密的生物膜,而处理组随着粗提物浓度增加,生物膜生成量逐渐减少,菌体分散,生物膜稀疏,密度明显降低,表明其抑制生物膜形成具有剂量效应。 扫描电镜(scanning electron microscope,SEM)结果显示,对照组生物膜基质明显增加,并且大量的微菌落连接形成致密的生物膜结构。处理组中的生物膜由少量菌落构成,随着粗提物浓度的增加,单增李斯特菌生物膜形成量显著减少。当粗提物浓度为1.0MIC时,菌体分散未形成生物膜。结果表明菌株Z01粗提物可抑制单增李斯特菌的聚集、黏附以及生物膜的形成[26]。
2.5 乳酸菌的鉴定
2.5.1 生理生化反应
表1为菌株Z01的生理生化鉴定结果,初步判定菌株Z01为融合魏斯氏菌(Weissella confusa)。

表1 菌株Z01生理生化鉴定结果Table 1 Physiological and biochemical test results of strain Z01
2.5.2 16S rDNA序列分析
菌株Z01 16S rDNA基因扩增电泳图及系统发育树如图6所示。
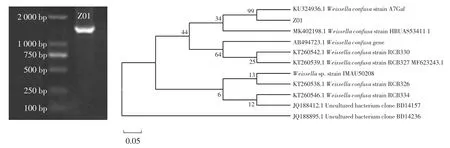
图6 菌株Z01的16S rDNA基因扩增电泳图及16S rDNA系统发育树Fig.6 PCR amplification of 16S rDNA gene and the phylogenetic tree for sequences of strain Z01
将PCR产物进行凝胶电泳分析,结果在1 500 bp左右出现特异性亮带,表明目标片段被成功扩增。16S rDNA系统发育树对比发现菌株Z01和融合魏斯氏菌(Weissella confusa)KU324936.1的 16S rDNA最为相似,支持率为99%。确证菌株Z01为融合魏斯氏菌。
3 结论
本文从东北传统酸菜中获得一株对单增李斯特菌具有较强拮抗作用的融合魏斯氏菌Z01,其粗提物对单增李斯特菌的MIC为16.0 mg/mL。当作用浓度为0.5 MIC粗提物处理单增李斯特菌时,单增李斯特菌的数量减少了29.24%。当粗提物浓度为0.5 MIC和1.0 MIC时,对生物膜的形成抑制率以及对生物膜黏附细菌的抑制率分别为 59.33%、77.77%和14.49%、26.44%。此外,光镜和扫描电镜观察研究发现粗提物对单增李斯特菌生物膜形成数量及生物膜形态具有显著的影响,该菌株可作为研发低温条件下控制单核细胞增生李斯特菌的生物制剂的出发菌株。
