鱼类重要免疫器官抗菌机制的研究进展
2021-07-21罗智文董志祥林连兵张棋麟
罗智文,董志祥,林连兵,张棋麟
( 昆明理工大学 生命科学与技术学院,云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500 )
鱼类是重要的水产养殖动物,因其分布范围广,涉及区域多,极易遭受外源压力的影响,故病原菌对鱼类的危害最大。鱼类病原菌多样,致病原因复杂,广泛存在于环境中并易于传播,严重地威胁鱼类养殖业的健康发展[1]。近年来,随着集约化养殖规模的扩大,病原菌感染导致鱼类大量死亡,限制了产业的发展[2-3]。因此,一些研究者聚焦于鱼类抗菌的免疫机制探索[4-6]。免疫系统的响应机制是鱼类抵抗寄生虫、细菌和病毒威胁的防线[7],其中,重要免疫器官的抗菌机制探讨是鱼类免疫学研究的核心。笔者总结了鱼类免疫系统的组成及作用机制,重点综述了鱼类免疫器官对病原菌的免疫响应机制,为今后鱼类抗菌机制的研究与应用提供重要的参考信息。
1 免疫器官是鱼类免疫系统的重要组成部分
根据免疫响应的特异性程度,免疫分为先天免疫和适应性免疫。免疫系统具有分层防御机制,增加特异性以对抗感染。简单来说,物理屏障可防止细菌和病毒等病原进入生物体[8],如果病原体突破了这些屏障,成功地躲避了先天免疫系统,脊椎动物的适应性免疫系统便发挥作用,保护机体免受侵害[9]。鱼类的先天免疫和适应性免疫系统彼此交联[10-11],不仅可识别和排除外来物质(不同污染源和各类病原菌)[12-13],还可在机体监视、自稳方面发挥重要作用[14]。免疫系统主要包括免疫组织及器官、免疫细胞和免疫因子3类[15]。免疫组织为免疫细胞分化、成熟、定居及产生免疫应答提供场所[15]。鱼类的免疫器官包括中枢免疫器官和外周免疫器官[16]。免疫细胞参与机体的免疫应答,主要分布在机体淋巴器官及血液中。免疫因子包括抗菌肽[17]、补体[18-19]、细胞因子[20]等,共同构成了机体免疫的基础。其中,鳃、肾脏、肝脏和脾脏是鱼类最主要的免疫器官,具有不可替代的作用[21-24]。
鳃与水直接接触进行物质交换,对外来生物素高度敏感,是许多毒物的靶器官[25],在机体对抗外源物入侵时发挥着重要的免疫作用[26]。此外,鳃还涉及呼吸、渗透压调节、酸碱平衡、含氮废物排泄、热交换和黏液生成等功能[27]。硬骨鱼类的肾脏分为头肾、中肾和后肾,是最重要的淋巴组织[28-29]。成年硬骨鱼的头肾主要有造血和内分泌两种功能,这主要得益于头肾内部丰富的血管网、造血组织、淋巴细胞丛以及噬黑色素细胞和淋巴细胞结构[30-31];后肾为排泄器官,也具有造血和免疫功能[28]。当头肾和中肾受到病原刺激时,组织内细胞便大量增殖以响应免疫[32]。脾脏是淋巴系统中最后一个发生器官,主要由红髓和白髓组成,为红细胞、中性血细胞及各种粒细胞产生、储存和成熟的场所,是名副其实的造血系统和免疫器官[33]。脾脏主要依赖淋巴小泡、巨噬细胞和噬黑色素细胞产生作用,当受抗原刺激后,脾脏内部免疫细胞将大量增殖并作用在整个器官上。
肝脏是鱼体内最大的腺体,由于具有消化、代谢、排泄、解毒及免疫等多种功能,肝脏也是动物体内最大的代谢器官[34]。鱼类代谢产生的有害废物、外来的有毒物质、药物的代谢和分解产物均由肝脏清除。肝脏还是机体内最大的网状内皮细胞吞噬系统,能吞噬、隔离、消除入侵和内生的各种病原体[24]。值得注意的是,几乎所有的凝血因子均由肝脏产生,所以肝脏在机体的凝血和抗凝血两个系统的动态平衡中起着重要的调节作用[35]。鱼皮肤作为身体的最外层器官[36],不但是外部和内部环境之间的一个保护屏障,还是免疫系统的第一道防线[37]。由于直接暴露在多种外部压力源下,鱼皮肤可以通过系统产生的防御信号[38],主要依靠分泌的黏液(其中含有大量的抗体、溶菌酶、抗菌肽及免疫球蛋白等免疫成分)和表皮细胞共同作用来保护机体[39]。
除上述免疫器官,肠道的免疫功能也不可忽视。肠道是一个重要的环境—生物界面,具有完整的免疫屏障结构,此外,鱼肠道中后部还分布着大量的淋巴细胞,是主要的抗原摄取和免疫应答部位[40]。
2 病原菌对鱼类免疫器官的影响
病原菌的危害是限制水产养殖业发展的主要因素之一。通常来说,鱼类感染病原菌的死亡率较高,并且由于病原菌种类繁多、致病原因复杂,对水产养殖业有所冲击。
弗氏柠檬酸杆菌(Citrobacterfreundii)是一种威胁鱼类生存的常见病原菌[41],鱼类感染后会出现再生障碍性贫血、蛋白质丢失、白细胞数量减少及肝脏变性、肾脏造血组织数量减少、皮肤出血、严重肠炎等不良反应,最终导致鱼类死亡[42-44]。无乳链球菌(Streptococcusagalactiae)是威胁尼罗罗非鱼(Oreochromisniloticus)健康的主要病原菌。该菌为革兰氏阳性菌,呈灰白色,表面光滑,有乳光,单菌落隆起呈圆形,感染无乳链球菌的斑马鱼(Daniorerio)表现为眼球突出,鳃和鳍充血,腹部肿胀,且伴有严重出血症状(图1)。无乳链球菌广泛存在于淡水、河口和海洋中,可引起不同鱼类的败血症和脑膜炎,严重限制了水产养殖业的发展[45-48]。此外,嗜水气单胞菌(Aeromonashydrophila)也是危害鱼类健康的病原菌。感染嗜水气单胞菌的鱼类出现肝脏坏死、肾小管降解、肠上皮区域扩大等病理变化,给水产养殖业带来了巨大的经济损失[49]。近年报道多、危害严重的鱼类病原菌见表1。
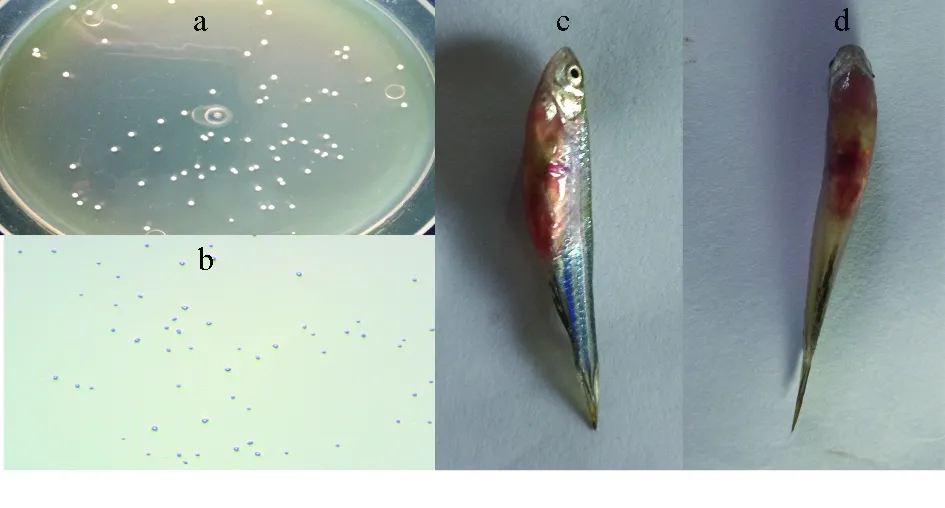
图1 无乳链球菌菌落形态、细胞显微形态和感病斑马鱼症状Fig.1 Colony morphology, cell morphology and symptoms of zebrafish infected by S. agalactiaea.无乳链球菌菌落形态; b.无乳链球菌显微形态; c、d.无乳链球菌感染致死的斑马鱼.a.colony morphology of S. agalactiae; b.micro-morphology of S. agalactiae;c and d.dead zebrafish caused by S. agalactia infection.
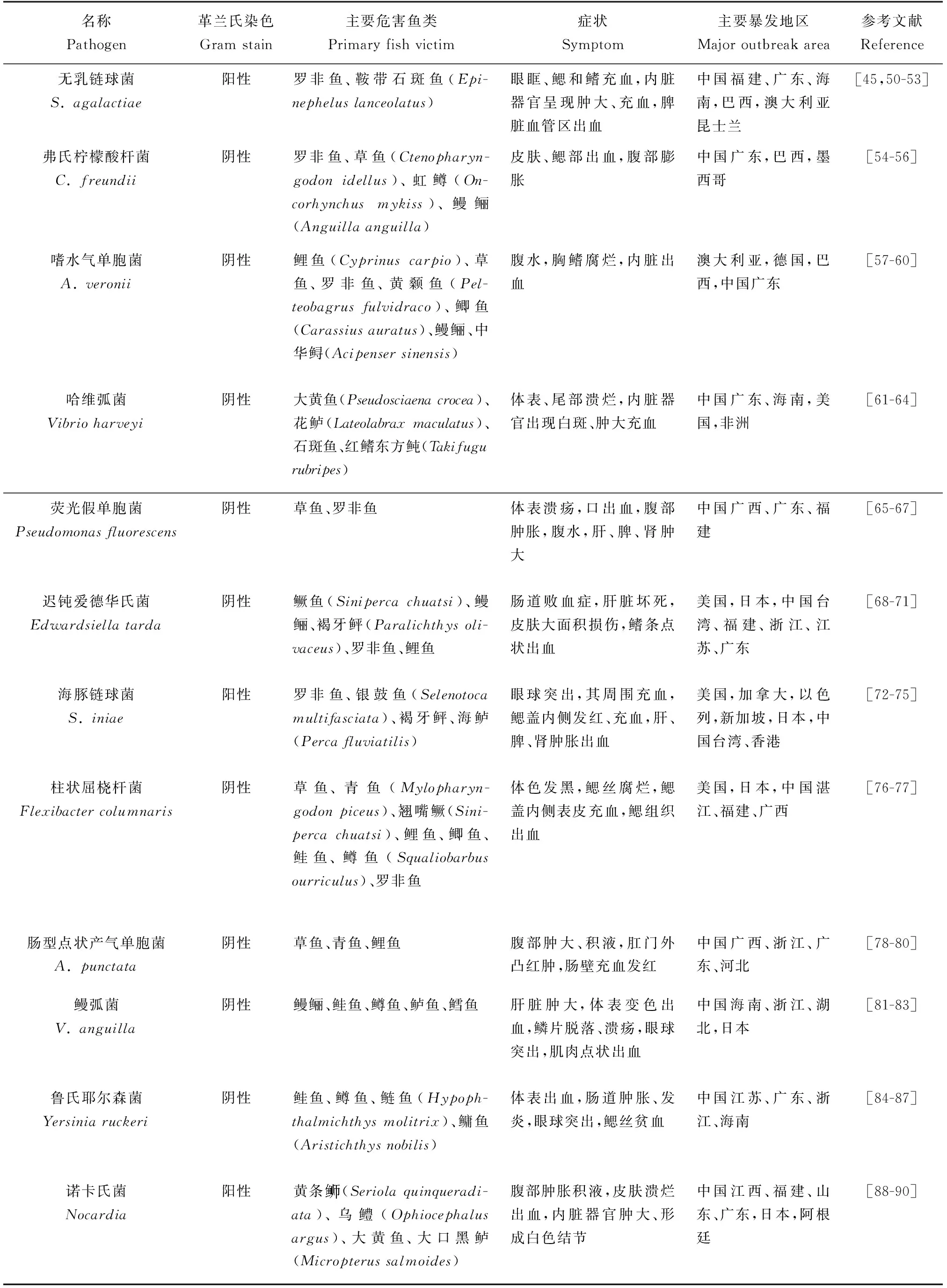
表1 病原菌及其对鱼类免疫器官的危害
3 鱼类重要免疫器官的抗菌机制
3.1 鳃
鳃作为鱼类与外部环境进行物质交流的媒介和重要的生物屏障[91],导致其极易受到各种环境和致病微生物的威胁。随着与鱼鳃相关的疾病越来越多[92],其重要的免疫作用也受到关注[93]。当鳃受到病原菌侵染时,往往表现出较明显的病征。例如,细菌感染引起的烂鳃病会导致鳃盖内表面充血,严重时还会出现糜烂、鳃丝肿胀、末端黏液分泌增多、鳃丝缺失而导致鳃丝软骨外露等症状。朱潜等[94]在患烂鳃病的鲫鱼中分离出维氏气单胞菌(A.veronii)和阴沟肠杆菌(Enterobactercloacae),这2种菌是烂鳃病的致病菌。金黄色葡萄球菌(Staphylococcusaureus)为革兰氏阳性菌,菌落厚、有光泽、圆形凸起,对鱼鳃威胁巨大。Zhang等[95]探索斑马鱼感染金黄色葡萄球菌后鳃的miRNA表达水平的改变,共鉴定出30个差异表达的miRNA,如miR-153a-3p、miR-133b-3p、miR-134-3p、miR-10a-5p和miR-93等。将这些DEMs进行功能富集分析后,发现其主要参与先天免疫过程、凋亡、防御反应和抗菌反应,不仅为斑马鱼鳃在金黄色葡萄球菌诱导的免疫应答过程中miRNA的调控机制提供了新的视角,还为硬骨鱼类对革兰氏阳性细菌感染的先天免疫应答提供了基础认识。Hu等[96]发现,鱼鳃在蛋白质组水平上参与了对嗜水气单胞菌感染的免疫应答,通过同位素标记相对和绝对定量分析技术,鉴定出82个相对丰度差异蛋白,其中有57个蛋白丰度在病原菌侵染后上升,如补体成分5、组蛋白H4、甘油醛3-磷酸脱氢酶等,25个蛋白丰度下降,进一步揭示了鳃蛋白质组对嗜水气单胞菌感染的响应机制。Liu等[97]对致病菌和宿主之间蛋白质的相互作用研究表明,石斑鱼感染迟钝爱德华氏菌后,从鳃内鉴定到8种相互作用的细菌蛋白(ETAE-2675、ompA、fliC、pnP等),以及12种相互作用的鱼类蛋白(dldH、nme2b、anxa4、canX等),为揭示鳃的抗菌机制提供了参考。
3.2 肾脏
肾脏是成鱼最重要的淋巴组织。作为中枢免疫器官,它能分化成红细胞、淋巴细胞及多种粒细胞,但不同的种类所分化的免疫细胞类型各异。在鱼类中,宿主感染病原菌后,肾脏通常会出现肾小管降解,肾窦腔扩大[98],肾小球的毛细血管扩张、充血和水肿[99]等一系列组织病理学反应。蒋自立等[100]研究发现,嗜水气单胞菌感染后,鱼类肾脏会发生间质比例增大,肾小球数量减少,管腔界限不清等现象。Kumar等[101]研究了虹鳟感染鲁氏耶尔森菌对淋巴器官的影响,发现虹鳟感染该菌后脾脏肿大变黑,可见多灶性坏死,肾小管变性,黑色素巨噬细胞明显增多;蛋白质组学分析发现,头肾中多种蛋白丰度改变,包括溶酶体、抗氧化剂、金属蛋白酶、四聚体蛋白、组织蛋白酶、B和C型凝集素受体蛋白等。鱼类乳球菌病是由格氏乳球菌(Lactococcusgarvieae)引起的出血性败血症。虹鳟感染该病菌后肾脏出现剧烈炎症反应,致使脾脏中炎症分子、巨噬细胞和中性粒细胞、头肾中NK细胞、细胞毒性细胞以及T细胞明显上调[102]。Byadgi等[103]对感染了格氏乳球菌的鲻鱼(Mugilcephalus)头肾转录组测序发现,头肾中有7192个差异表达基因,其中上调基因4211个,下调基因2981个,涉及的主要免疫相关途径包括补体和凝血级联、Toll样受体(Toll-like receptors)信号通路(图2)、抗原加工和表达等。鲤鱼感染嗜水气单胞菌后,肾脏免疫基因表达受到了影响,如HSP70基因的表达水平降低,IL-1β和TNF-α表达水平升高,表明病原菌感染显著影响鲤鱼的免疫原表达[104]。这些研究结果为了解鱼类肾脏抗菌机制提供了信息。
3.3 脾脏
鱼类脾脏是释放免疫因子和防御病原微生物的主要器官,也是淋巴结缺失时主要的继发性淋巴器官[106]。鱼类脾脏除产生含抗体的细胞及免疫球蛋白外,还参与B细胞的发育、抗原处理以及MHCⅡ类过程[107],这些都是产生有效适应性免疫反应的重要过程。C3作为补体系统的重要成分,在草鱼对抗嗜水气单胞菌感染中发挥重要作用。感染病原菌后,草鱼脾脏中C3补体基因的表达水平显著上调,说明较高的C3基因表达不仅可帮助草鱼更好地抵抗细菌入侵,还能积极修复损伤组织[108]。感染鲁氏耶尔森氏菌干扰了施氏鲟(A.schrenckii)脾脏内的免疫相关基因的表达水平。代谢通路分析表明,差异表达的基因主要涉及抗原处理与表达、补体与凝血级联、T细胞受体信号通路、B细胞受体信号通路、类节点受体信号通路和趋化因子信号通路等[87]功能。Long等[109]对虹鳟感染杀鲑气单胞菌(A.salmonicida)前后的脾脏进行比较转录组学和比较蛋白质组学分析,共筛选出17个差异表达基因和蛋白,包括CD209、IL-13Rα1、VDAC2、GIMAP7、PSMA1和ANXA11s等,表明免疫蛋白在鱼免疫反应过程中具有重要的保护功能。Jiang等[110]对感染嗜水气单胞菌前后的鲤鱼脾脏进行转录组测序及比较,发现了2900个差异表达基因,如IL1B、FRIH、MX2和IL8等显著上调,MX1、CO7、APJA和XCR1等显著下调,所获得的差异表达基因主要参与病原体识别、细胞表面受体信号转导和免疫防御等途径。Qin等[111]研究发现,感染嗜水气单胞菌的瓦氏黄颡鱼(Pelteobagrusvachellii)脾脏共有27 803个差异表达基因,其中13 934个上调,13 869个下调。这些差异表达基因主要涉及免疫信号通路,包括Toll样受体信号通路、B细胞受体信号通路和Fcγ受体介导吞噬作用的信号通路等。
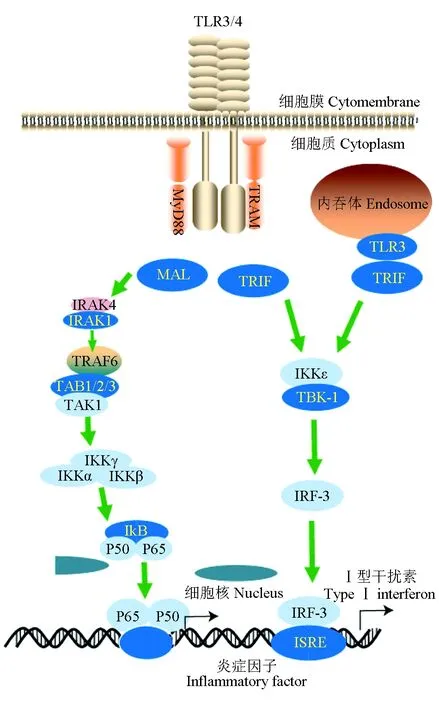
图2 TLR信号通路的负调控因子Fig.2 Negative regulators of TLR signaling pathwayTLR3信号通路为MyD88非依赖型,TLR4为Myd88依赖型信号通路的代表;→表示正调控;所有的调控因子均为TLRs信号通路中的相关蛋白(出自文献[105]).TLR3 signaling pathway is MyD88 independent type, and TLR4 is the representative of Myd88 dependent signaling pathway; → indicates positive regulation; all regulatory factors are related proteins in the TLRs signaling pathway (from reference [105]).
3.4 肝脏
脊椎动物肝脏不仅是新陈代谢的重要场所,因其还可产生细胞因子、趋化因子、补体成分和APR蛋白以应对病原菌的攻击[112],所以肝脏还是一个重要的免疫器官[37]。肝脏的免疫细胞包括巨噬细胞、中性粒细胞、B淋巴细胞、T淋巴细胞和NK细胞[113]。肝脏在免疫和新陈代谢中的双重作用使其成为宿主防御病原体攻击时调整代谢功能的重要候选者。刘问[114]发现,感染嗜水气单胞菌会导致青鱼肝脏出血,肝细胞边界不分明、细胞核固缩、肝板排列紊乱等现象。除了成年青鱼,该菌感染还会导致草鱼幼鱼肝脏结构变化,出现颜色变浅、肝细胞坏死、血管扩张充血等组织病理学现象。Causey等[115]从蛋白质组学角度探索了鱼类肝脏在细菌感染防御中的作用。结果显示,沙门氏菌(Salmonella)感染虹鳟后,肝脏中CD8和MX1基因的表达显著上调,在鉴定出来的2433种蛋白质中,有109种蛋白的丰度在病原菌入侵后显著变化,其中包括了补体系统和急性期反应蛋白的上调。草鱼感染嗜水气单胞菌患败血症,肝脏的生物学参数和免疫酶活性发生显著变化,如肝功能指数比富尔顿条件因子更敏感,肝脏中过氧化物酶、碱性磷酸酶和酸性磷酸酶活性显著升高[116]。Li等[117]在对感染鲁氏耶尔森菌的鲟鱼肝脏的转录组测序中共鉴定出1112个差异表达基因,其中63个同免疫相关,如TLR5、IL-8、NALP3、CCL19/21、C1QC、HSP70/90和MHCI等,为人们理解鲟鱼肝脏抗菌免疫机制提供了遗传学资源。
3.5 肠道
肠道是鱼类重要的免疫器官[40,118],其主要生理功能包括营养吸收、渗透压调节,减轻病原菌和环境压力对机体的影响[119-120]。鱼类肠道免疫功能与天然免疫成分[如溶菌酶、酸性磷酸酶、补体、抗菌肽和适应性免疫复合物(如免疫球蛋白)等]密切相关[121]。作为先天免疫系统的重要发生场所,肠细胞及其免疫因子,如促炎性细胞因子、肿瘤坏死因子α(TNF-α)、白细胞介素(IL-6)、抗炎性细胞因子、IL-10和转化生长因子β(TGF-β)等,能维护或保持肠道免疫稳态,抵抗病原菌入侵[122]。肠上皮之所以能够识别和对抗病原体,是因其细胞之间彼此连接,形成了对抗病原体和有毒物质的选择性物理屏障。此外,覆盖在肠细胞的黏液层也具有该功能。肠黏膜可激活免疫系统,使机体形成免疫屏障,从而有效清除外源物质及病原菌感染。肠上皮细胞模式识别受体(PRRs)通过病原相关分子模式识别病原体。近年来,对鱼类模式识别受体的研究大多集中在Toll样受体上,它对激活先天免疫系统至关重要[123]。Song等[124]比较分析草鱼感染嗜水气单胞菌前后的肠道转录组,发现315个基因在感染细菌后上调(如CCR4、IL8、RRM2等),234个基因下调(如ELA2、RASA1、SERCA等);进一步对差异表达基因的功能富集结果显示,这些基因主要参与了炎症反应、趋化因子和免疫细胞分化等功能。Li等[125]对感染爱德华氏菌(E.ictaluri)的斑点叉尾(Ictaluruspunctatus)后肠进行转录组分析,发现后肌动蛋白细胞骨架聚合、重塑和连接调节和炎症反应等相关基因发生了表达响应,显示了肠道在鱼类抗菌免疫中的重要角色。
3.6 皮肤
鱼类皮肤是抗菌免疫的第一道防线,在维持内环境稳态和防止细菌入侵方面起着重要的作用[126]。Wang等[127]对嗜水气单胞菌感染的鲫鱼皮肤进行了转录组分析,共鉴定出118 111个差异表达基因,对这些基因进行代谢通路富集后发现,其主要参与了TLR、MAPK、JAK-STAT等关键先天免疫代谢途径。Wu等[128]对斑马鱼的皮肤进行了无乳链球菌感染试验,发现PI3K-Akt、IL-17、MAPK、TNF、补体和凝血级联信号途径等重要免疫相关基因的快速表达响应。Caipang等[129]对大西洋鳕(Gudasmorhua)皮肤进行了转录组分析,发现皮肤中涉及抗菌、抗病毒和细胞因子的产生等相关免疫反应的基因均具有较高的表达量。Guardiola[130]等对欧洲舌齿鲈(Dicentrarchuslabrax)、金头鲷(Sparusaurata)、石鼓鱼(Umbrinacirrosa)和暗石斑鱼(E.marginatus)的皮肤黏液进行了分析,发现被检测的鱼皮肤黏液中均含有IgM抗体和溶菌酶、过氧化物酶、碱性磷酸酶、蛋白酶等与免疫相关的酶,其相互作用,共同抵御病原体的入侵。这些研究表明,鱼类皮肤在抵御病原菌感染方面发挥了重要的作用,一系列与病原菌免疫相关的基因是皮肤抗菌免疫的基础。
4 展 望
近年来,针对鱼类抗菌机制的研究也从单基因或少数基因的“假设基因”途径转向到基于基因组学、转录组学、蛋白质组学和代谢组学等多组学联合研究的“候选基因”途径,更为高效、全面及准确地对鱼类不同免疫器官的抗菌机制开展了研究。这些快速涌现的研究成果不但为相关研究人员打开了更为广阔的视野,也有助于更系统和深入地了解鱼类抗菌免疫防御过程。此外,鱼类抗菌免疫学的深入研究也可为保护鱼类免受或减轻来自病原菌的侵害提供新的思路和手段。如鱼类各个器官抗菌免疫学机制的成果为今后设计有效的疫苗和抗菌、抗病毒药物提供了理论依据和有效靶标。然而,当前鱼类重要器官免疫学抗菌机制研究还存在一些不足,如研究鱼类种类单一,对抗菌机制的起源和演化没有足够的认识,以及对重要免疫基因开展功能基因组学的研究较少。因此,建议未来重点开展以下3个方面的研究:(1)通过结合不同种类和分类单元下鱼类重要免疫器官的抗菌机制,比较分析获得鱼类种间甚至种内独特和共有的抗菌特征;(2)从细胞和基因层面,在软骨鱼类甚至更原始的无颌类动物[如七鳃鳗(Lampetrajaponicum)等]中追溯重要鱼类免疫细胞(如肥大细胞、淋巴样细胞和巨噬细胞等)、先天免疫和获得性免疫重要基因(白细胞分化抗原分子、趋化因子和抗原呈递蛋白编码基因等)的起源和演化规律,加深对鱼类抗菌机制的系统认识;(3)对大量研究中挖掘出的候选基因进行群体水平上和功能基因组学(如利用斑马鱼等模式鱼类开展目标基因的正反向遗传学研究)验证,进一步明确重要抗菌免疫基因的功能。
