1株拉萨裸裂尻鱼源致病性中间气单胞菌的分离鉴定
2021-07-21曾本和杨成年邱玉林王金林王万良朱成科
曾本和,杨成年,邱玉林,王金林,王万良,王 建,朱成科
( 1.西藏自治区农牧科学院 水产科学研究所,西藏 拉萨 850002; 2.西南大学 动物科学学院,淡水鱼类资源与生殖发育教育部重点实验室,水产科学重庆市市级重点实验室,重庆 402460 )
拉萨裸裂尻鱼(Schizopygopsisyounghusbandi)主要分布于雅鲁藏布江大拐弯以上的干支流及羊八井温泉出水小河中,为一种底栖刮食性鱼类,是西藏地区主要的经济鱼类之一[1]。其肉质细嫩,肉味鲜美,且富含脂肪,特别是体内富含n-3型多不饱和脂肪酸,在抗心血管疾病和调节血脂方面发挥重要作用[2]。近年来,由于受水利工程建设和人类活动加剧等因素影响,使得该鱼的野生资源量急剧减少[3-4],因此增强种质资源显得尤为重要。
目前,拉萨裸裂尻鱼的研究主要集中在生长规律[3]、食性[5]、胚胎发育[6]等方面,对拉萨裸裂尻鱼病害方面的报道甚少,目前仅有拉萨裸裂尻鱼体表出血病病原分离的研究报道[7]。2019年2月,在西藏自治区农牧科学院水产科学研究所养殖基地出现拉萨裸裂尻鱼患病死亡现象,临床症状主要表现为鳃盖、下颌、腹部及侧线有明显的出血点,腹鳍和臀鳍充血发红且肛门红肿,解剖发现体内有少许腹水。该病发病率高达20%~40%,死亡率达10%~20%,给该养殖基地带来较大的经济损失。
笔者首次从拉萨裸裂尻鱼肝脏内分离到1株病原菌,经人工回归感染试验确定为致病菌,经形态学观察和生理生化特性研究,基于16S rRNA、gyrB基因确定分类地位,综合鉴定该菌为中间气单胞菌(Aeromonasmedia),同时进行病原菌的耐药性试验,以期为该病的治疗提供科学依据。
1 材料与方法
1.1 试验材料
病鱼取自西藏自治区农牧科学院水产科学研究所养殖基地,体质量9.99~14.45 g,用于人工感染试验的150尾健康拉萨裸裂尻鱼取自拉萨市曲水县西藏土著鱼类增殖育种场,体质量12.25~15.65 g。
主要试剂和仪器:普通营养肉汤培养基(Oxoid公司)、药敏纸片(杭州微生物试剂有限公司)、细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)、革兰氏染色试剂盒(青岛海博生物)、API 20E试剂盒(法国Biomerieux公司)、琼脂糖(Takara公司);恒温摇床(美国Bio-Rad公司)、PCR 扩增仪(美国Bio-Rad公司)、电泳仪(美国Bio-Rad公司)等。
1.2 试验方法
1.2.1 病原菌的分离及形态学观察
在无菌条件下进行病原菌的分离。用75%酒精擦拭鱼体,再用无菌接种针蘸取肝脏、脾脏及腹水进行平板划线,28 ℃恒温培养箱中培养24 h;选取优势单菌落在相同条件下进行二次纯化培养24 h,观察菌落形态学特性,同时挑取单个菌落进行革兰氏染色,在油镜下观察细菌的显微结构。最后将纯化分离菌株于4 ℃保存待用。
1.2.2 人工感染试验
挑取单菌落接种于液体培养基,28 ℃培养7~8 h,3500 r/min离心10 min收集菌体,然后用无菌生理盐水依次调整至1.0×108、1.0×107、1.0×106、1.0×105cfu/mL不同密度的菌悬液。试验鱼胸鳍基部注射0.2 mL对应密度的菌悬液,对照组注射等量生理盐水,30尾/组。每日观察拉萨裸裂尻鱼发病症状,连续观察7 d。对感染死亡的拉萨裸裂尻鱼进行致病菌的分离鉴定试验。
1.2.3 生理生化鉴定
在超净工作台内,挑取纯化的单菌落于普通营养琼脂固体培养基表面,在恒温培养箱培养24 h后,根据API 20E试剂盒相关操作进行细菌的生理生化鉴定试验,结果参照《伯杰细菌鉴定手册》[8]的标准进行判定。
1.2.4 分子生物学鉴定
参照文献[9]方法提取分离株细菌的总DNA,于-20 ℃条件下储存备用。本试验中PCR反应体系设为50 μL,以细菌DNA为PCR反应模板,在0.2 mL Eppendorff管中依次加入以下试剂:10×PCR缓冲液(含MgCl2)5 μL,10 mmoL/L dNTPs 1 μL,16S rRNA正向引物(F:5′-AGAGTTTGA TCCTGGCTCAG-3′[10])、反向引物(R:5′-AAGGAGGTGATCCAGCCGCA-3′[10]),gyrB正向引物(F: 5′-TCCGGCGGTCTGCACGGCGT-3′[11])、反向引物(R: 5′-TTGTCCGGGTTGTACTCGTC-3′[11])各1 μL,模板DNA 2 μL,rTaq酶0.4 μL,ddH2O 39.6 μL。反应条件为:反应前94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸90 s,共32个循环;72 ℃终延伸10 min;4 ℃保存。PCR产物经1%的琼脂糖凝胶电泳检测合格后送华大基因进行序列测定。
1.2.5 药物敏感试验
运用K-B纸片扩散法进行药敏试验。将菌液制成1.0×108cfu/mL密度的悬液,用无菌棉球将菌液均匀涂布在固体营养琼脂表面,然后贴上不同的药敏纸片,28 ℃培养24 h,用游标卡尺测量抑菌圈的大小,结果参考British Society for Antimicrobial Chemotherapy(BSAC)标准[12]进行判定。
2 结果与分析
2.1 病鱼症状和病原菌的分离
患病拉萨裸裂尻鱼主要临床症状表现为鳃盖、下颌、腹部及侧线有明显的出血点,腹鳍和臀鳍充血发红且肛门红肿(图1),解剖鱼体发现体内有少许腹水。从病鱼肝脏分离到1株细菌LS-01。该菌在普通营养琼脂平板表面生长良好,在28 ℃培养24 h后形成光滑、隆起、有光泽,直径在1.0~1.6 mm的圆形菌落,在油镜下观察到两端钝圆的革兰氏阴性杆菌(图2)。

图1 患病鱼Fig.1 Sick S. younghusbandi
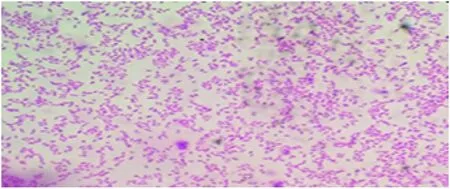
图2 菌落革兰氏染色结果Fig.2 Morphological characteristics of strain LS-01 stained by Gram
2.2 人工感染试验
试验组拉萨裸裂尻鱼在注射0.2 mL密度为1.0×108cfu/mL的菌悬液后,3 d内的死亡率达100%,对照组拉萨裸裂尻鱼未出现死亡(表1)。感染死亡的拉萨裸裂尻鱼临床症状表现为腹部有出血点,肛门红肿,解剖后腹腔内有少许红色腹水,这与自然环境下拉萨裸裂尻鱼的患病症状极为相似,同时在病鱼肝脏内再次分离到优势菌,综合细菌形态学、生理生化特性及分子生物学鉴定,结果与菌株LS-01特性一致,表明菌株LS-01是引起此次拉萨裸裂尻鱼患病的病原菌。根据改良寇氏法[13],计算分离株细菌LS-01的半数致死密度为3.98×106cfu/mL。
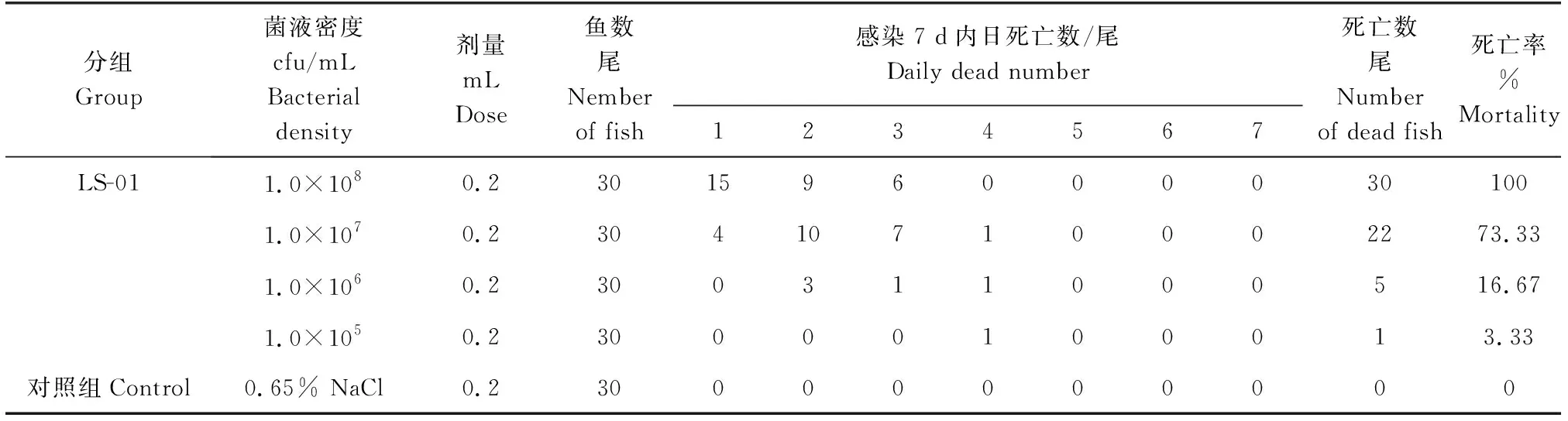
表1 人工感染试验
2.3 生理生化鉴定
菌株LS-01能利用阿拉伯糖、D-甘露糖、麦芽糖、半乳糖、海藻糖等,苯丙氨酸脱氨酶、精氨酸双水解酶、氧化酶阳性;鸟氨酸脱羧酶阴性(表2)。试验结果与《伯杰细菌鉴定手册》[8]比对分析,鉴定分离菌株LS-01为中间气单胞菌。

表2 生理生化鉴定结果
2.4 16S rRNA、gyrB基因扩增及系统发育分析
以菌株LS-01的DNA为模板,使用16S rRNA、gyrB通用引物进行PCR反应,产物经1%的琼脂糖凝胶电泳检测到2条大小约为1500 bp、1200 bp的DNA片段,与预期结果大小相符(图3)。经测序获得16S rRNA、gyrB基因片段大小依次为1497 bp和1210 bp。
菌株LS-01的16S rRNA序列与中间气单胞菌(GenBank登录号:KC210759.1)的相似性高于99%;菌株LS-01的gyrB序列与中间气单胞菌(GenBank登录号:AY987513.1)的相似性高于99%。根据比对结果选取GenBank中已登录的部分同属异种的其他序列,运用Clustal X软件及MEGA 3.0软件采用邻接法构建系统发育树。结果表明,菌株LS-01与中间气单胞菌聚为一支,进一步确定菌株LS-01为中间气单胞菌(图4,图5)。
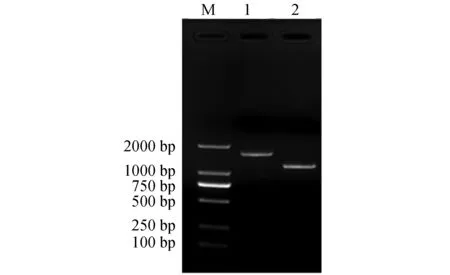
图3 菌株LS-01 16S rRNA、gyrB基因PCR产物扩增电泳Fig.3 The electropherogram of PCR amplified product based on 16S rRNA and gyrB gene in strain LS-01M.DL2000 DNA marker; 1.16S rRNA; 2.gyrB.
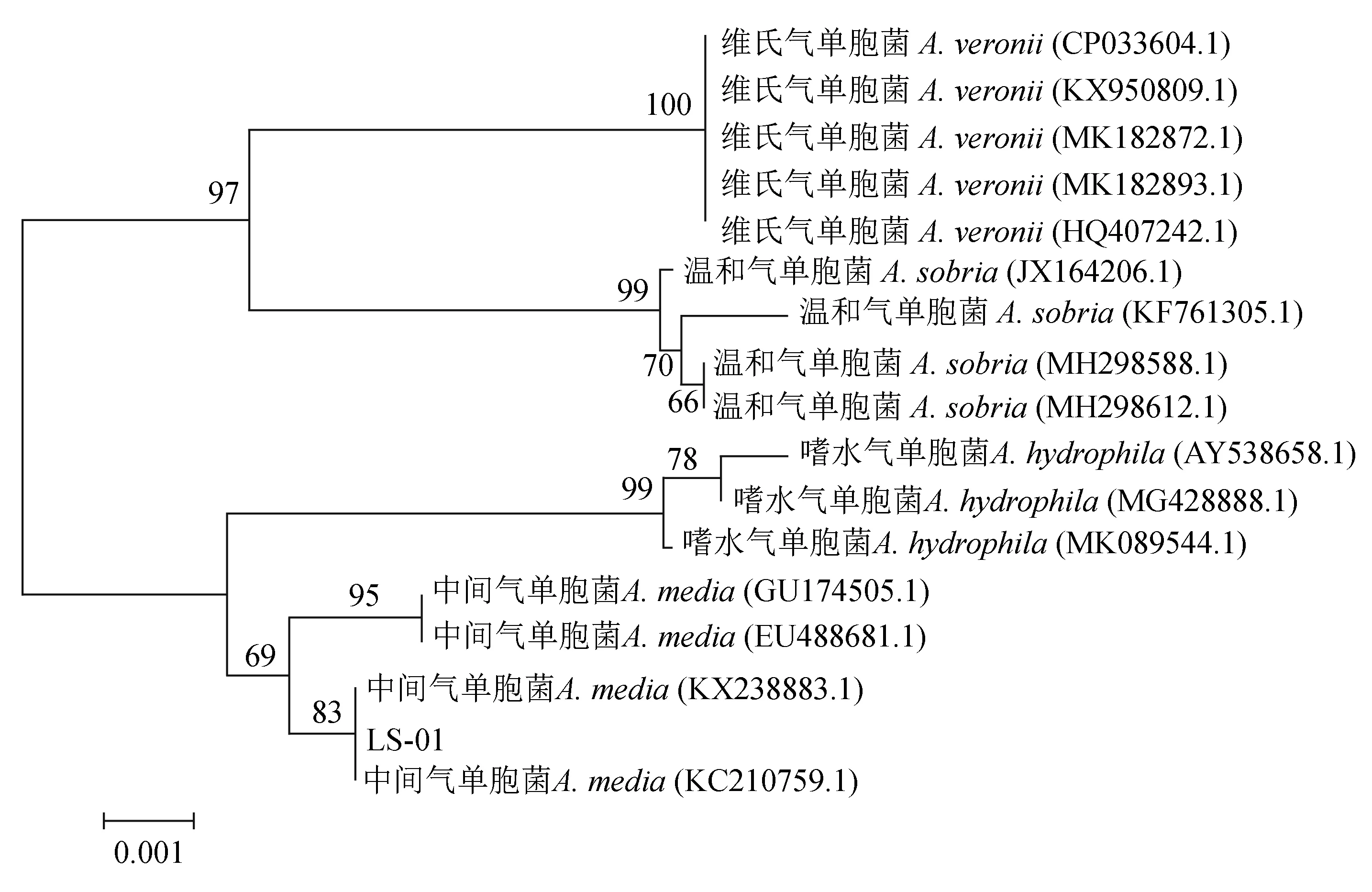
图4 16S rRNA基因构建的系统发育树Fig.4 Unrooted neighbour-joining phylogenetic tree based on the 16S rRNA gene
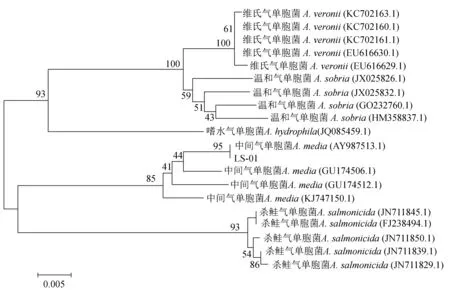
图5 gyrB基因构建的系统发育树Fig.5 Unrooted neighbour-joining phylogenetic tree based on the gyrB gene
2.5 药敏试验结果
中间气单胞菌LS-01对33种抗生素的敏感性见表3。结果显示,中间气单胞菌LS-01对头孢他啶、头孢哌酮等12种药物高度敏感,对新霉素、卡那霉素等2种药物敏感,对红霉素、麦迪霉素等19种药物耐药。

表3 药敏试验结果
3 讨 论
3.1 致病菌致病性及种类鉴定
自患病拉萨裸裂尻鱼肝脏内分离出的病原菌能够在培养基表面生长出浅黄色、半透明的圆形菌落,经革兰氏染色镜检观察为短杆状的革兰氏阴性菌。人工感染发病死亡的病鱼临床症状表现出与自然状况下相似的病症,同时从鱼体内再次分离出具有相同形态特征的病原菌,以上内容符合科赫法则判定细菌性疾病的条件,说明此次拉萨裸裂尻鱼死亡是由细菌性疾病引起。人工感染试验得到菌株LS-01的半致死密度为3.98×106cfu/mL,当给鱼体注射0.2 mL密度为1.0×108cfu/mL菌悬液时,3 d内试验鱼的死亡率达100%,表明该菌具有较强的致病性。
为确定病原菌的分类地位,运用常规的分子生物学鉴定方法。本试验选用进化速率慢,功能保守的16S rRNA基因进行鉴定[14],但该基因由于分子较小,包含的信息量少,对于同源关系接近的种间分辨率不够[15]。由于gyrB基因在细菌的复制和转录过程中均起到重要作用,常用于分辨亲缘关系较近的种间关系,故选用特异性更高的gyrB基因进行鉴定[15]。本试验通过提取分离株细菌的DNA,然后分别以16S rRNA、gyrB基因的通用引物进行PCR扩增,将扩增产物经电泳检测后测序,测序结果经Blast比对分析,结果与中间气单胞菌相似度高达99%,最终鉴定菌株LS-01为中间气单胞菌。
中间气单胞菌属气单胞菌目、气单胞菌科、气单胞菌属,为革兰氏阴性菌,广泛分布于土壤、水体中,是淡水养殖中一类常见的病原菌。现有研究报道,中间气单胞菌能够引起仿刺参(Apostichopusjaponicus)表皮溃烂病[16]、胭脂鱼(Myxocyprinusasiaticus)体表出血病[17]及斑点叉尾(Ictalunespunctatus)体表出血病[18]等。笔者首次从拉萨裸裂尻鱼肝脏内分离到中间气单胞菌,对该菌的形态学、生理生化特性及致病性方面进行了研究,但对于该细菌的致病机理还需进一步研究。
3.2 致病菌对常见抗生素的敏感性
药敏试验结果显示,从拉萨裸裂尻鱼体内分离出的中间气单胞菌对头孢他啶、头孢哌酮、氨曲南等12种药物高度敏感,该结果与王高学等[16-18]的研究结果存在一定的差异,这可能是由于抗生素的使用量不同、菌株来源差异和地理环境不同等所致[19]。在对该疾病的治疗过程中,根据农业农村部公告第193号《食品动物禁用的兽药及其化合物清单》和NY 5071—2002《无公害食品渔用药物使用准则》相关内容并结合本试验药敏试验结果,建议选择氟苯尼考等高度敏感的抗菌药物针对性地开展治疗。同时,在实际生产中要科学地使用敏感性抗菌药物进行治疗,同时积极改善养殖水体环境,增强鱼体抵抗力。
4 结 论
致病菌株LS-01为革兰氏阴性菌,经鉴定为中间气单胞菌,对拉萨裸裂尻鱼幼鱼半数致死剂量为3.98×106cfu/mL,对头孢他啶、头孢哌酮、左氧氟沙星、氟苯尼考等12种药物高度敏感。
