甘蔗丙二烯氧化物环化酶基因(ScAOC)的克隆与表达分析
2021-07-20薛耀威陈丽兰王亚如高三基王锦达
薛耀威 陈丽兰 王亚如 高三基 王锦达
摘 要:丙二烯氧化物环化酶(allene oxide cyclase,AOC)是茉莉酸合成途径的一个关键酶,在植物防御反应中起着重要的作用。本研究基于甘蔗转录组数据库克隆到一个AOC基因,命名为ScAOC,并对其进行生物学分析、组织特异性分析和逆境胁迫下的表达分析,以初步了解该基因的功能。甘蔗ScAOC基因的开放阅读框(ORF)为744 bp,编码244个氨基酸,其蛋白分子质量是26.37 kDa。生物信息学分析结果显示,ScAOC蛋白属于不稳定碱性亲水蛋白,含有1个Allene_ox_cyc Superfamily的PLN02343 domain的保守结构域;构建系统进化树,结果显示ScAOC蛋白与高粱的蛋白具有较高的同源性。荧光定量PCR结果显示,ScAOC基因在甘蔗的根、茎、叶中均有表达,表达量从高到低依次是叶、根、茎。在PEG、NaCl及外源MeJA胁迫下,ScAOC基因相对表达量都是先上升后下降,而ABA对ScAOC的表达有一定的抑制作用。在病原菌和粘虫取食的胁迫下,ScAOC基因相对表达量显著上升。结果显示ScAOC可能参与甘蔗对生物或非生物胁迫的防御反应。
关键词:甘蔗;丙二烯氧化物环化酶;茉莉酸;生物信息学分析
中图分类号:S566.1 文献标识码:A
Abstract: Allene oxide cyclase (AOC) is a key enzyme in the synthesis pathway of jasmonic acid and plays an important role in plant defense reactions. In this study, an AOC gene was cloned based on the sugarcane transcriptome database and named ScAOC. Biological analysis, tissue-specific analysis, and expression analysis under stress were conducted to understand the preliminary function of the gene. The open reading frame (ORF) of the ScAOC gene in sugarcane was 744 bp, encoding 244 amino acids, and its protein molecular mass was 26.37 kDa. Bioinformatics analysis showed that the ScAOC protein was an unstable basic hydrophilic protein and contained a conserved domain of the PLN02343 domain of Allene_ox_cyc Superfamily. Constructing a phylogenetic tree showed that the ScAOC protein has a high homology with sorghum protein. Fluorescence quantitative PCR showed that the ScAOC gene was expressed in the roots, stems and leaves of sugarcane, and the expression levels from high to low were leaves, roots and stems. Under the stress of PEG, NaCl and exogenous MeJA, the relative expression of ScAOC gene increased first and then decreased, and ABA had a certain inhibitory effect on the expression of ScAOC. Under the stress of pathogenic bacteria and armyworm feeding, the relative expression of ScAOC gene increased significantly. The results showed that ScAOC maight be involved in the defense response of sugarcane to biological or abiotic stress.
Keywords: sugarcane; allene oxide cyclase; jasmonic acid; bioinformatics analysis
DOI: 10.3969/j.issn.1000-2561.2021.05.007
甘蔗是我國最主要的糖料作物,甘蔗产糖占我国食糖总量的90%左右[1],此外甘蔗也是重要潜在的能源作物,因此甘蔗的优质高效生产是事关国计民生的大事。甘蔗属于多年生作物,生产周期较长,且长期连作,经常受到各种不良环境的威胁,导致甘蔗产量降低,蔗汁品质下降。而目前田间管理上多通过喷施化学肥料和农药的方法,提高甘蔗抵御外界各种胁迫。地球资源短缺,环境恶化,环境保护和食品安全的重要性日益突显,未来农业生产势必向无毒、绿色环保的方向发展。选育和利用抗逆品种,是目前公认提高农作物抗逆性最根本、经济有效且对环境影响最小的办法。利用品种对外界环境的不敏感性,提升农作物对各种生物胁迫的忍受能力,并降低各种有害生物的生存适合度,不但有利于农作物抵抗外界不良胁迫,也有利于减少环境污染,维持生态系统的平衡。
茉莉酸类化合物(Jasmonates,JAs)是一类基本的植物激素,作为植物体内的一种内源性调节物质,在植物的生长过程中有十分重要的作用。一方面JAs可通过调节植物的生长发育过程,如种子萌发[2]、器官发育[3]和衰老死亡[4]等;另一方面JAs还可参与植物的生物胁迫和非生物胁迫[5],如逆境胁迫[6]、病原菌侵扰[7]等过程。在植物体内JAs通过亚麻酸或亚油酸为底物经过各种酶促反应合成[8]。其中丙二烯氧化物环化酶(allene oxide cyclase,AOC)基因是茉莉酸生物合成途径中的一个关键酶基因,能够通过特异性地催化丙二烯氧化物[12,13(s)-epoxy-(9Z,11E,15Z)-octade-catrienoic acid, 12,13-EOT]形成茉莉酸产物的前体1,2-氧-植物二烯酸[12-oxo-phytodienoic acid,OPDA][9],其活性在中间产物转化为茉莉酸的过程中起重要作用[10]。已有研究显示,AOC可通过提高表达促进JAs的形成,提高植物抵抗外界不良环境胁迫的能力。因此分离AOC基因并分析其表达规律对于研究该基因在植物生长发育和抵御外界胁迫的过程中的作用具有重要的意义。自2000年首个AOC基因在番茄中克隆报道以来[11],该基因已经在玉米[12]、拟南芥[13]等多种植物中克隆得到,并对其进行了相关功能研究。而目前尚未有甘蔗中AOC基因的研究报道,因此对甘蔗AOC基因进行全长克隆分析,并研究在外界生物胁迫和非生物胁迫下AOC基因的表达规律,为揭示AOC基因在甘蔗茉莉酸生物合成过程中的作用以及分析甘蔗的生长发育和防御反应的分子机理提供科学依据。
1 材料与方法
1.1 材料
1.1.1 材料及处理 本实验采用由福建农林大学国家甘蔗工程技术研究中心提供的新台糖22号(ROC22)甘蔗品种。采集新鲜的根茎叶,提取总RNA,检测ScAOC基因在不同部位以及逆境胁迫下的表达差异。从蔗田挑选涨势健壮一致的甘蔗种茎切断,然后进行30 min温水(52 ℃,含1 g/L多菌灵)脱毒处理,然后放入培养箱(30 ℃,光照16 h,湿度65%)中催芽,分别经4种外源激素处理:0.1 mmol/L的ABA处理0、12、24 h (CK、ABA-12 h、ABA-24 h);25% PEG6000干旱处理0、6、12 h(CK、PEG-6 h、PEG-12 h);250 mmol/L的高盐(NaCl)胁迫处理0、12、24 h(CK、NaCl-12 h、NaCl-24 h);100 ?mol/L的茉莉酸甲酯(MeJA)处理0、12、24 h(CK、MeJA- 12 h、MeJA-24 h)。2种生物胁迫:赤条菌(Acidovorax avenae subsp. avenae,Aaa)处理0、24、48 h(CK、Aaa-24 h、Aaa-48 h);粘虫取食(Insect)处理0、12、24 h(CK、Insect-12 h、Insect-24 h)。然后提取RNA检测ScAOC基因在不同胁迫下的表达差异性。
1.1.2 试剂 实验所用主要试剂:PrimeScript? RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TaKaRa,中国,大连)、TRIzol Reagent(Invitrogen,美国,卡尔斯巴德)、Gel Extraction Kit(天根生化科技有限公司,中国,北京),基因克隆载体pEASY-Blunt Zero Cloning Kit载体(全式金,中国,北京)、基因克隆试剂Prime-STAR? GXL Premix Kit(TaKaRa,中国,大连)等。
1.2 方法
1.2.1 RNA提取 按照TRIzol Reagent RNA提取试剂盒的操作步骤对各处理材料进行RNA的提取,利用1%的琼脂糖凝胶电泳检测RNA的完整性,保存于–80 ℃超低温冰箱。将RNA反转录合成cDNA,参照PrimeScript? RT reagent Kit with gDNA Eraser反转录试剂盒的说明书进行,并保存于–80 ℃超低温冰箱。
1.2.2 ScAOC基因的引物设计与克隆 根据本实验室测序得到的转录组数据库(未发表)筛选到甘蔗ScAOC的unigene序列,通过在线软件Primer 5.0进行基因特异性克隆引物的设计(表1)。将cDNA作为目的基因的克隆模板进行PCR反应,将得到的目的片段经回收、连接和克隆后经过挑单菌落菌液PCR检测,最后送福州博尚测序公司进行测序。
1.2.3 ScAOC的生物信息学分析 利用NCBI的ORF Finder在线程序分析测序获得的目的基因核酸序列的开放阅读框(open reading frame, ORF);利用NCBI的Conserved domains database (CDD)数据库对基因蛋白进行结构域预测;利用在线软件Protparam、GOR IV、SWISS MODEL对基因蛋白进行一级结构、二级结构、三级结构预测;利用DNAMAN软件对7個物种的AOC基因进行多序列比对,通过NPS的proscan(https://npsa- pra-bi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_proscan.html)对ScAOC进行活性位点预测;利用MEGA对基因蛋白进行进化树分析。
1.2.4 ScAOC基因在不同组织和不同胁迫下的表达分析 采用SYBR Green染料法,分析ScAOC在根、茎、叶中的表达特异性及在不同胁迫下的表达差异。以磷酸甘油醛脱氢酶(reduced glyceral-dehyde-phosphate dchydrogenase,GAPDH)为内参基因[14-15]。每个样品以无菌水为对照,设置3次重复。基因相对表达量计算采用2-ΔΔCT算法,基因的相对表达量为扣除0 h对照组的基因相对表达水平。
2 结果与分析
2.1 ScAOC基因的鉴定及序列分析
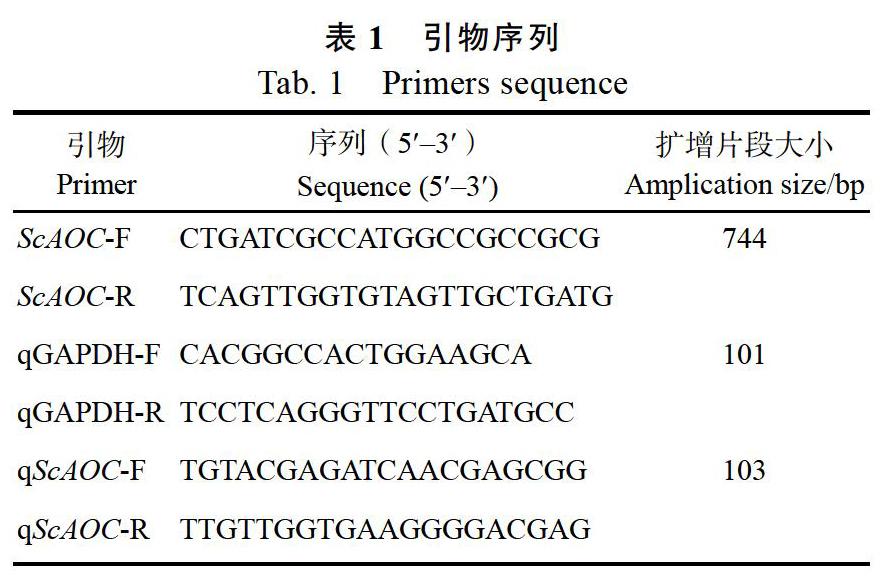
本研究克隆了ScAOC基因的全长,该序列包括744 bp的开放阅读框(图1),编码244个氨基酸,GenBank号为:MK784561。通过对ScAOC进行一级结构预测,结果显示该基因编码蛋白的理论相对分子量为26.37 kDa,理论等电点为9.45,不稳定系数为45.06,平均疏水性为–0.250,脂肪系数(AI)为80.45(表2)。推测ScAOC属于不稳定碱性亲水蛋白。
ScAOC基因二级结构预测结果表明(表3),该二级结构主要为无规则卷曲,占比为54.10%;其次为23.77%的α-螺旋和22.13%的延伸链,不含β-螺旋结构。
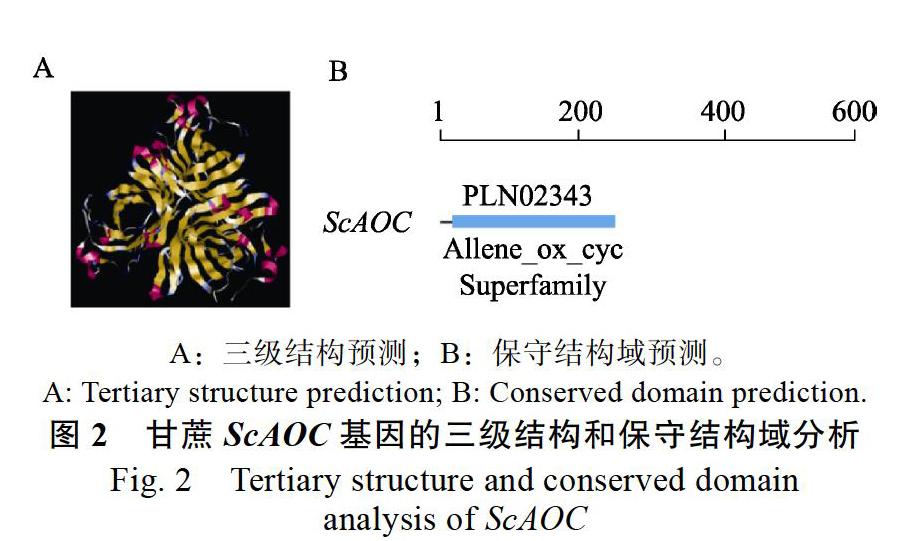
SWISS MODEL的三级结构预测结果显示(图2A),ScAOC基因三级结构元件主要是无规则卷曲。且ScAOC主要含有一个Allene_ox_cyc Superfamily的PLN02343 domain的保守结构域(图2B)。
2.2 ScAOC蛋白序列分析及系统进化树构建
使用DNAMAN软件对7个物种的AOC蛋白序列进行多序列比对发现(图3),这些AOC蛋白中包含8个高度保守的β延伸鏈结构。进一步通过NPS(Network Protein Sequence Analysis)对ScAOC进行活性位点预测,结果表明ScAOC蛋白有6个活性位点,为N-糖基化位点、蛋白酶C磷酸化位点、酪蛋白激酶Ⅱ磷酸化位点、N-十四酰化位点、酪氨酸激酶磷酸化位点、酰胺化位点。
将ScAOC与其他22种植物的AOC基因的氨基酸序列构建系统进化树,结果显示单子叶植物的AOC蛋白相对双子叶植物独立于一簇,且甘蔗ScAOC蛋白与高粱在同一个小分支上,亲缘关系最近(图4)。
2.3 ScAOC基因在甘蔗不同组织部位的表达分析
通过荧光定量PCR分析,结果发现ScAOC基因在甘蔗的根、茎、叶中均有表达。表达量从高到低依次是叶、根、茎,其中ScAOC在叶中的表达量是茎的1.31倍,且表达差异不显著(图5)。
2.4 ScAOC基因在不同胁迫下的表达分析
2.4.1 非生物胁迫下ScAOC的相对表达量 从图6可知,在4种非生物胁迫处理下,ABA处理后ScAOC出现先下降后上升变化,而其他3种处理则出现相反趋势。其中在ABA处理下ScAOC的表达量变化幅度不大,甚至在12 h时下降到对照组的0.82倍,24 h时表达量上升到对照组的
1.47倍;而在25%的PEG6000干旱处理下其表达水平迅速上调,在6、12 h时分别达到了对照组的6.17、4.64倍;在NaCl胁迫下,在12、24 h时分别达到了对照组的3.96、2.63倍;在100 ?mol/L的MeJA处理下,组织相对表达量在12、24 h时分别达到了对照组的1.93、1.84倍,且差异显著。
2.4.2 生物胁迫下ScAOC的相对表达量 通过接种病原菌和粘虫取食2种生物胁迫,ScAOC的表达量呈现相同上升趋势。其中病原菌胁迫处理24、48 h时ScAOC的表达量分别达到了对照组的2.09、2.34倍;粘虫取食12、24 h时ScAOC的表达量分别达到了对照组的2.5、4.0倍(图7)。
3 讨论
茉莉酸广泛存在于植物的幼嫩组织和发育的生殖器官中[16],是一种通过韧皮部筛管长距离运输的信号物质[17],在植物体内充当信号转导分子,调节植物的生长发育和应激反应[18]。本实验以甘蔗品种为新台糖22号(ROC22)为模板,克隆并得到了甘蔗AOC基因,该基因全长744 bp,编码244个氨基酸。根据生物信息学分析发现ScAOC基因含有1个保守的allene-ox-cyc结构,聚类分析表明该蛋白与玉米、高粱等植物的AOC具有较高的氨基酸序列度相似性。通过研究甘蔗中ScAOC基因的序列特征和表达特性,将为深入研究ScAOC在甘蔗中的作用奠定基础。
研究发现,不同植物的AOC基因在不同组织部位的表达存在差异。如Stenzel等[19]发现在拟南芥叶片中,AtAOC1和AtAOC2具有较高的表达量,但是在花中AtAOC3表达量最高,在根中AtAOC4表达量较高;在曹晏彬等[20]发现在苹果中MdAOC1基因在茎部高表达;而刘晓慧等[21]发现在金鱼草AmAOC在花中表达量最高,而在根中最低。本研究中我们发现ScAOC基因在甘蔗各部位均有表达,且在叶中的表达量最高。
大量研究显示,AOC在植物对非生物胁迫的防御反应中起着重要作用。在植物生长发育过程中,最常见的非生物胁迫有机械损伤、干旱、低温、高盐等。当番茄收到机械损伤,可在其叶片上检测到AOC基因表达量的升高[22];当高盐或低温处理麻风树时,发现JaAOC表达量快速上升[23]。而本实验所研究的4种非生物胁迫,ScAOC对其均有应答,其中在PEG胁迫下表达最迅速且相对表达量达到了4种胁迫中的最高值,为对照组的6.17倍,其次为NaCl胁迫。MeJA作为茉莉酸甲基化后的产物,参与了茉莉酸类物质的生物合成途径,在植物抗虫抗病上的作用颇为显著。在苹果[20]、白木香[18]中发现喷施茉莉酸甲酯后,对应的AOC基因表达量呈现先上升后下降趋势,这与我们的研究结果一致,只是表达峰值出现在不同时间点,这也说明了不同植物AOC基因对该激素处理有不同的表达模式。我们认为外源刺激是短暂且非持久的,过多的JA积累触发了植物体内自我保护机制,从而抑制了植物体内AOC基因的持续高表达。而在ABA处理12 h时的相对表达量为对照组的0.82倍,出现抑制表达情况,同样在研究水稻OsAOC的表达量时发现ABA对其有明显抑制[24],植物体内其他激素生物合成途径对JA信号途径的影响错综复杂,具体机制目前尚不清楚。综合我们的研究结果显示,盐、干旱等外界不良环境的胁迫可以改变ScAOC的表达,且多种激素参与AOC的表达调控,但是不同植物的调控过程和机理可能有所差异。
此外,AOC在植物防御生物胁迫的过程中也起着重要的作用。吕丽敏[25]等在甜菜夜蛾取食12 h后的棉花中检测发现GhAOC表达量明显上升,达到对照组的4.0倍,差异极显著;而在番茄受棉铃虫咬食的胁迫实验中发现,番茄在被取食3 h时后体内AOC表達水平达到顶峰,且JA类物质大量合成[26];此外JA类信号物质可以短时间内在受伤植株的受伤部位以及未受伤部位大量合成,来应对外界刺激如病原菌感染、昆虫取食等并做出快速响应,产生信号转导,进而调控植物的抗性[27-28]。本研究发现甘蔗在生物胁迫(粘虫取食和病原菌)下,体内ScAOC基因表达水平均明显提高。因此我们认为甘蔗受到外界的生物胁迫下也能够迅速通过AOC基因表达量的提高,合成JA类物质产生防御反应,阻止外界病原和昆虫的进一步取食以达到自我防御的作用。
参考文献
[1] 陈如凯. 现代甘蔗遗传育种[M]. 北京: 中国农业出版社, 2011.
[2] Anderson J M. Jasmonic acid-dependent increases in the level of specific polypeptides in soybean suspension cultures and seedlings[J]. Journal of Plant Growth Regulation, 1988, 7(4): 203-211.
[3] Meyer A, Miersch O, Büttner C, et al. Occurrence of the plant growth regulator jasmonic acid in plants[J]. Journal of Plant Growth Regulation, 1984, 3(1): 1-8.
[4] Reinbothe C, Springer A, Samol I, et al. Plant oxylipins: role of jasmonic acid during programmed cell death, de-fence and leaf senescence[J]. Febs Journal, 2009, 276(17): 4666-4681.
[5] Wasternack C, Hause B. Jasmonates and octadecanoids: signals in plant stress responses and development [J].Progress in Nucleic Acid Research and Molecular Bi-ology, 2002, 72: 165-221.
[6] Tsonev T D, Lazova G N, Stoinova Z G, et al. A possible role for jasmonic acid in adaptation of barley seedlings to salinity stress[J]. Journal of Plant Growth Regulation, 1998, 17(3): 153-159.
[7] Parthier B. Jasmonates: Hormonal regulators or stress factors in leaf senescence[J]. Journal of Plant Growth Regulation, 1990, 9: 57-63.
[8] Stenzel I, Hause B, Miersch O, et al. Jasmonate biosynthesis and the allene oxide cyclase family of Arabidopsis thaliana[J]. Plant Molecular Biology, 2003, 51(6): 895-911.
[9] Creelman R A, Mullet J E. Biosynthesis and action of jas-monates in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48: 355-381.
[10] Schaller F. Enzymes of the biosynthesis of octadecano-id-derived signalling molecules[J]. Journal of Experimental Botany, 2001, 52(354): 11-23.
[11] Ziegler J, Stenzel I, Hause B, et al. Molecular cloning of allene oxide cyclase: The enzyme establishing the stereo-chemistry of octadecanoids and jasmonates[J]. Journal of Biological Chemistry, 2000, 275(25): 19132-19138.
[12] Hamberg M, Fahlstadius P. Allene oxide cyclase: a new enzyme in plant lipid metabolism[J]. Arch Biochem Biophys, 1990, 276(2): 518-526.
[13] Hause B, Stenzel I, Miersch O, et al. Occurrence of the allene oxide cyclase in different organs and tissues of Arabidopsis thaliana[J]. Phytochemistry, 2003, 64(5): 971-980.
[14] Ling H, Wu Q, Guo J, et al. Comprehensive selection of reference genes for gene expression normalization in sugar-cane by real time quantitative rt-PCR[J]. PLoS One, 2014, 9(5): e97469.
[15] 闕友雄, 许莉萍, 徐景升, 等. 甘蔗基因表达定量PCR分析中内参基因的选择[J]. 热带作物学报, 2009, 30(3): 274-278.
[16] Laudert D, Weiler E W. Allene oxide synthase: a major control point in Arabidopsis thaliana octadecanoid signalling[J]. The Plant Journal, 1998, 15(5): 675-684.
[17] Shan X Y, Wang Z L, Xie D. Jasmonate signal pathway in Arabidopsis[J].Journal of Integrative Plant Biology, 2007, 49(1): 81-86.
[18] 董先娟, 李铁铮, 冯莹莹, 等. 白木香丙二烯氧化物环化酶基因(AsAOC1)的克隆与表达分析[J]. 药学学报, 2018, 53(3): 467-475.
[19] Stenzel I, Otto M, Delker C, et al. ALLENE OXIDE CYCLASE (AOC) gene family members of Arabidopsis thaliana: tissue-and organ-specific promoter activities and in vivo heteromerization[J]. Journal of experimental botany, 2012, 63(17): 6125-6138.
[20] 曹晏彬, 柏素花, 戴洪义. 苹果丙二烯氧化物环化酶基因MdAOC1的克隆与表达分析[J]. 林业科学, 2013, 49(12): 73-80.
[21] 刘晓慧, 冷平生, 胡增辉. 金鱼草丙二烯环化酶基因AmAOC的克隆及表达分析[J]. 分子植物育种, 2017, 15(9): 3489-3496.
[22] Hause B, Stenzel I, Miersch O, et al. Tissue-specific oxylipin signature of tomato flowers: allene oxide cyclase is highly expressed in distinct flower organs and vascular bundles[J]. The Plant Journal, 2000, 24(1): 113-126.
[23] Liu B, Wang W G, Gao J H, et al. Molecular cloning and characterization of a jasmonate biosynthetic pathway gene for allene oxide cyclase from Jatropha curcas[J]. Acta Phy-siologiae Plantarum, 2010, 32(3): 531-539.
[24] Agrawal G K, Jwa N S, Shibato J, et al. Diverse environ-mental cues transiently regulate OsOPR1 of the “octadeca-noid pathway” revealing its importance in rice de-fense/stress and development[J]. Biochemical and Biophysical Research Communications, 2003, 310(4): 1073-1082.
[25] 吕丽敏, 张 帅, 雒珺瑜, 等. 甜菜夜蛾和茉莉酸甲酯处理对棉花茉莉酸合成途径关键基因及萜类合酶基因表达的影响[J]. 植物生理学报, 2018, 54(4): 636-644.
[26] 崔伟康, 杨 鹏, 廉法卓, 等. 茉莉酸信号转导途径介导番茄对棉铃虫的抗性[J]. 福建农林大学学报(自然科学版), 2016, 45(4): 371-375.
[27] Kessler A, Halitsctke R, Baldwin L T. Sliencing the jasmo-nate cascade:induced plant defenses and insect opula-tions[J]. Science, 2004, 305(5684): 655-668.
[28] Devoto A, Ellis C, Magusin A, et al. Expression profiling reveals COI1 to be a key regulator of genesinvolved in wound- and methyl jasmonate-induced secondary metabol-ism, defence, and hormone interactions[J]. Plant Molecular Biology, 2005, 58(4): 497-513.
责任编辑:黄东杰
