Pannx1通道阻滞剂对急性癫痫小鼠海马谷氨酸能神经元电生理变化的影响
2021-07-20倪红郑卜真王恩柯绍发马传花王皖芬罗莎
倪红 郑卜真 王恩 柯绍发 马传花 王皖芬 罗莎
癫痫是一组以大脑神经元异常放电所引起的短暂性中枢神经系统功能失常为特征的慢性脑部疾病。临床治疗时,常用的传统抗癫痫药物作用有限,约40%的癫痫发作不能得到有效控制,且长期服药会导致患者认知功能减退。尤其癫痫患者中儿童比例高,处于大脑发育期的患儿长期服药对智力所造成的影响远超成人患者。谷氨酸是哺乳动物脑内最重要的兴奋性递质,参与癫痫发生、学习、药物依赖成瘾、记忆及神经系统退行性疾病等多种病理生理过程。N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体,是中枢离子型谷氨酸受体。Pannx1是Pannx家族中唯一被证明可以形成功能通道的成员,在神经元和胶质细胞中均有表达[1-6]。Thompson等[7]研究发现NMDA受体激活后继发的内向电流系Pannx 1通道开放所致,Pannx1通道可能在癫痫异常电活动中扮演重要角色,阻断Pannx1通道能抑制癫痫发作。本实验通过研究急性癫痫小鼠海马谷氨酸能神经元的电生理变化及使用Pannx1通道阻滞剂干预后的电生理变化,现将结果报道如下。
1 材料和方法
1.1 实验动物选择、建模及癫痫发作分级标准
1.1.1 实验动物选择 健康C57 Thy1-YFP小鼠45只,出生后 15~17 d,体重(15.0±0.5)g,雄性 24 只,雌性 21只,由蚌埠医学院实验动物中心提供。本实验通过动物伦理委员会伦理审查,全程遵守实验中心动物管理条例。将小鼠随机分为癫痫组、Pannx1组和对照组,各15只。
1.1.2 建模 癫痫组、Pannx1组小鼠腹腔注射东莨菪碱注射液3 ml/kg,30 min后腹腔注射匹鲁卡品注射液15 ml/kg,诱发V级癫痫发作持续1 h为建模成功,注射后未诱发Ⅲ级以上癫痫发作,可重复给予原剂量匹鲁卡品,以5次为最高限。Pannx1组在建模前1 h腹腔注射甲氟喹溶液20 ml/kg[8];癫痫组和对照组腹腔注射0.9%氯化钠注射液20 ml/kg。
1.1.3 癫痫发作分级 采用小鼠痫性发作分级标准(Racine标准):0级:无面部阵挛,Ⅰ级:面部阵挛,Ⅱ级:Ⅰ级+节律点头,Ⅲ级:Ⅱ级+前肢阵挛,Ⅳ级:Ⅲ级+后肢站立,V级:Ⅳ级+跌倒。
1.2 方法
1.2.1 脑片制备 小鼠癫痫发作持续10 min后腹腔注射2%的戊巴比妥注射液0.1 ml进行麻醉,断头取脑,在充分氧合的冰水混合人工脑脊液中切厚度400 μm的脑片,将其孵育在25℃充分氧和的人工脑脊液[9]中1~2 h,再转移至31℃充分氧和的人工脑脊液灌流槽中进行电位记录。
1.2.2 海马谷氨酸能神经元的选择 使用IR-DIC光学显微镜(日本Nikon公司,E600FN型)在脑片中选择海马谷氨酸能神经元,其在波长575 nm光激发下可发出黄色荧光。
1.2.3 海马谷氨酸能神经元记录和指标测定 使用Axoclamp-200B放大器膜片钳电流钳模式记录海马谷氨酸能神经元动作电位峰间距(inter-spike interval,ISI),电压钳模式记录自发性兴奋性突触后电流(spontaneous excitatory postsynaptic current,sEPSC)。将电信号输入到 pClamp-10(Axon Instrument Inc,Foster CA,USA)进行数据采集和分析。按照实验要求设置去极化电流脉冲的强度和持续时间,诱发动作电位,放大器的高频滤波为3 kHz。电压钳模式下将神经元膜电位钳制在-65 mV记录自发sEPSC。膜片钳电极管内充满标准电极液,渗透压为 295~305 mOsmol,电极阻抗为 5~6 MΩ。ISI表示动作电位的发放能力,指去极化电流脉冲诱发动作电位中相邻两个动作电位峰顶点间的距离(图1)。统计分析细胞膜静息膜电位超过-70 mV的数据。sEPSC包括电流发放的间隔和幅度(图2)。sEPSC的间隔和幅度结果以累积概率的50%表示,以进行统计比较[10]。
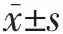
2 结果
2.1 3组小鼠海马谷氨酸能神经元动作电位ISI比较 见图 1、表 1。
由图1、表1可见,Pannx1组小鼠海马谷氨酸能神经元动作电位ISI较癫痫组延长,差异有统计学意义(P<0.01);癫痫组ISI较对照组明显缩短,差异有统计学意义(P<0.01)。

表1 3组海马谷氨酸能神经元动作电位ISI的变化(ms)
图1 3组小鼠海马谷氨酸能神经元动作电位神经元动作电位峰间距(ISI)比较(a:癫痫组;b:Pannx1组;c:对照组)
2.2 3组小鼠海马谷氨酸能神经元sEPSC比较 见图2、表 2。

表2 3组海马谷氨酸能神经元sEPSC间隔及幅度的变化

图2 3组小鼠海马谷氨酸能神经元自发性兴奋性突触后电流(sEPSC)比较
由图2、表2可见,与对照组比较,Pannx1组、癫痫组海马谷氨酸能神经元sEPSC间隔缩短,幅度增大,差异均有统计学意义(均P<0.01);与癫痫组比较,Pannx1组sEPSC间隔增加、幅度减小,差异有统计学意义(P<0.01)。
3 讨论
癫痫的发病机制是近年来研究的热点,目前研究认为癫痫的发生是由于兴奋性神经元活性增强和谷氨酸释放量增加,或抑制性神经元活性减弱和抑制性氨基酸递质释放量减少造成的。谷氨酸能神经元是脑内最主要的兴奋性神经元,各类癫痫的发生几乎均与其兴奋性变化有关。谷氨酸能神经元形态呈锥形,有明显的轴树突,其典型特征是簇发放。sEPSC是由动作电位诱发的谷氨酸能神经元释放谷氨酸而引起的自发兴奋性突触后电流。其中sEPSC的间隔表示单位时间内谷氨酸能神经元释放谷氨酸的数量变化,包括谷氨酸能神经元递质的释放和由动作电位诱发的谷氨酸能神经元递质释放数目增减;sEPSC的幅度变化反映单位时间内突触前递质释放量和突触后膜受体数目或受体的反应性变化。sEPSC的间隔和幅度代表神经元接受外来信号并产生sEPSC的能力。ISI表示动作电位的输出能力,是神经元兴奋性的重要指标。本研究使用匹鲁卡品建立癫痫动物模型,利用电压钳和电流钳记录海马的谷氨酸能神经元sEPSC和ISI。通过研究发现在相同刺激强度、刺激时间下癫痫组较对照组ISI均明显降低,sEPSC间隔缩短、幅度增大,表明癫痫发作后谷氨酸能神经元发放的动作电位个数增多,兴奋性升高,发放冲动增加。
Pannx是10年前发现的一类膜蛋白通道,这些通道介导了细胞质和细胞外空间之间的分子交换[11]。Pannx1是Pannx家族中唯一被证明可以形成功能通道的成员。Pannx1通道可以在多种情况下被激活,包括机械应激、去极化、胞外K+升高、胞内Ca2+、嘌呤能受体激活或缺血[12-15]。Pannx1通道的开放被认为有害,主要见于炎症、缺血性脑卒中或急性癫痫活动等病理状态[16-18]。Dossi等[19]研究发现Pannx1通道激活通过嘌呤能2受体的三磷酸腺苷信号通路促进癫痫发作的产生和维持。Thompson等[7]在分离的海马锥体神经元研究中发现NMDA受体激活后继发的内向电流系Pannx 1通道开放所致,在海马脑片中的研究中发现Pannx1干扰肽能显著降低NMDA诱导的癫痫样放电频率和幅度以及阻断并抑制锥体神经元摄取荧光染料,以上结果显示Pannx1通道可能在癫痫异常电活动中扮演重要角色,阻断Pannx1通道能抑制癫痫发作。
目前用于治疗疟疾的药物甲氟喹对Pannx1通道有药理抑制作用。Pinheiro等[12,20-21]在研究中发现甲氟喹可抑制海人酸模型小鼠癫痫自发发作的频率和总时间,强烈抑制癫痫发作。本研究使用甲氟喹阻断Pannx1通道,结果显示Pannx1组较癫痫组海马谷氨酸能神经元动作电位的ISI升高、sEPSC间隔增大、幅度降低,说明甲氟喹阻断Pannx1通道能使癫痫小鼠海马谷氨酸能神经元兴奋性降低,有抑制神经元兴奋性的作用,且甲氟喹有抗癫痫作用。甲氟喹通过血脑屏障有立体选择性,在大脑的不同区域会达到不同的浓度。尽管甲氟喹是Pannx1的良好抑制剂[22],但在少数疟疾患者中已被证明可诱发癫痫发作[23-24]。甲氟喹由于作用于不同的靶点如神经元、星形细胞、钠离子通道或内质网蛋白,而表现出多种不良反应[25]。这些报道显示甲氟喹用于治疗癫痫存在明显的局限性。
综上所述,甲氟喹阻断Pannx1通道能抑制癲痫小鼠海马谷氨酸能神经元的兴奋性,但由于其不良反应,很难被认为是潜在的抗癫痫药物,希望未来能不断发现具有高选择性的Pannx1通道阻断剂,增加癫痫治疗药物的种类,从而控制难治性癫痫。
