异甘草素联合顺铂抑制三阴性乳腺癌细胞增殖的效果研究
2021-07-20梅瑜张松蒋静
梅瑜 张松 蒋静
乳腺癌是女性常见的癌症之一,是全球第五大癌症死亡原因[1-2]。在众多乳腺癌亚型中,三阴性乳腺癌(triple negative breast cancer,TNBC)由于癌细胞增殖、侵袭转移能力强,是目前最难治疗的乳腺癌亚型[3]。尽管现在有以聚(ADP-核糖)聚合酶1(PARP1)抑制剂为典型代表的多种小分子抑制剂被证明治疗TNBC效果显著[4-5],但小分子抑制剂普遍存在适应证范围狭窄、易产生耐药的问题[5-6],目前临床上用于治疗TNBC的药物主要还是紫杉醇和顺铂(cisplatin,DDP)等化疗药物[7]。然而,TNBC患者容易对化疗药物产生耐药性,表现为临床预后差、易复发[7-8]。DDP主要通过引起DNA损伤来诱导细胞死亡[9-10]。癌细胞长期暴露于DDP下可导致细胞内参与DNA损伤修复的一些基因的过度表达和活化,导致DNA修复功能增强而产生耐药性[11-12]。
异甘草素(isoliquiritigenin,ISL)是从甘草中提取出来的,具有抗肿瘤活性成分,被证明可通过诱导细胞凋亡、促进细胞自噬、抑制癌组织血管生成等多种机制治疗乳腺癌[13-14]。同时有研究表明,ISL可导致其下游骨髓细胞瘤癌基因(c-Myc)的过度表达[15]。而c-Myc的异常表达被证明可上调重组酶51(Rad51)、乳腺癌易感基因(BRCA)1/2的表达,继而促进DNA同源重组(HR)修复[16-17]。因此本研究旨在探究ISL联合DDP抑制TNBC细胞增殖的效果,并初步探讨两者协同治疗TNBC的机制。
1 材料和方法
1.1 细胞株 人野生型TNBC细胞株MDA-MB-231购自上海生命科学院细胞资源中心。
1.2 主要试剂与仪器 c-Myc一抗(批号:18583S)、Rad51一抗(批号:8875S)、BRCA1 一抗(批号:14823S)、BRCA2 一抗(批号:10741S)、β-肌动蛋白(β-actin)一抗(批号:4970S)、鼠二抗(批号:14709S)和兔二抗(批号:14708S)均购自美国Cell Signaling Technology公司;DDP(批号:P4394,规格:25 mg)和 ISL(批号:I3766,规格:10 mg)均购自美国Sigma-Aldrich公司;MTT细胞生长活力检测试剂盒(批号:KGA311)、Annexin VFITC和典化丙啶(PI)凋亡检测试剂盒(批号:KGA105)、彗星实验测试试剂盒(批号:KGA240)、Leibovitz's L-15培养基(批号:KGM41300-500)和胰酶(批号:KGY001)均购自江苏凯基生物技术股份有限公司;RIPA细胞裂解缓冲液(批号:SY021-100)购自南京三翊生物科技有限公司;Cytation 5酶标仪购自美国Biotek公司;FACSCantoⅡ流式细胞仪购自美国BD公司;EVOS XL Core倒置荧光显微镜购自美国 ThermoFisher公司;Gel DocTMXR+凝胶成像系统购自美国Bio-rad公司;CO2细胞培养箱购自美国ThermoFisher公司;蛋白电泳仪系统购自美国Bio-rad公司。
1.3 方法
1.3.1 细胞培养 人野生型TNBC细胞株MDA-MB-231置于含10%FBS、100 mg/L链霉素、100 KU/L青霉素的Leibovitz's L-15培养基中培养。细胞培养箱条件:CO2浓度为5%,温度为37°C。
1.3.2 细胞分组及细胞活力测定 采用MTT法。将对数生长期的MDA-MB-231细胞随机分为4组:ISL/DDP 联用组(同时经 10 μmol/L ISL 和 10 μmol/L DDP共同处理MDA-MB-231细胞48 h)、DDP处理组(经30 μmol/L DDP 处理 MDA-MB-231细胞 48 h)、ISL 处理组(经25 μmol/L ISL处理 MDA-MB-231细胞48 h)和对照组(未施药的MDA-MB-231细胞)。将各组细胞以5×104个/ml接种于96孔板,培养过夜。待细胞贴壁之后,给各组细胞施药48 h,随后加入MTT继续培养4 h,吸除上清液,在每孔加入150 μl DMSO,震荡 30 s之后,用酶标仪测定570 nm处的吸光度值。细胞活力=实验组吸光度值/对照组吸光度值×100%。半数抑制浓度(IC50)值为抑制细胞活力到50%的药物浓度。
1.3.3 ISL/DDP联用组协同指数(CI)测定 参考ISL处理组和DDP处理组对应药物的IC50值,ISL/DDP联用组 ISL 与 DDP 联用比例设置为 4∶1、2∶1、1∶1、1∶2 以及 1∶4。公式 CI=CA,X/ICX,A+CB,X/ICX,B[18]。其中 CA,X和 CB,X分别表示ISL和DDP联合用药达到X%生长抑制率的浓度。而ICX,A和ICX,B则表示ISL和DDP单独使用达到相同生长抑制率时的浓度。当CI<1时表明两者联用具有协同效果,CI=1时表明两者没有协同作用仅仅是加和作用,当CI>1时表明两者联用具有拮抗作用。
1.3.4 4组细胞凋亡率检测 采用Annexin V-FITC和PI双染法。将对数生长期的MDA-MB-231细胞以2×105个/ml接种在6孔板上。将4组处理后的细胞用不含EDTA的胰酶消化,PBS清洗两遍,按照试剂盒说明书方法分别用Annexin V-FITC和PI对各组细胞染色。采用流式细胞仪测定各组细胞凋亡情况,以Annexin V阳性的凋亡细胞比例作为凋亡率进行统计,细胞凋亡数据采用FlowJo 7.6软件处理。
1.3.5 4组细胞DNA损伤程度检测 采用彗星实验法[19]。将对数生长期的MDA-MB-231细胞以2×105个/ml接种在6孔板上。将4组处理后的细胞用不含EDTA的胰酶消化,并用不含Ca2+的PBS清洗两遍。取1×104个/ml的细胞与低熔点琼脂糖以1∶10混合并铺在载玻片上。随后用试剂盒裂解缓冲液在4°C环境下裂解细胞2 h,后在室温下用碱性解旋液解旋DNA 30 min。将解旋过DNA的细胞在21 V条件下电泳30 min,之后用PI染色,在倒置荧光显微镜下观察。每个载玻片随机选择5个视野进行观察。
1.3.6 4 组细胞 c-Myc、Rad51、BRCA1、BRCA2 表达水平检测 采用Western blot法。收集各组处理后的细胞,用RIPA细胞裂解缓冲液在冰上裂解细胞60 min。取各组25.0 μg全蛋白用SDS-PAGE凝胶电泳分离,并将分离得到的目标蛋白通过湿法电转印到PVDF膜上。膜上的蛋白用5%脱脂奶粉室温封闭1 h,之后用一抗4°C孵育过夜,二抗室温孵育1 h。最后,PVDF膜上的蛋白用增强化学发光液显色,检测系统检测后,用Image J处理并比较各组蛋白表达水平的差异。本研究实验室部分工作委托南京三翊生物科技有限公司完成。

2 结果
2.1 DDP处理组和ISL处理组细胞活力的比较 DDP处理组中,随着DDP浓度的增加,细胞活力显著降低,对应的 IC50值为(29.8±2.3)μmol/L;ISL 处理组中,随着ISL浓度的增加,细胞活力逐渐降低,对应的IC50值为(25.6±1.8)μmol/L。见图 1。
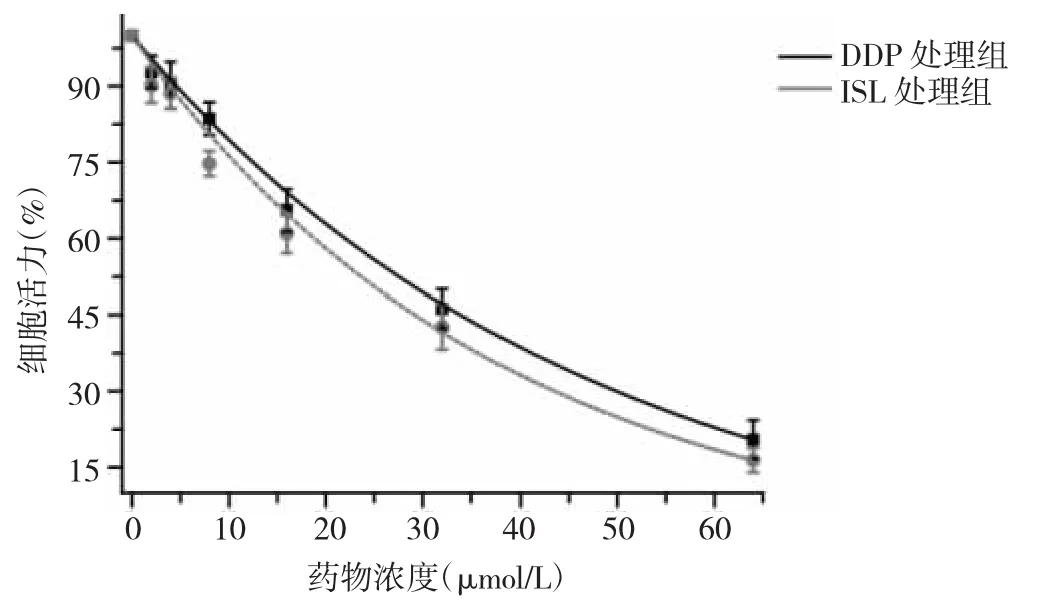
图1 顺铂(DDP)处理组和异甘草素(ISL)处理组细胞生长活力的比较
2.2 ISL/DDP联用组不同浓度比例时的CI比较 ISL/DDP 联用组内,当 ISL/DDP 联用浓度比例为 1∶2、1∶1 以及2∶1时,对应的CI均<1.0。当ISL/DDP联用浓度比例为1∶1时,两者抑制细胞活力到50%的CI值为0.84,协同效果最好。见图2。

图2 异甘草素(ISL)/顺铂(DDP)联用组不同浓度比例时的协同指数(CI)比较
2.3 4组细胞凋亡率比较 与对照组比较,DDP处理组和ISL处理组细胞凋亡率均明显增加,差异均有统计学意义(均P<0.05);与DDP处理组比较,ISL/DDP联用组细胞凋亡率明显增加,差异有统计学意义(P<0.05)。见图 3、表 1。

表1 4组细胞凋亡率比较(%)
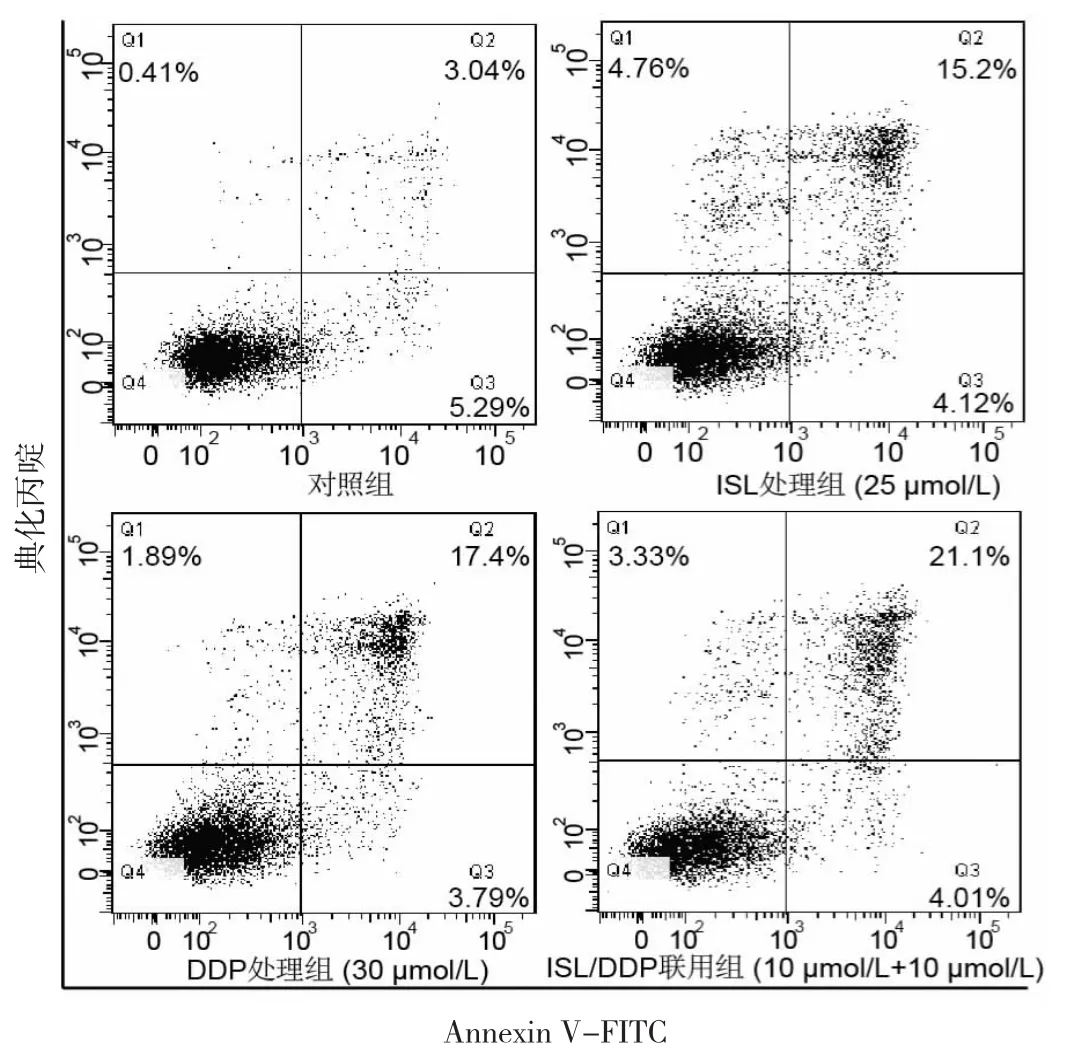
图3 4组细胞凋亡率比较(ISL为异甘草素;DDD为顺铂)
2.4 4组细胞DNA损伤程度比较 与对照组比较,DDP处理组和ISL处理组细胞内均可见明显的DNA拖尾,DNA损伤程度显著;与ISL处理组比较,ISL/DDP联用组DNA拖尾现象更加明显;与DDP处理组比较,ISL/DDP联用组DNA拖尾现象无明显变化。见图4。

图4 4组细胞DNA损伤程度比较(DDD为顺铂;ISL为异甘草素)
2.5 4组细胞 c-Myc、Rad51、BRCA1及 BRCA2表达水平比较 与对照组比较,DDP处理组Rad51和BRCA1表达水平均明显增加,差异均有统计学意义(均P<0.05),ISL处理组 c-Myc、Rad51、BRCA1以及 BRCA2表达水平均明显降低,差异均有统计学意义(均P<0.05)。与DDP 处理组比较,ISL/DDP 联用组 c-Myc、Rad51、BRCA1以及BRCA2表达水平均明显降低,差异均有统计学意义(均P<0.05)。与ISL处理组比较,ISL/DDP联用组c-Myc、Rad51及BRCA2表达水平均明显降低,差异均有统计学意义(均P<0.05)。见图5、表2。
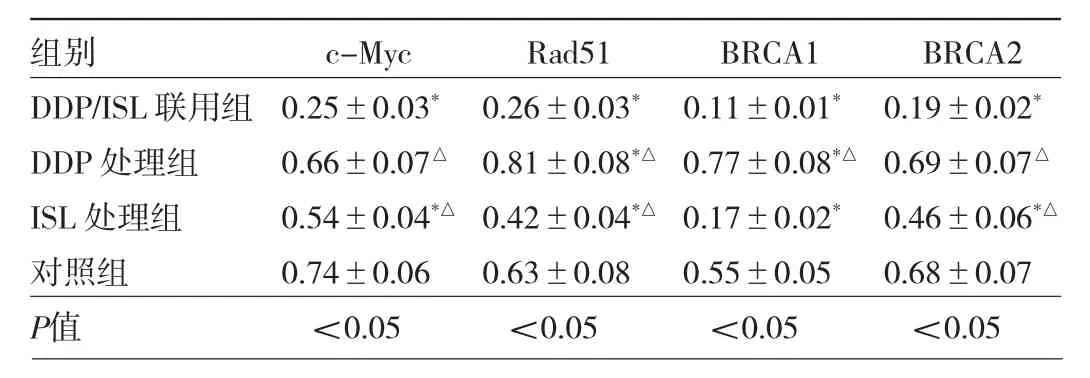
表2 4组细胞c-Myc、Rad51、BRCA1及BRCA2表达水平比较

图5 4组细胞骨髓细胞瘤癌基因(c-Myc)、重组酶51(Rad51)、乳腺癌易感基因1(BRCA1)及乳腺癌易感基因2(BRCA2)表达的电泳图(DDD为顺铂;ISL为异甘草素;β-actin为β-肌动蛋白)
3 讨论
TNBC细胞增殖、侵袭转移能力强,无法通过内分泌及抗人表皮生长因子受体-2分子进行靶向治疗,因此是致死率很高的乳腺癌亚型[1-3]。尽管有很多小分子抑制剂相继研发用于靶向治疗TNBC,但由于抑制剂本身适应证范围狭窄,目前DDP和紫衫醇依旧是治疗TNBC的临床主要用药[4-7]。与紫杉醇治疗机制不同,DDP主要是通过与癌细胞DNA作用致DNA损伤,最终导致细胞死亡[9-10]。与所有的化疗药物相同,肿瘤细胞对DDP会产生适应性耐药[11-12]。耐药细胞对DDP不再敏感,这限制了药物的临床使用。目前,针对单一药物耐药性问题,临床主要通过联合用药来提高肿瘤治疗效果。
ISL作为甘草提取物,其主要的抗肿瘤成分被证明可通过多种途径抑制乳腺癌细胞恶性增殖。本研究发现ISL和DDP都可以很好地抑制野生型TNBC细胞MDA-MB-231的恶性增殖。通过双药协同实验,本研究亦发现ISL和DDP联用可以协同抑制细胞活力。随后,本研究分析了两者联用抑制MDA-MB-231细胞恶性增殖的原因,发现ISL和DDP联用不仅可以协同诱导细胞凋亡,还可以促进DNA损伤。
细胞内DNA活性氧物种或者化疗药物诱导损伤之后,细胞内一些参与DNA单链损伤修复及DNA双链损伤修复的因子便会被激活并募集到损伤DNA处进行修复[20]。DDP主要通过诱导DNA损伤发挥抗癌功效[9-10]。但针对单一化疗药物,癌细胞可通过激活一些DNA损伤修复相关的因子来抵制药物对本身的杀伤作用[12]。本研究发现,DDP在抑制细胞恶性增殖、诱导细胞凋亡和DNA损伤的同时,可以导致细胞内HR修复相关蛋白Rad51和BRCA1的过度表达。作为参与HR修复的主要蛋白,Rad51和BRCA1的过度表达将导致细胞HR修复功能增强[17]。这将导致细胞在长时间暴露于DDP之后,对其产生耐药性。而ISL可以通过下调c-Myc的表达,进而下调其下游蛋白Rad51、BRCA1、BRCA2的表达来抑制HR修复。ISL和DDP联用之后,细胞内c-Myc、Rad51、BRCA1以及BRCA2的表达量明显降低。基于此,本研究团队推断ISL可通过阻遏损伤DNA的HR修复途径,协同促进DDP引起的细胞DNA损伤和细胞凋亡,继而抑制细胞的恶性增殖。
综上所述,联合ISL和DDP可以有效抑制TNBC细胞的恶性增殖。DDP可直接诱导TNBC细胞DNA损伤,ISL则可以通过下调HR修复相关蛋白Rad51、BRCA1及BRCA2的表达来阻遏损伤DNA的修复。两者联用可协同促进DNA损伤,诱导细胞凋亡。
