硫化氢调控Nrf2-HO-1信号通路对休克大鼠肺损伤的保护作用
2021-07-20黄朝露赵晓勇林丽丽徐文莉李海燕
黄朝露 赵晓勇 林丽丽 徐文莉 李海燕
创伤失血性休克是机体遭遇重大创伤后死亡的主要原因之一[1]。创伤后的大出血、微循环灌注不足、组织广泛损伤所导致的后续炎症综合征等均可引起重要脏器功能衰竭。而在后期复苏时,缺血-再灌注损伤可进一步导致耗氧增加,氧化应激反应增强以及线粒体功能障碍[2]。因此如何减轻缺血-再灌注损伤,改善氧化应激和炎症的发生至关重要。核转录因子E2相关因子2(Nrf2)是具有独特cap-ncollar区域的转录因子,有研究表明,Nrf2可促进血红素加氧酶-1(HO-1)的转录,对细胞有保护作用,在抗氧化应激过程中扮演重要角色[3]。硫化氢(H2S)是第3类气体信号分子,在正常机体内可自行合成,参与机体各大系统生理、病理过程,有研究证实,H2S对创伤失血性休克具有保护作用[4-5]。本研究通过观测外源性H2S硫氢化钠(NaHS)对Nrf2/HO-1信号通路的作用,探讨H2S对创伤失血性休克所致肺损伤的保护作用。
1 材料和方法
1.1 实验动物和分组 36只SD雄性大鼠由温州医科大学实验动物中心提供,动物许可证号:SYXK(浙)2020-0014。大鼠置于自然光、安静环境、室温(23±2)℃、相对湿度(50±10)%环境下饲养 48 h以上,随时可以进食、饮水。采用随机数字表法分为NaHS处理组(NaHS组)、模型组(HTS组)和假手术组(Sham组),每组12只。
1.2 主要试剂和仪器 NaHS购自美国Sigma公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、髓过氧化物酶(MPO)测试盒均购自南京建成生物研究所;HE染色试剂盒购自北京Solarbio公司;Nrf2、HO-1和GAPDH抗体均购自美国Santa公司;山羊抗兔IgG(H+L)购自美国Abcam公司;醋酸锌、N,N-二甲基-对苯二胺硫酸盐、三氯醋酸、三氯化铁均购自美国Sigma公司。OMRP24组织匀浆机购自北京鸿苑鑫仪科技有限公司;KDC-2046低速冷冻离心机购自安徽科大创新股份有限公司;Mini-Proten Tetra System成套电泳系统购自美国BIO-RAD公司;Multiskan GO全波长酶标仪购自美国Thermo Fish科技有限公司;RM2235轮转式石蜡切片机购自上海徕卡显微系统有限公司;LV-150N光学显微镜购自日本尼康公司。
1.3 方法
1.3.1 模型的制备 动物模型的制备参照文献[6],所有大鼠禁食过夜,自由饮水,3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,作腹正中切口5 cm后缝合直接造成软组织创伤。NaHS和HTS组大鼠一侧股动脉留聚乙烯导管放血,另一侧股静脉插管输液及股动脉插管连接压力转换器检测平均动脉压(MAP),在10 min内迅速放血使MAP维持在40 mmHg左右,此时为最大放血量;回输40%最大放血容量的林格液维持上述低血压状态90 min,然后以4倍最大放血容量的林格液复苏60 min,复苏后立即缝合所有伤口。NaHS组在复苏前腹腔注射0.5 ml NaHS(28 μmol/kg),HTS 组予等量 0.9%氯化钠注射液。Sham组仅作腹部切口,不放血、不复苏。复苏2 h后麻醉大鼠,取动脉血2 ml,3 000 r/min离心10 min,提取上清液冻存备用;脱颈处死大鼠后迅速开胸,取双肺组织备用。
1.3.2 血清H2S浓度及SOD、MDA、MPO水平测定 采用去蛋白方法测定H2S浓度,于血清中加入0.5 ml醋酸锌形成沉淀,分别加入0.5 ml N,N-二甲基-对苯二胺硫酸盐和三氯化铁使之充分显色,再加入0.5 ml三氯醋酸和2.5 ml蒸馏水使蛋白沉淀,5 000 r/min离心5 min后取上清液在665 nm波长处测吸光度值,根据标准曲线计算血清中H2S浓度。根据试剂盒说明书的具体步骤检测血清SOD、MDA和MPO水平。
1.3.3 肺系数、肺湿/干重比检测 肺组织称重计算肺系数,肺系数=大鼠肺质量/大鼠体质量×100%。取左肺下叶称湿重,置于75℃烤箱至恒重计算肺湿/干重比。
1.3.4 肺损伤形态观察 将肺组织常规石蜡包埋,切片,HE染色,每组随机选取3只大鼠各1张肺组织切片,每张切片随机选取3个视野观察大鼠肺组织的病理改变。
1.3.5 肺组织Nrf2、HO-1蛋白表达水平检测 采用Western blot法。在肺组织中加入适量RIPA蛋白裂解液和蛋白酶抑制剂,匀浆后提取蛋白,采用BCA法测定蛋白浓度,SDS-PAGE电泳分离蛋白后转至PVDF膜,用5%脱脂牛奶封闭,孵育一抗并4℃过夜,TBST漂洗后孵育HRP结合的二抗,超敏ECL显色,凝胶成像仪观察并拍照。Image J测定光密度并分析。
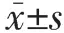
2 结果
2.1 3组大鼠血清H2S浓度及SOD、MDA、MPO水平比较 与Sham组比较,HTS组H2S浓度及SOD、MDA、MPO水平差异均有统计学意义(均P<0.05);与HTS组比较,NaHS组H2S浓度及SOD、MDA、MPO水平差异均有统计学意义(均P<0.01)。见表1。
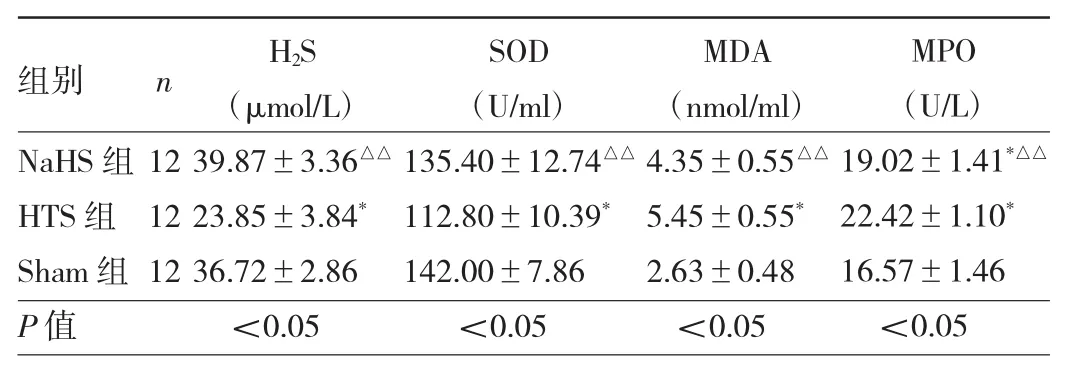
表1 3组大鼠血清H2S浓度、SOD、MDA、MPO水平比较
2.2 3组大鼠肺系数、肺湿/干重比比较 与Sham组比较,HTS组肺系数、肺湿/干重比均明显增加,差异均有统计学意义(均P<0.05);与HTS组比较,NaHS组肺系数、肺湿/干重比均显著下降,差异均有统计学意义(均P<0.01)。见表 2。

表2 3组大鼠肺系数、肺湿/干重比比较
2.3 3组大鼠肺损伤形态学比较 HE染色结果显示,Sham组肺泡形态结构基本完整,轮廓清晰,未见病变;HTS组肺泡壁明显增厚,水肿,炎性细胞浸润,部分肺泡壁塌陷;而NaHS组大鼠肺泡水肿和炎性浸润情况明显改善。见图1。

图1 3组大鼠肺损伤形态学比较(HE染色,×200)
2.4 3组大鼠Nrf2、HO-1蛋白表达水平比较 与Sham组比较,HTS、NaHS组Nrf2、HO-1蛋白表达水平均明显升高,差异均有统计学意义(均P<0.05);与HTS组比较,NaHS组Nrf2、HO-1蛋白表达水平均明显升高,差异均有统计学意义(均P<0.01)。见图2和表3。

表3 3组大鼠Nrf2、HO-1蛋白相对表达量
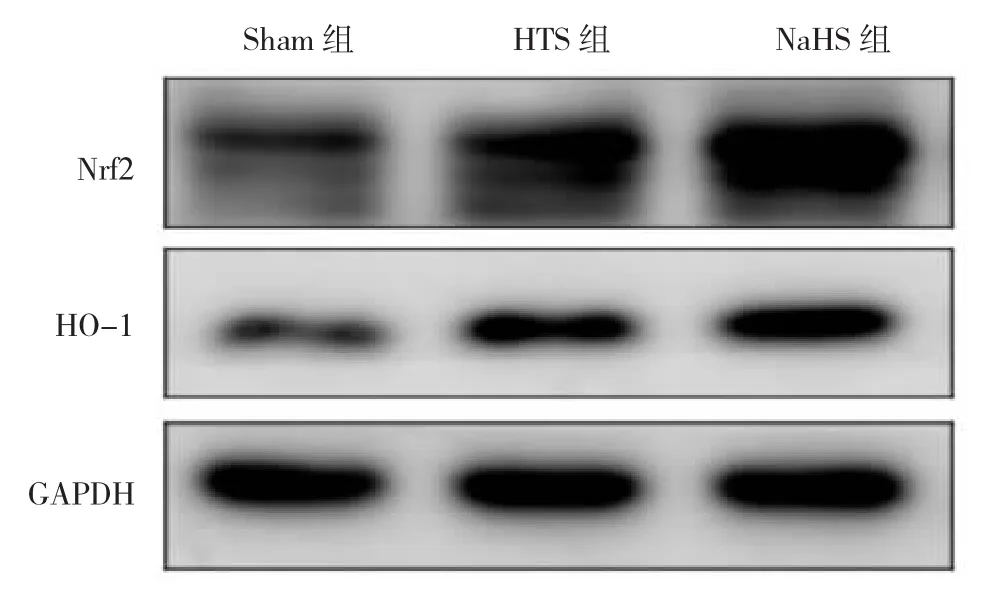
图2 3组大鼠核转录因子E2相关因子2(Nrf2)、血红素加氧酶-1(HO-1)蛋白表达的电泳图(NaHS为硫氢化钠)
3 讨论
创伤失血性休克是由创伤所致机体有效循环容量急剧下降,最后发展为多器官功能障碍的连续过程,病理、生理过程包括机体灌注不足、组织器官缺血、缺氧、细胞代谢障碍、同时产生大量氧自由基等毒性因子使重要器官发生强烈的炎症和氧化应激反应等。后期的液体复苏在增加氧供的同时也造成了再灌注损伤,加剧了“氧供-氧耗”的失衡,氧化应激被进一步激活[1,7]。氧化应激是指体内氧化与抗氧化作用失衡的一种状态。正常机体内,氧自由基清除剂主要有SOD、POD和谷胱甘肽过氧化物酶(GSH-Px);MDA是氧自由基攻击生物膜产生脂质过氧化反应的产物之一,因此可以通过检测以上氧化应激指标来评价机体氧化应激损伤程度。
H2S作为继一氧化氮和一氧化碳之后的第3种气体分子,近些年越来越引人关注[8-9],其主要通过提高细胞内的谷胱甘肽(GSH)水平来对抗氧化应激[10]。Geng等[11]首次提出H2S可通过抗氧化应激反应减轻心肌损伤;此外,H2S还可以通过丝裂原活化蛋白激酶信号通路减少活性氧(ROS)诱导的细胞凋亡[12]。本研究建立创伤失血性休克动物模型,观察H2S供体NaHS对机体创伤早期引起氧化应激反应的影响。本实验结果显示NaHS组、HTS组肺组织中氧化应激标志物MDA、MPO水平均明显高于Sham组,而NaHS组的MDA、MPO水平均明显低于HTS组。此外,SOD水平检测和HE染色结果进一步证明了H2S可在创伤失血性休克引起的肺氧化应激损伤中起到保护作用。
Nrf2(由Nfe2l2基因编码)是主要的真核生物氧化还原活性因子,主要负责调节细胞氧化还原平衡、保护性抗氧化和Ⅱ期排毒反应,其中包括HO-1和SOD[3,13-14]。近期研究发现在肺缺血再灌注损伤小鼠中,经重组高迁移率族蛋白1(rHMGB1)预处理可通过Keap1/Nrf2/HO-1途径抑制氧化应激,从而改善肺缺血再灌注损伤;且使用异丁香酚抑制该途径会加重肺组织损伤和肺缺血再灌注损伤后的炎症反应[15]。此外,Khan等[16]发现咖啡因可显著降低ROS和脂质过氧化物水平,并增强Nrf2和HO-1的表达,从而改善镉诱导的氧化应激、神经炎症和认知障碍。研究还发现抗抑郁药度洛西汀对氧化应激和细胞死亡的神经保护作用机制也依赖于Akt/Nrf2/HO-1途径[17]。本实验研究发现在SD大鼠创伤失血性休克发生后,大量炎性细胞浸润,肺泡壁结构的破坏和增厚,肺系数和肺湿/干重比增加,而经外源性H2S干预后均可显著改善。本研究中还发现创伤失血性休克可增加大鼠肺组织Nrf2和HO-1表达,说明Nrf2-HO-1信号通路可能参与了机体保护作用。干预后NaHS组Nrf2、HO-1表达进一步增加,说明H2S可能通过Nrf2-HO-1信号分子通路来维持“氧供-氧耗”的平衡,增强机体抗氧化应激能力,从而减轻创伤失血性休克导致的肺损伤。
综上所述,外源性H2S可能通过激活Nrf2-HO-1信号通路抑制氧化应激反应,减轻炎性细胞浸润和肺水肿,从而对创伤失血性休克大鼠产生肺保护作用。
