高分辨熔解曲线非标记探针基因分型技术检测恶性疟原虫青蒿素耐药相关K13基因突变方法学的建立*
2021-07-20陈伟忠
陈伟忠
广东省潮州市人民医院检验科,广东潮州 521000
疟疾是由疟原虫造成的一种全球性急性寄生虫传染病[1-2]。据世界卫生组织统计,2018年全球发生了2.28亿例疟疾病例,其中以非洲的撒哈拉以南地区感染疟疾的疫情最重[3]。青蒿素是我国科学家从青蒿中发现的新型抗疟药物。以青蒿素为基础的联合疗法(ACT)被广泛用于疟疾临床治疗,成为治疗疟疾的一线药物[4-5]。近年来,恶性疟原虫开始出现了青蒿素抵抗的现象。目前的研究表明,恶性疟原虫第13号染色体上编码的kelch蛋白的基因,即K13基因,其螺旋桨域N458Y、Y493H、R539T、I543T、R561H和C580Y氨基酸替换能够影响原虫体外存活率和体内清除率,该基因单核苷酸多态性(SNP)可以作为监控ACT药物抗性的分子标记[6]。特别是在东南亚地区C580Y被认为是一种主要和富有潜力的衡量青蒿素抵抗的分子标志。通过对这些恶性疟原虫青蒿素耐药相关基因突变的检测,可以评价和预测耐药性情况[7]。
本实验运用的非标记探针法高分辨熔解曲线(HRM)分析技术,不仅可以确定特定等位基因的存在或缺失,还可以检查探针下的整个区域单个碱基差异[8]。该分析方法的主要优点是灵敏度和特异度极高;所有实验反应试剂均在实验前加入管中,以避免开盖造成的实验污染;其检测通量大而成本低,适合临床大批量标本的筛查[9]。
1 材料与方法
1.1一般资料 通过设计的目的基因突变位点的探针和引物,构建标准质粒,使用HRM非标记探针基因分型技术检测恶性疟原虫青蒿素耐药性相关K13基因C580Y突变位点。
1.2仪器与试剂 Thermo Cell恒温金属浴、薄壁管低俗离心机、BIOER基因扩增仪、LightScanner高分辨溶解曲线分析仪;干血斑基因组DNA提取试剂盒(DP334)、2×Taq plus PCR MasterMix、饱和荧光染料LC Green、96孔全裙边板HSP9665、0.2 mL薄壁管PCR-02-C。
1.3方法
1.3.1设计探针与引物 引物和探针设计后由上海美吉医学检验有限公司合成,产品真空冷冻干燥保存。探针序列:TCATCATCTATGTGTGTTGCTTT-block;上游引物序列:GCTCTTCTATTATACCGAA;下游引物序列:TTCTAATAAGGCATATGGAA。产物长度为218 bp。
1.3.2标准质粒构建 采用人工合成的办法由华大公司合成含有青蒿素耐药相关突变C580Y和野生型的pUC57-amp质粒。
1.3.3PCR反应体系 本实验采用不对称PCR扩增法,上、下游引物比为5∶1。反应体系为20 μL,试剂配制及用量如下:2.0 μL(约20 ng)基因组DNA或103 copy/mL质粒(对照)、0.2 μL 10.0 μmol/L上游引物、1.0 μL 10.0 μmol/L的下游引物、10.0 μL 2×Master Mix(艾德莱公司)、0.5 μL 10.0 μmol/L非标记探针(3′端采用C3 spacer或磷酸化封闭)、2.0 μL饱和荧光染料LC Green,最后加无菌蒸馏水至20.0 μL。进行反应前加入矿物油10 μL,以防止挥发污染。突变型和野生型标本分别进行5个重复实验。
1.3.4PCR扩增与HRM检测 将反应体系加入96孔全裙边板,放至BIOER基因扩增仪,PCR 程序为94 ℃预变性3 min,然后94 ℃ 30 s、60 ℃ 15 s、72 ℃ 20 s,进行55 个循环,95 ℃ 1 min,使异源双链核酸分子形成。15 ℃保持直到实验结束。
扩增完毕后,将96孔全裙边板放至微孔板专用离心机进行离心,将产物聚集于反应孔底部。产物通过Lightsanner96仪器检测分析,设置起始温度为45 ℃,结束温度为95 ℃,仪器采集荧光信号并绘制溶解曲线图进行分析。
1.3.5灵敏度检验 为了验证本实验灵敏度,同时评估该方法在野生型和突变型混合感染中突变检测能力,笔者对突变型和野生型质粒(10~105ng/μL)按不同比例混合稀释。突变型质粒和野生型质粒原倍浓度均为1 105 copy/L,按照突变型/野生型质粒比例为10∶90、30∶70、50∶50、70∶30和90∶10进行混合,然后分别对混合标本进行检测。每个混合比例进行5个重复实验。
2 结 果
2.1HRM检测结果 通过Lightsanner96仪器对产物进行分析形成熔解曲线图。在60~85 ℃形成两个熔解曲线峰,即在低温区(61~69 ℃)的探针峰和高温区(75~84 ℃)的产物峰。在探针峰上,突变型和野生型之间的温度差达到5 ℃,能够很好地鉴别区分,见图1。
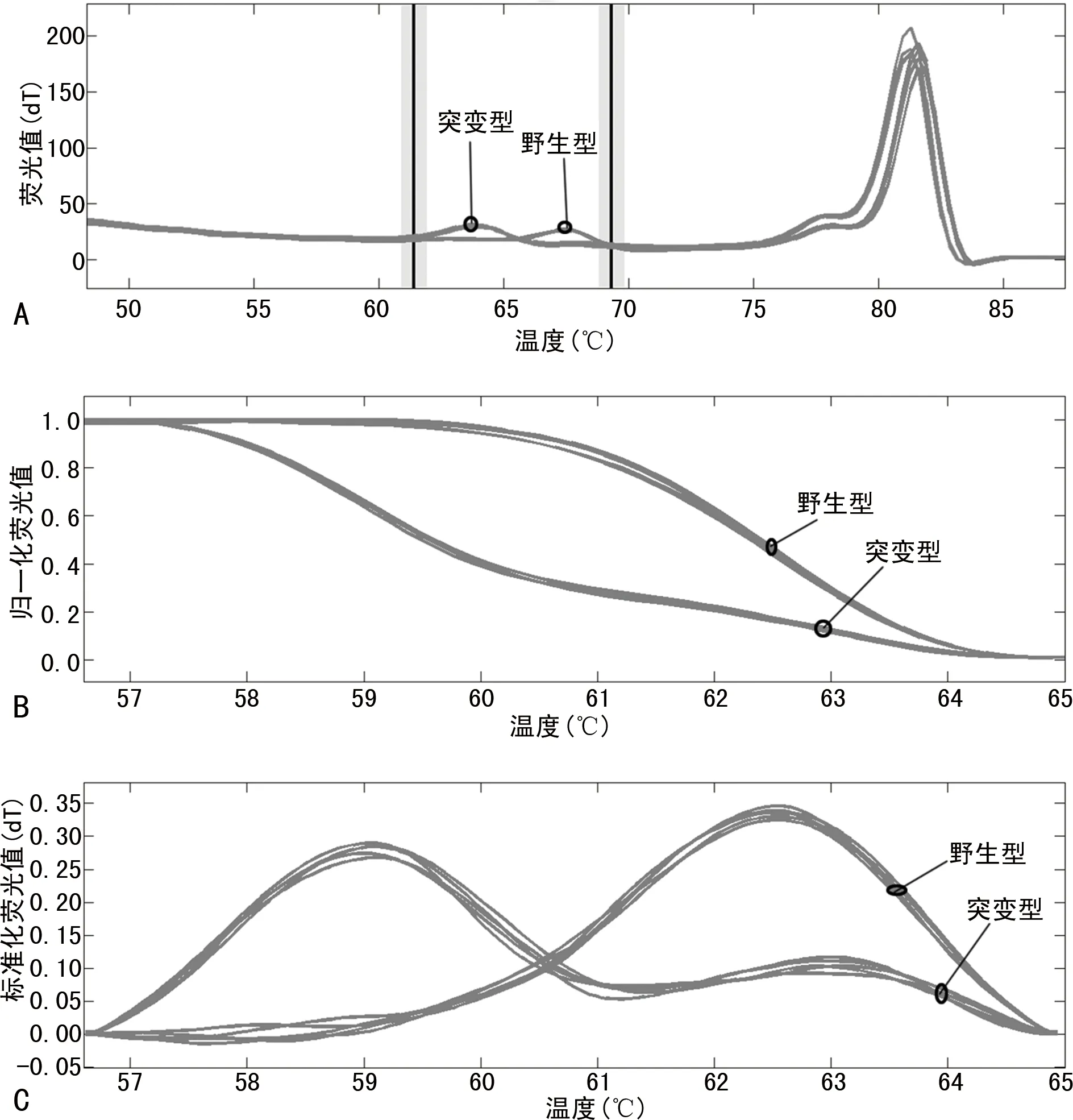
注:A为熔解曲线图;B为差异曲线图;C为标化熔解峰图。
2.2灵敏度检验结果 将突变型和野生型质粒按照比例为10∶90、30∶70、50∶50、70∶30和90∶10进行混合后再检验得到的熔解曲线,见图2。各个混合比例曲线按比例递进顺序依次排列,均能很好地区分,形成单一的扩增峰,无非特异性产物干扰峰形成。结果显示,本实验具有良好的重复性、扩增效率及良好的线性关系,可做基因分型的半定量检测。

注:A为熔解曲线图;B为差异曲线图;C为标化熔解峰图。
3 讨 论
疟疾具有非常强的传播性,其对人类的危害不单单是局限在某一个地区或国家,而是关系到全人类的公共卫生问题[10]。疟原虫耐药性的产生和流行,更是对全球公共卫生工作提出了巨大的挑战[11]。目前,世界卫生组织确认性疟原虫K13基因突变与青蒿素耐药性相关,可以作为恶性疟原虫青蒿素耐药性的分子标志物。根据2019年世界卫生组织关于疟疾的ACT药物抵抗报告,PFK13基因的F446I、N458Y、Y493H、R539T、I543T、R561H、C580Y这7个突变已经被证实与青蒿素和其衍生物的抵抗有关,推荐其作为监控ACT药物抗性的分子标记。
目前,对恶性疟原虫青蒿素耐药相关基因SNP的检测方法比较多,常见的有Sanger测序法[12]、PCR-限制性片段长度多态性分析技术(RFLP)[13]、环介导等温扩增技术(LAMP)联合纳米孔测序技术[14]及突变扩增系统(ARMS)结合实时荧光定量PCR等[15]。然而这些方法由于需要昂贵的仪器、严格标准的实验环境、昂贵的费用,以及实验方法操作繁琐,耗时长等原因,限制了它们用于高疟区大量临床标本的快速诊断。
HRM分析技术是一种快速而有效的基因突变检测技术,升温过程中双链DNA开始变性解离,嵌合在其中的饱和荧光染料逐渐释放,荧光强度随着变弱。系统通过荧光强度变化与时间的关系绘制出熔解曲线。不同位点基因型会产生不同的熔解曲线峰形,因此HRM能够有效区分。目前,临床已经开发了几种复杂的PCR-HRM方法用于从临床标本中检测疟原虫,但鲜见用于检测恶性疟原虫青蒿素耐药性相关基因突变。
本研究基于HRM非标记探针基因分型技术,建立了针对世界卫生组织推荐的已经验证的青蒿素耐药相关的突变C580Y的检测方法。相对于其他分子诊断方法,此方法检测灵敏度高,操作简便快速,成本低,反应通量大,结果准确,可以满足临床标本的检测,并且实现了真正的闭管操作,减少实验室污染的机会,是理想的检测方法,可用于疫情地区大批量人群筛查。同时,该实验方法可作为突变的半定量检查,用于耐药性疟原虫水平的粗略估算,可更好地指导临床用药。研究中笔者发现,应用梯度PCR对实验体系和反应条件进行优化,本实验上、下游引物之间5∶1的比例是最适合的;探针可被设计成与野生型或突变型互补,探针的设计应该将突变位点尽量置于中间,在应用非标记探针时,退火温度确定在60 ℃左右最合适,否则会产生非特异熔解峰而影响判读结果。本研究将对实验继续优化和改良,提高实验灵敏度和特异性,将该方法应用到其他耐药相关基因检测中。
