α-MnO2/SnO2复合电极材料的制备及其电化学性能
2021-07-20韩曰朋曾啸雄赵晨鹏谈国强
夏 傲,韩曰朋,曾啸雄,赵晨鹏,谈国强
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
当前,能量储存装置已无处不在.锂离子电池因循环寿命长、能量密度大、自放电率低、无记忆效应等优点,已成为新型能源领域的研究热点[1].负极材料作为锂离子电池的核心结构之一,对锂离子电池性能有着重要影响.目前商品锂离子电池的主要负极材料为石墨化碳,其理论比容量仅为372 mAh·g-1,并且循环稳定性差、大电流密度下容量快速衰减,高倍率快速充电时在活性碳颗粒表面易生成锂镀层,甚至形成锂枝晶引发安全问题[2].因此,寻求高比容量的非碳基材料来替代商业化的碳基材料是目前的主要研究方向.
过渡金属氧化物作为负极材料具有众多优点.MnO2作为其中的一种,其理论比容量高达1 232 mAh·g-1,该比容量不仅远高于碳材料,而且也高于其他许多过渡金属氧化物,例如[3]:Co3O4(890 mAh·g-1)、CuO(673 mAh·g-1)、Fe2O3(1 007 mAh·g-1)、Fe3O4(924 mAh·g-1)、NiO(718 mAh·g-1)、ZnO(978 mAh·g-1)等,为开发大容量的锂电负极材料提供了可能.同时,MnO2放电平台(~0.40 V)[4,5]较低,且明显低于其他过渡金属氧化物,例如[6-8]:Fe2O3(0.7~0.9 V)、Co3O4(~0.6 V)、CuO(~0.9 V)等,低的放电平台有助于提高电池整体的电压和功率.
但MnO2为半导体材料,导电性较差,电导率仅为10-6~10-5S/cm[9],不利于电荷传递.并且由于泰勒效应,循环过程中会发生体积变化致使循环稳定性减弱[10].一维管状结构由于自身中空的特点以及其在无序的堆积状态下会产生额外的空隙,能够缓解体积变化带来的相关应变[11].在MnO2的α、β、γ、δ、λ等多种晶型中α-MnO2具有由[MnO6]双链构成的[2×2]的一维管状隧道结构,[2×2]的孔道直径(4.6 Å)较大,不仅有利于缓解体积变化带来的应变,而且便于碱金属离子的脱嵌,使 H+、Na+、K+等在α-MnO2中的扩散容易发生,离子扩散性能好.并且在电极表面和内部都可进行赝电容反应.
针对MnO2导电性差的问题,研究者们提出很多改善方案,例如制备超薄MnO2纳米管[12],空心海胆装MnO2纳米球[13],从而缩短离子、电子的扩散距离.另一方面通过与导电性能良好的第二相材料复合提升导电性能.SnO2的本征导电性优于MnO2,而且理论比容量高(790 mAh·g-1),储量丰富,价格低廉,环境友好.将两者进行复合能够形成异质结构[14],更利于导电性能的提升.
Yang等[15]通过水热的方式将SnO2纳米棒生长在α-MnO2表面,在0.1 A·g-1的电流密度下,经过50个循环后剩余比容量为436.7 mAh·g-1,而纯相MnO2的剩余比容量仅为165 mAh·g-1,电化学性能明显提升.Pan等[16]通过超声混合的方式将水热法制备的SnO2纳米线与湿化学法制备的MnO2纳米片混合形成夹层结构,充分利用MnO2纳米片富有弹性的特点与SnO2良好导电性之间的协同作用获得优异的电化学性能,在0.1 A·g-1的电流密度下,经过200个循环后剩余比容量达到862 mAh·g-1.Dai等[17]利用湿化学的方式制备了用于超级电容器的SnO2包裹MnO2纳米棒的复合材料,利用SnO2良好导电性提升了电化学性能.本文通过烧结的方式将SnO2纳米粒子生长在α-MnO2表面,对样品进行结构和性能分析,探究不同复合比例对结构和电化学性能的影响,探索最佳复合比例.
1 实验部分
1.1 极材料的制备
1.1.1α-MnO2的制备
将0.264 g KMnO4分散于30 mL去离子水中,并滴加0.5 mL浓HCl,利用磁力搅拌器充分搅拌,搅拌均匀后将溶液转移至50 mL聚四氟乙烯水热釜中,在140 ℃下反应12 h.自然冷却至室温后,用去离子水和乙醇交替洗涤若干次,离心收集沉淀,将沉淀置于烘箱中,在70 ℃下干燥12 h,收集得到纳米管状α-MnO2.
1.1.2α-MnO2/SnO2的制备
将2 mmolα-MnO2以及SnCl2·2H2O(Sn/Mn摩尔比为5%、10%、15%、20%)分散于乙醇与去离子水体积比为1∶1的混合溶剂中,搅拌5 h,蒸发溶剂,将收集到的粉体置于坩埚中,在400 ℃下烧结2 h,待冷却至室温后,收集α-MnO2/SnO2粉体.五个比例的样品分别标记为M/S-0、M/S-5、M/S-10、M/S-15、M/S-20.
1.2 电池的制备
按照7∶2∶1的质量比称取活性物质、导电炭黑、PVDF,置于研钵中充分研磨,均匀后滴加N-甲基吡咯烷酮,研磨至具有一定稠度后,将浆料倒在吸附在涂布机上的铜箔上,将其平整均匀地涂敷在铜箔上,而后将其转移至真空干燥箱中,在70 ℃下干燥12 h.烘干后进行冲压得到直径为16 mm的电极片,活性物质负载量大约为1 mg/cm2.将其作为正极,将锂片作为负极,以聚丙纤维为隔膜,LiPF6有机溶剂作为电解液,在充满氩气的手套箱中进行CR2032扣式电池的组装,组装好后静置24 h,进行电化学性能测试.
1.3 表征测试与性能测试
利用X射线衍射仪(XRD,D/max2200PC,日本理学株式会社)对不同复合比例的α-MnO2/SnO2样品进行物相定性分析,利用场发射扫面电子显微镜(SU8100,日本HITACHI公司)对不同复合比例的α-MnO2/SnO2样品进行微观结构分析.恒流充放电性能测试由蓝电电池测试系统CT2001A(5V10mA8CT)完成.循环伏安测试(CV,0~3 V,0.1 mV·s-1)以及电化学阻抗测试(EIS,0.001~100 000 Hz)由电化学工作站(CHI 660E)完成.
2 结果与讨论
2.1 α-MnO2/SnO2结构与形貌分析
图1为M/S-0、M/S-5、M/S-10、M/S-15、M/S-20样品的XRD图谱.从图1可以看出,五个复合比例的α-MnO2/SnO2样品中的MnO2的衍射峰均指向α-MnO2(JCPDS NO.72-1982)PDF卡片,复合样品中的SnO2衍射峰均指向金红石型SnO2(JCPDS NO.41-1445)PDF卡片,并且随着复合比例的增加,衍射峰的强度有所增加.
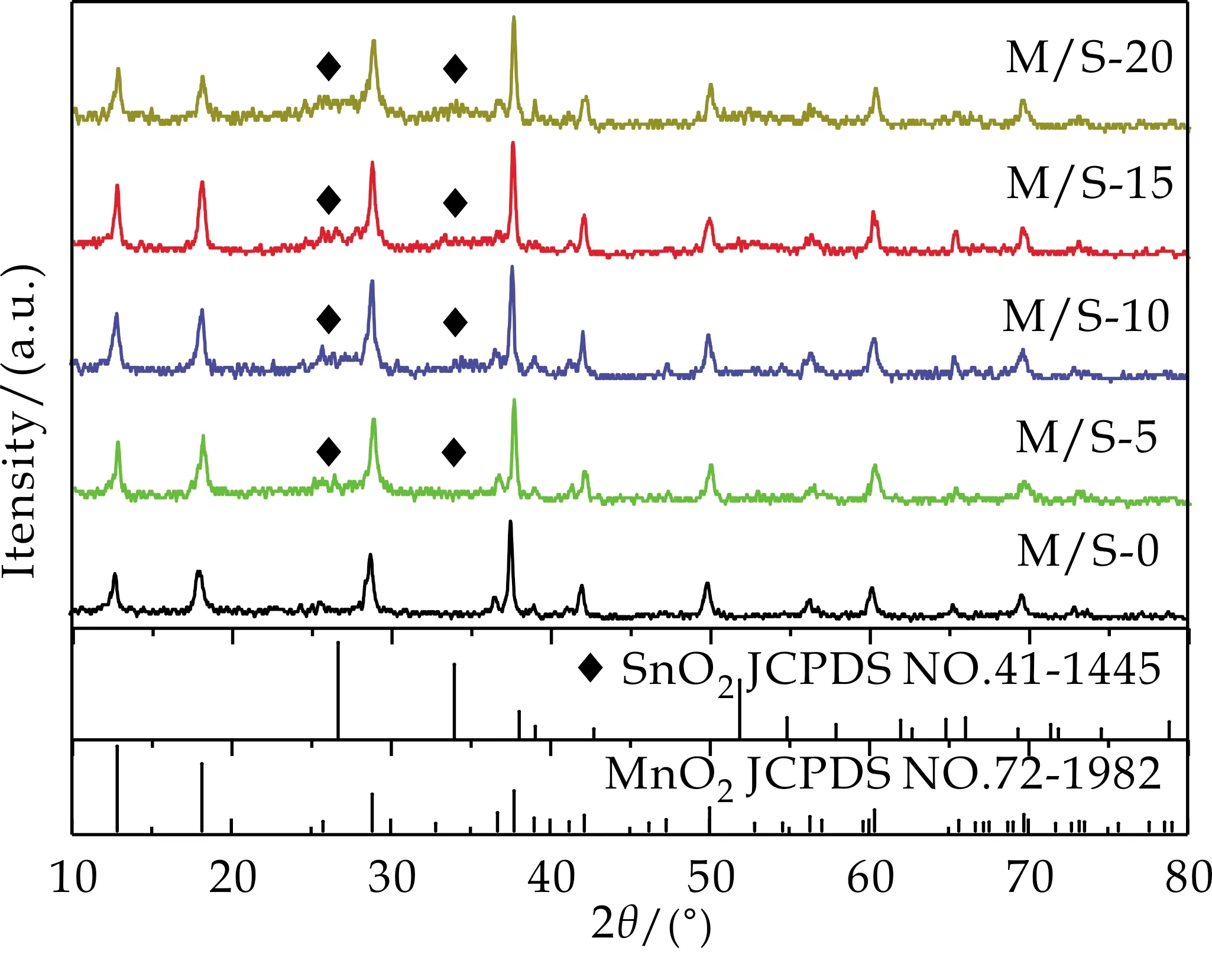
图1 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20样品的XRD图
图2为M/S-0、M/S-5、M/S-10、M/S-15、M/S-20样品的SEM图以及M/S-15样品的元素分布图以及元素的相对含量.从图2可以看出,M/S-0为纳米管状结构,形貌较为均一,管径为50~60 nm,长度约为2μm,表面光滑干净.从图2(a)中的插图可以看出α-MnO2的端侧为开口状态,提供了更大的比表面积,更多的活性位点.图2(b)、(c)、(d)、(e)分别为M/S-5、M/S-10、M/S-15、M/S-20样品的SEM图,从图中可以看出除M/S-20样品有轻微的团聚外,其他比例没有出现团聚的现象.但从复合样品表面形貌可以看出α-MnO2复合SnO2后表面变为粗糙的状态,并且随着复合量的增加,粗糙程度有所增加.图2(f)中M/S-15的SEM-EDS mapping图中Sn元素并不明显,可能是由于M/S-15表面SnO2含量较少且α-MnO2的端侧为开口状态,部分SnO2生长在α-MnO2管体内部[18],导致SEM-EDS mapping图中Sn元素不明显,但从M/S-15的EDS测试中的元素质量比可以看出Sn的质量比达到18.1%(如图3所示).

(a)M/S-0 SEM(b)M/S-5 SEM(c)M/S-10 SEM(d)M/S-15 SEM(e)M/S-20 SEM(f)M/S-15的SEM-EDS mapping图
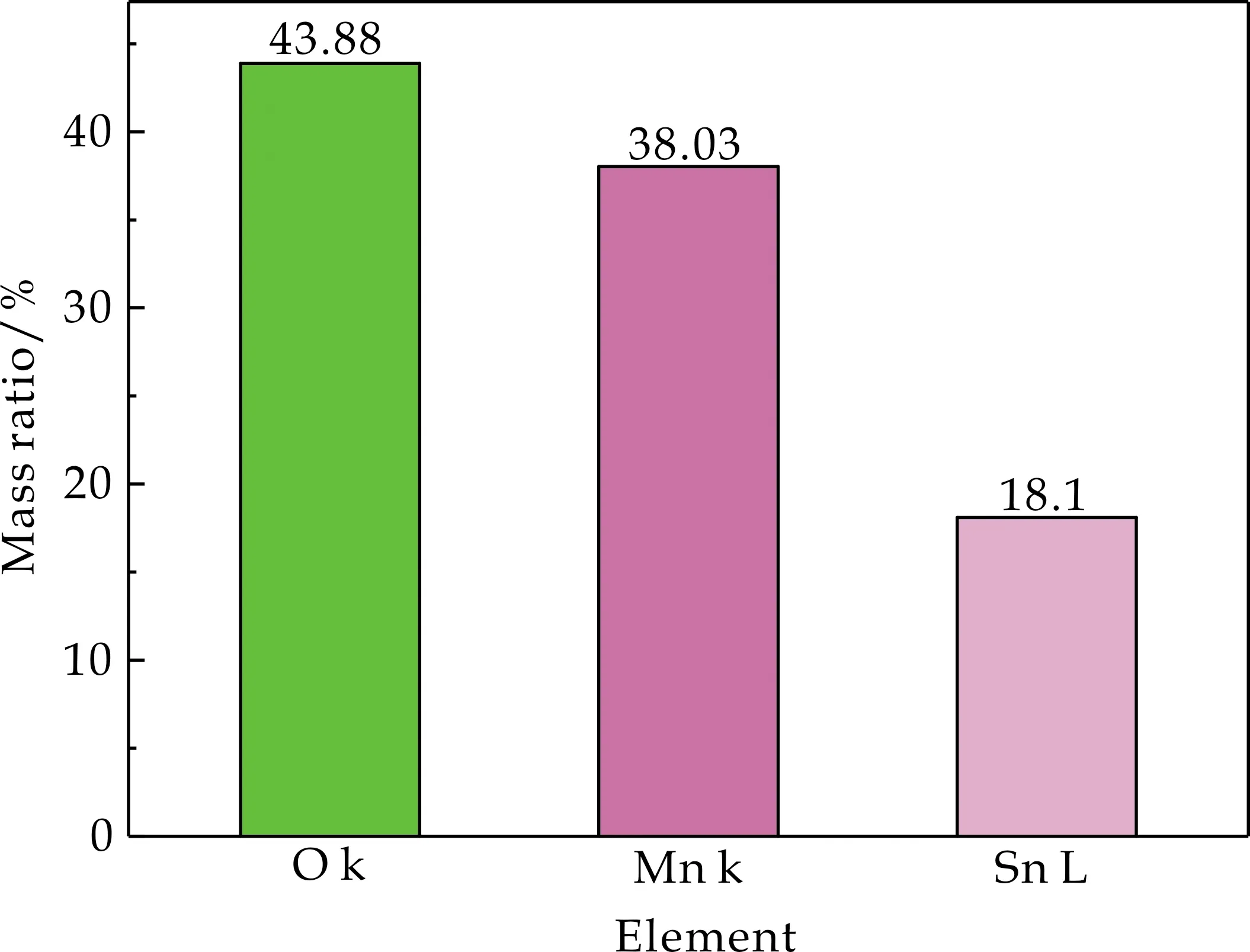
图3 M/S-15的EDS测试中各元素的质量比
2.2 α-MnO2/SnO2电化学性能分析
采用循环伏安法对电极进行电化学性能测试,了解充放电过程中电化学变化状态,图4显示了各个复合比例的α-MnO2/SnO2样品的首圈CV曲线.对于α-MnO2(M/S-0)来说,在放电过程中0.32 V处的峰是由于形成SEI膜和α-MnO2与Li+发生还原反应造成的[19,20].在充电过程中1.21 V处的氧化峰归因于Li2O与Mn纳米粒子可逆反应的结果.Mn单质具有较高的电化学活性,能使Li2O可逆的转化为Li+[21].α-MnO2(M/S-0)充放电过程中发生的反应式可总结为:
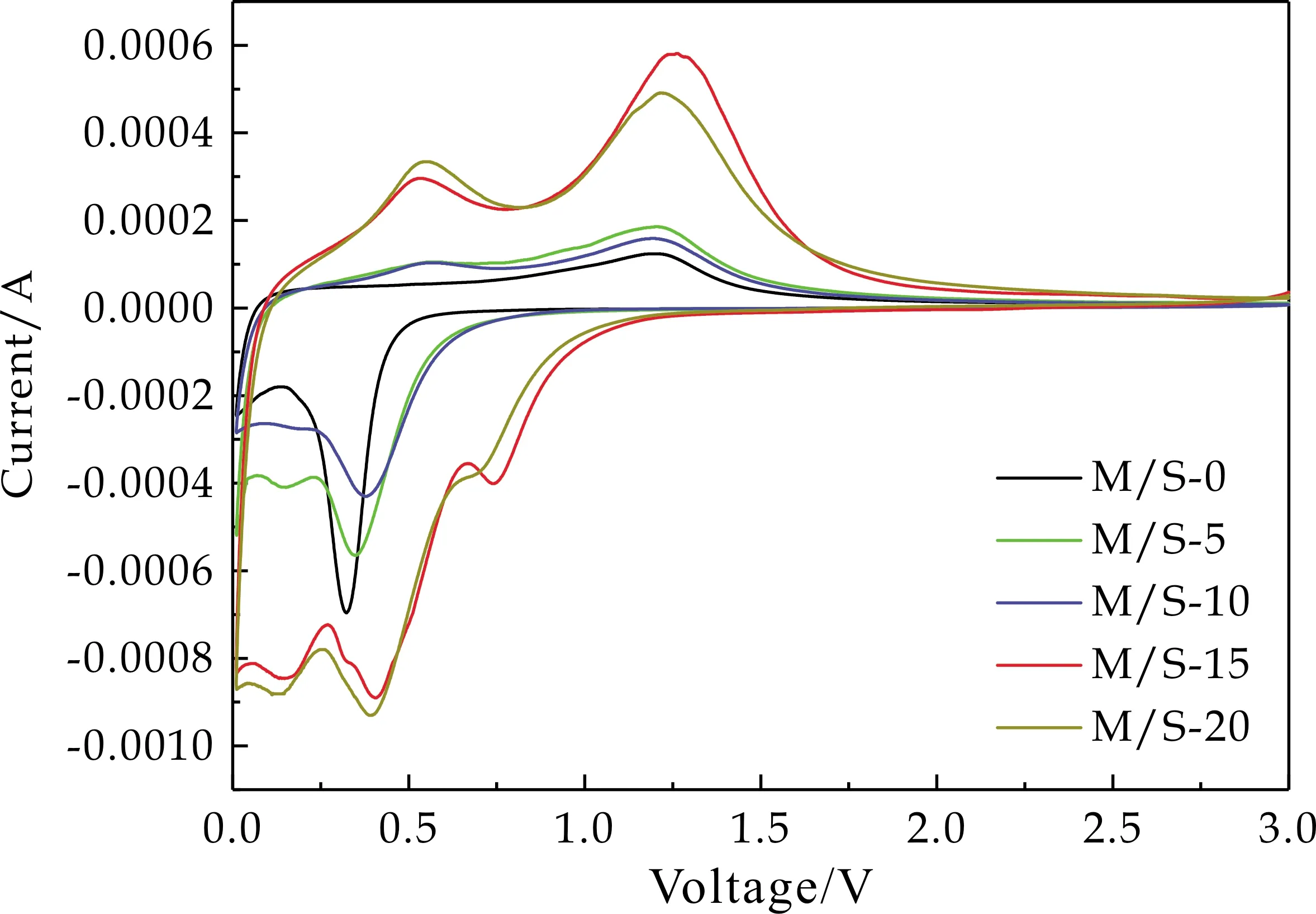
图4 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20的CV曲线

(1)
对于α-MnO2/SnO2来说,放电过程中0.74 V和0.15 V处的还原峰是由SnO2的还原(反应式(2))和LixSn的形成(反应式(3))造成的[22].在充电过程中0.54 V和1.26 V处的氧化峰可归因于LixSn的可逆分解(反应3)和Li2O与Mn单质的反应(反应式(1))[15,18],α-MnO2/SnO2在1.26 V处的氧化峰明显宽于α-MnO2的,这是由于不可逆反应式(2)提供了额外的Li2O与Mn单质发生反应[18].α-MnO2/SnO2充放电过程中发生的反应:

(2)

(3)
并且从图中可以清楚地看出,复合SnO2的样品CV曲线的面积明显要大于M/S-0的面积,其中M/S-15的CV曲线面积最大,表明其初始容量最大.
图5为M/S-0、M/S-5、M/S-10、M/S-15、M/S-20在0.1 A·g-1下的首次充放电曲线.从图5可以看出各样品的充放电平台与CV曲线氧化还原峰相对应.M/S-0、M/S-5、M/S-10、M/S-15、M/S-20的放电比容量分别为1 158.5 mAh·g-1、1 143 mAh·g-1、1 235.3 mAh·g-1、1 241 mAh·g-1和1 265.8 mAh·g-1,充电比容量分别为365.5 mAh·g-1、411 mAh·g-1、519.7 mAh·g-1、563.7 mAh·g-1和548.1 mAh·g-1,库伦效率分别为31.54%、35.95%、42.07%、45.42%和43.30%.可以看出复合SnO2后库伦效率和比容量均有所提高,其中M/S-15提升最大.结果与CV曲线得出的结论一致.

图5 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20的首次充放电曲线
为了对比不同复合比例样品的循环稳定性,将这五个样品分别在0.2 A·g-1和1 A·g-1的电流密度下测试循环性能,其结果如图6、图7所示.

图6 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20在0.2 A·g-1下的循环性能图

图7 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20在1 A·g-1下的循环性能图
从图6可以看出,在0.2 A·g-1的电流密度下,经过50个循环,M/S-0、M/S-5、M/S-10、M/S-15、M/S-20的剩余比容量分别为155.8 mAh·g-1、162.1 mAh·g-1、224.7 mAh·g-1、323.1 mAh·g-1和215.7 mAh·g-1.M/S-15电极剩余比容量明显高于其他样品.从图7同样可以看出,M/S-15循环性能最好,在1 A·g-1的电流密度下,经过300个循环,M/S-15剩余比容量为125.8 mAh·g-1,高于M/S-0(84.1 mAh·g-1),M/S-5(81.7 mAh·g-1),M/S-10(111.6 mAh·g-1)和M/S-20(51.7 mAh·g-1).表明M/S-15循环性能最好.
图8为M/S-0、M/S-5、M/S-10、M/S-15、M/S-20五个样品在0.1 A·g-1,0.2 A·g-1,0.5 A·g-1,1 A·g-1,2 A·g-1和0.1 A·g-1的电流密度下的倍率性能图.从图8可以看出,M/S-15在0.1 A·g-1,0.2 A·g-1,0.5 A·g-1,1 A·g-1和2 A·g-1的电流密度下的比容量均高于其他复合比例的样品,提供的平均比容量分别为567.69 mAh·g-1,414.41 mAh·g-1,293.98 mAh·g-1,230.45 mAh·g-1和175.29 mAh·g-1当电流密度快速恢复到0.1 A·g-1时,其平均比容量依然保持388.05 mAh·g-1,优于其他复合比例的样品.表明M/S-15样品倍率性能最佳.

图8 M/S-0、M/S-5、M/S-10、M/S-15、M/S-20的倍率性能图
为进一步探究复合SnO2对电极材料的动力学影响,对其进行了EIS测试,M/S-0和M/S-15样品的EIS图如图9所示,二者均由高频区的半圆和低频区的斜线组成,半圆弧的直径大小代表这电荷转移阻抗Rct的大小,二者之间成正比.插图为所所组装电池的等效电路模型,Rs为溶液阻抗,通过模拟电路拟合出M/S-0的Rs为2.823 Ω,Rct为222.4 Ω;M/S-15的Rs为3.791 Ω,Rct为78.16 Ω,表明M/S-15样品的导电性能明显增加.M/S-15导电性增加的原因可能是由于MnO2和SnO2能带结构不同,两种具有不同带隙的电化学活性物质结合处非均相界面形成的异质结可以增强反应界面动力,促进电荷转移,进而增强导电性能.Wang等[23]通过理论计算证明了异质结构可以极大地提升电极反应动力学和电化学性能.
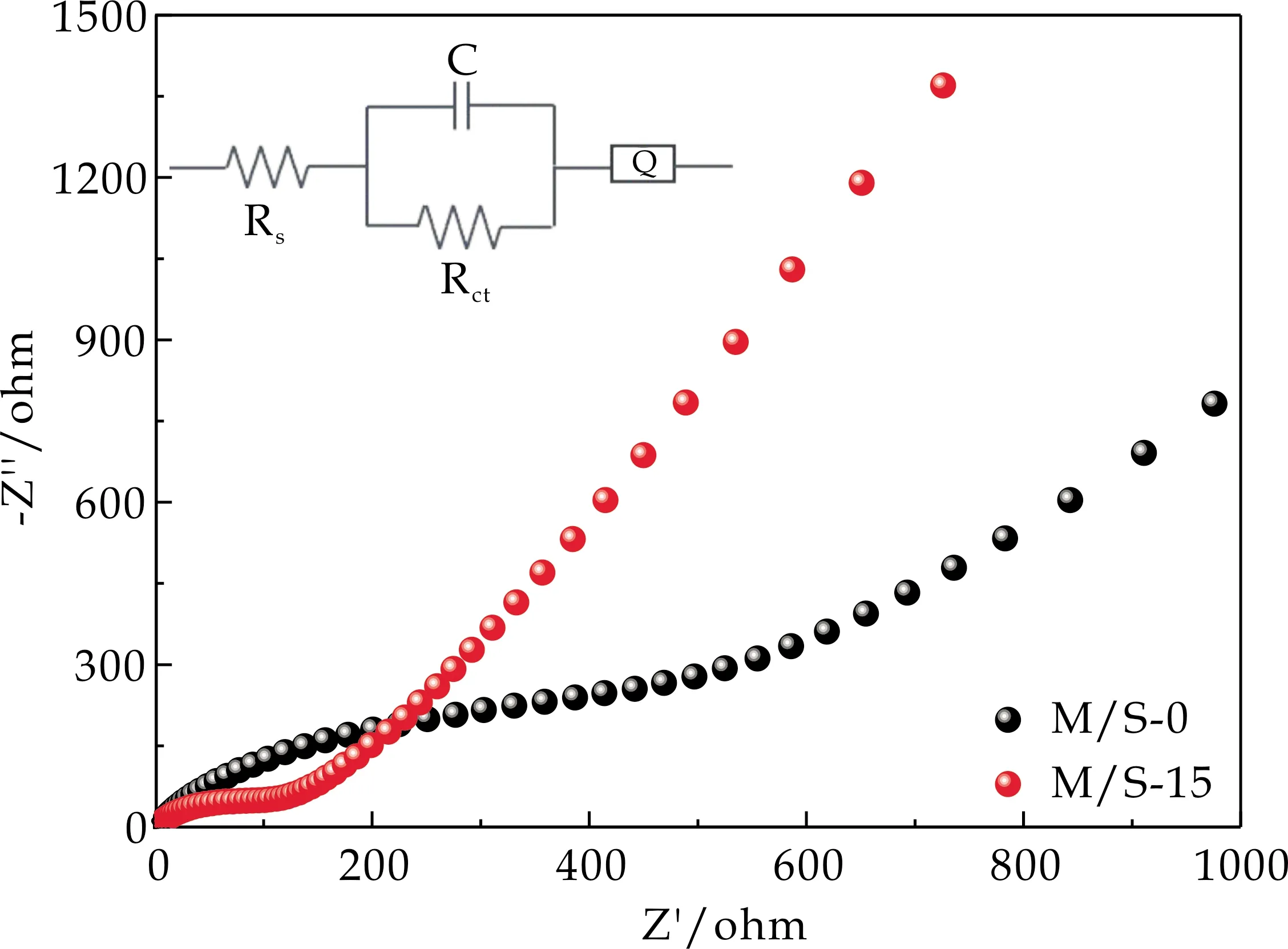
图9 M/S-0、M/S-15的EIS图及等效电路图
此外,可由公式(4)求出图10中Z′与ω-1/2在低频区的拟合曲线的斜率(阻抗因子σ),结合公式(5)计算出锂离子扩散系数,来评估锂离子在电极材料中扩散的快慢.
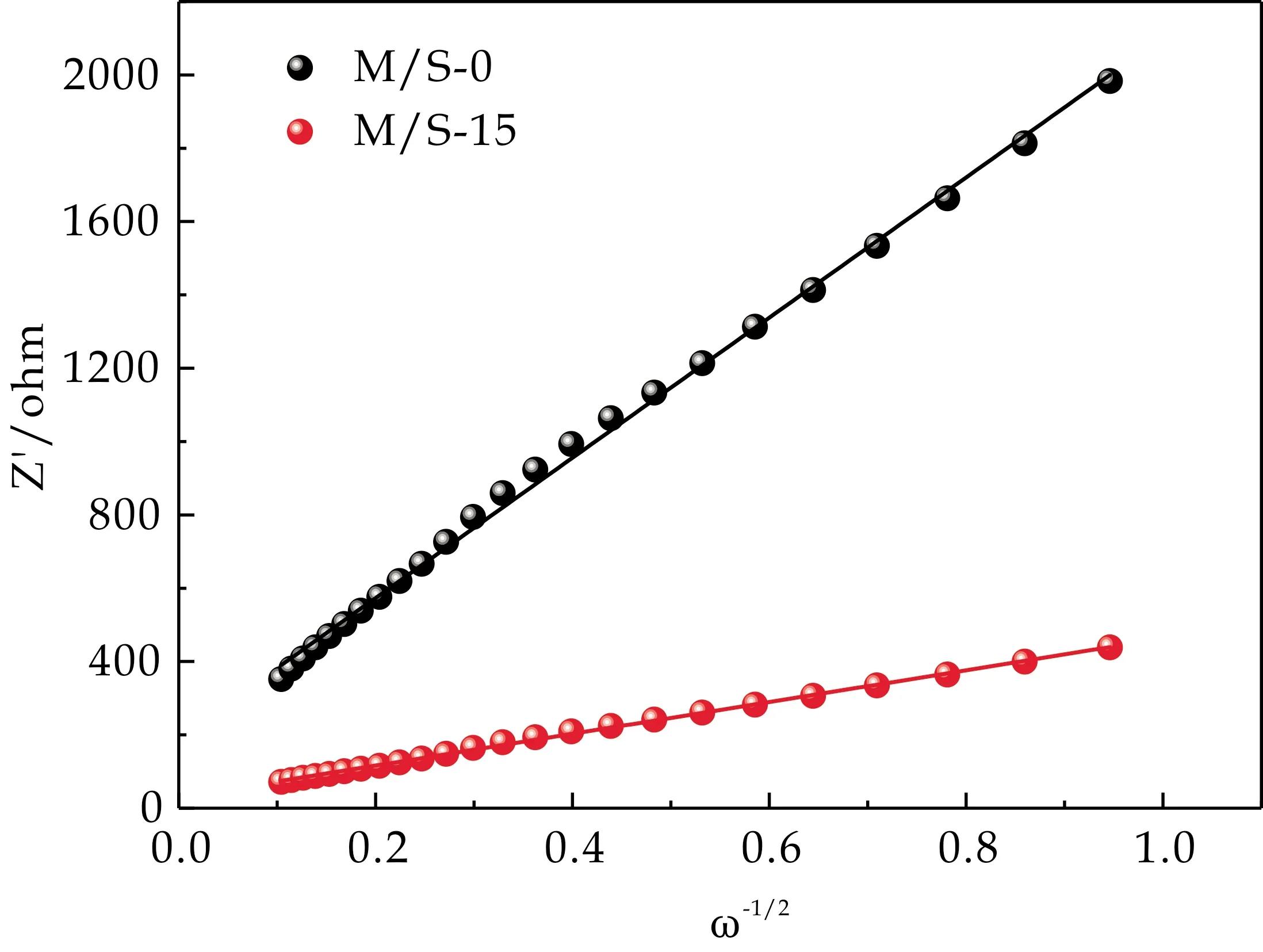
图10 Z′与ω-1/2在低频区的拟合曲线
Z′=Rs+Rct+σω-1/2
(4)
D=R2T2/2A2n4F4C2σ2
(5)
式(5)中:R代表气体常数(8.314 J·mol-1·K-1);T代表绝对温度(298 K);A代表电极片的面积;n代表每摩尔电极材料转移的电荷数;F代表法拉第常数(96 500 C·mol-1);C代表锂离子的摩尔浓度;σ代表阻抗因子.计算数据如表1所示.M/S-15的锂离子扩散系数为1.76×10-22cm2·s-1,高于M/S-0的0.91×10-23cm2·s-1,由此可知锂离子在M/S-15中的扩散更快.

表1 M/S-0和M/S-15的阻抗因子及扩散系数
MnO2/SnO2电化学性能优于MnO2可能是由于以下原因:MnO2与SnO2形成异质结构在促进电极-溶液界面电荷转移方面起着重要作用,并且SnO2的导电性优于MnO2,处在表面的SnO2能有效、快速地将电子存储、释放和传递给MnO2,促进MnO2发生氧化还原反应.并且SnO2氧化还原反应所产生的多个离子和电子参与电化学循环,可以诱导更高的电容量,同时复合SnO2后材料表面变为粗糙状态,增大了比表面积,与电解液接触面积增大.但是SnO2的理论比容量低于MnO2,SnO2粒子过量增加会占用MnO2过多的活性位点,导致MnO2/SnO2比电容降低,这与Feng等[24]的观点一致.所以SnO2占MnO2的15%时,MnO2与SnO2协同作用发挥到最佳状态,且SnO2粒子不会占用过多的MnO2的活性位点,进而获得最佳的电化学性能.
为进一步探究α-MnO2/SnO2复合电极的电荷储存方式,对M/S-15进行了0.1 至1 mV·s-1的CV测试,其结果如图11所示.
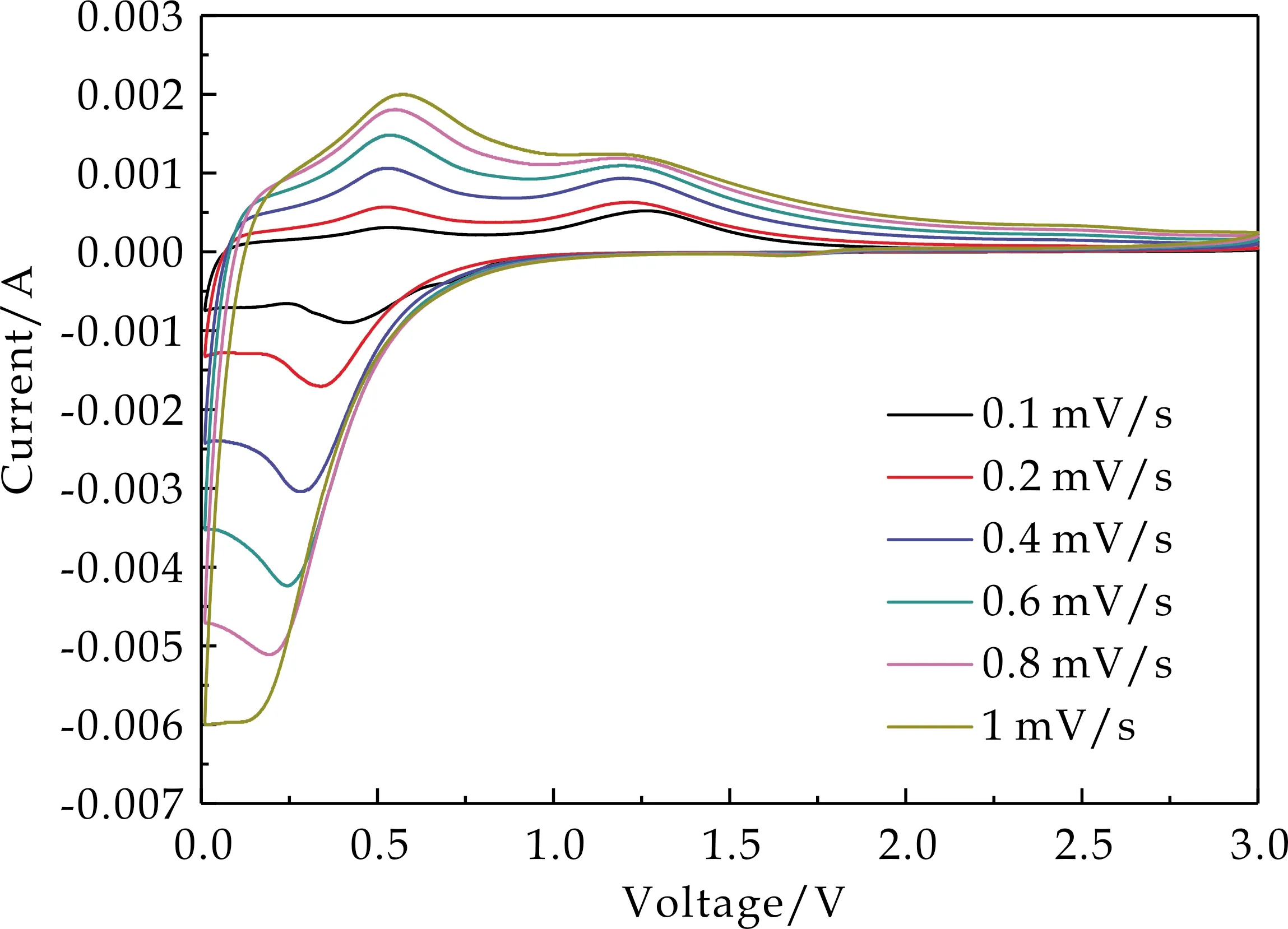
图11 M/S-0、M/S-15不同扫速的CV曲线
通常电极在工作过程中有两种类型的电荷存储模式同时参与,如公式(8)所示,其中k1v代表了表面电容效应控制的电荷存储贡献的电流,k2v1/2代表了离子扩散控制的电荷存储贡献的电流.根据Augustyn 等[25]的研究,电容效应的贡献可以用公式(6)推导出的公式(7)进行定性分析.
i=avb
(6)
logi=loga+blogv
(7)
i(V)=k1v+k2v1/2
(8)
式(6)中:a、b为可变参数,i为扫描速率为v时所得到的峰值电流大小.b的值由logv-logi图的斜率所确定.当b的值接近0.5时,以扩散控制的电荷存储为主.当b的值接近1时,以表面电容效应控制的电荷存储为主.从图12可以看出,还原过程中得到的b值为0.824,氧化过程中得到的b值为0.62,表明M/S-15复合电极呈现的电荷存储行为是扩散控制的电荷存储和表面电容效应控制的电荷存储共同参与的电荷存储行为方式.
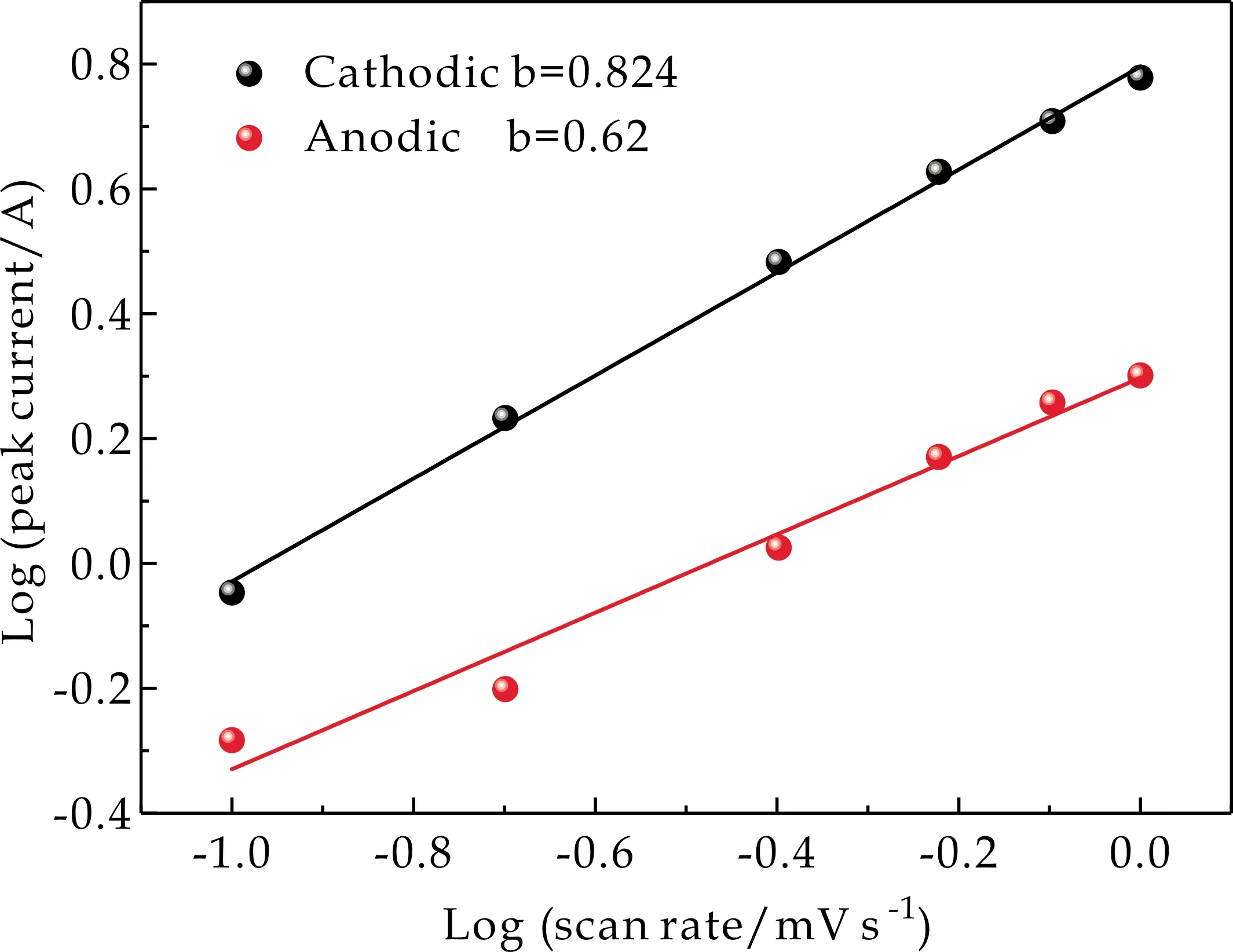
图12 M/S-15电流与扫速的幂次关系图
根据公式(8)计算可得出在不同扫速下两者之间的电流贡献比,如图13所示.在0.1 mV·s-1,0.2 mV·s-1,0.4 mV·s-1,0.6 mV·s-1,0.8 mV·s-1和1 mV·s-1的扫描速率下表面电容效应控制的电荷存储贡献的电流占比分别为38.87%、50.30%、58.63%、66.17%、77.73%和88.50%,离子扩散控制的电荷存储贡献的电流占比分别为61.13%、49.7%、41.37%、33.83%、22.27%和11.50%.从图13可以看出,随着扫速的增加,表面电容效应控制的电荷存储贡献随之增加,而离子扩散控制的电荷存储贡献随之减少.得出的结论与b计算结果得到的结论一致,M/S-15复合电极提供的电荷存储是扩散控制的电荷存储和表面电容效应控制的电荷存储共同参与得到的结果.
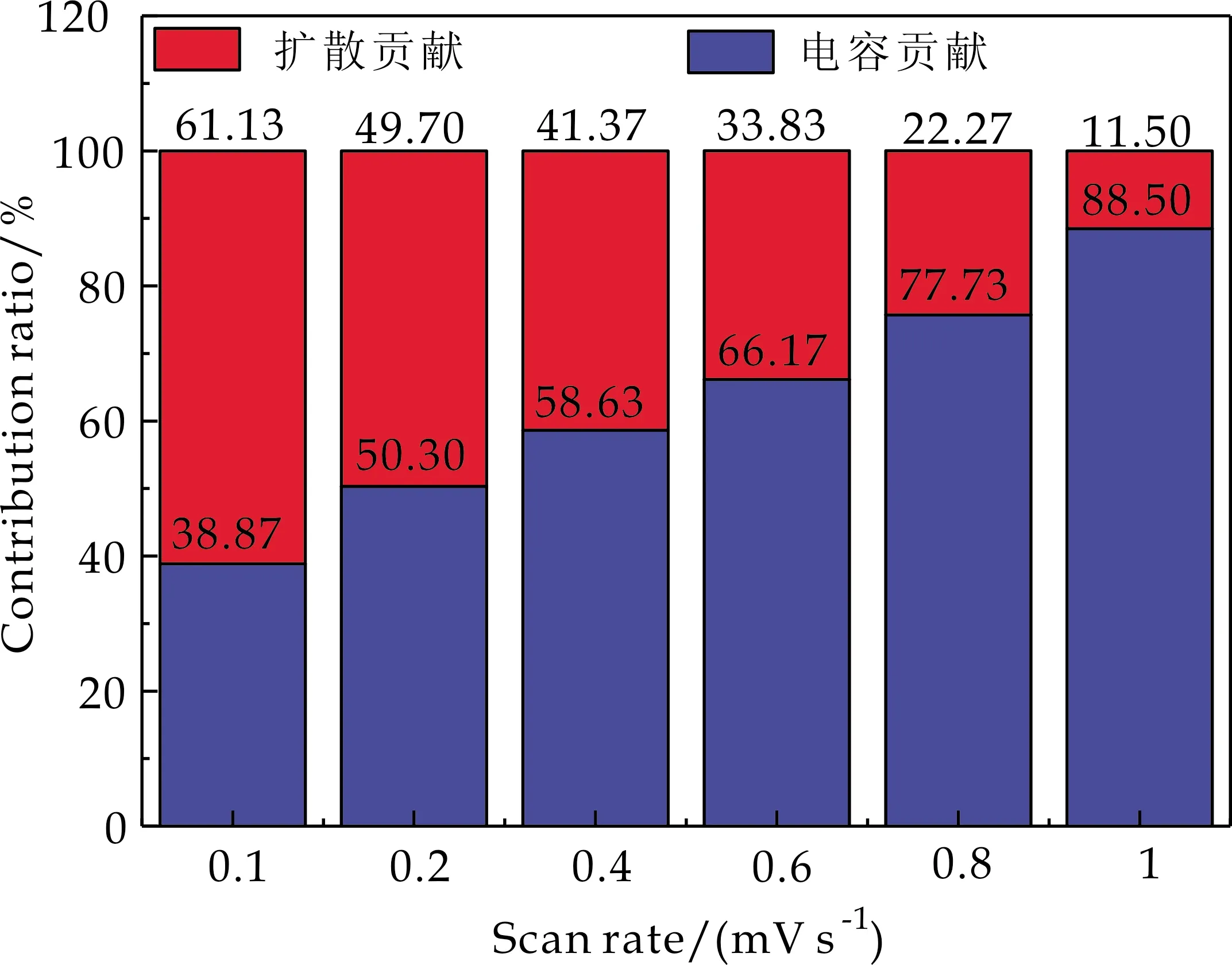
图13 不同扫速下扩散贡献容量与电容贡献容量的百分比
M/S-15的良好性能主要由于α-MnO2的一维中空管状结构提供了大的比表面积,有利于表面电容反应的发生,以及SnO2与MnO2形成异质结构提供了良好的导电性能促进了离子扩散,进而得到了良好的电化学性能.
3 结论
本文采用水热方式制备出了α-MnO2,再通过烧结将SnO2纳米颗粒生长α-MnO2表面,结果表明当SnO2复合量达到15%时,α-MnO2/SnO2复合材料的各项电化学性能达到最佳,其首次充电比容量达到563.7 mAh·g-1,库伦效率最高达到45.42%,在0.2 A·g-1的电流密度下,经过50个循环后剩余比容量达到323.1 mAh·g-1,在1 A·g-1的电流密度下,经过300个循环后剩余比容量达到125.8 mAh·g-1.电化学阻抗测试表明复合15%的SnO2后电荷转移阻抗由纯相的112 Ω减小到46.5 Ω,导电能力明显提升.由此说明复合SnO2可以作为一种改性手段来提升MnO2导电性能,进而提升电化学性能.
