牛磺酸对胰岛素抵抗HepG2细胞氧化应激的保护作用及机制研究*
2021-07-19曹志龙李德龙陈冰婷苏比努尔巴克马晓丽
曹志龙,李德龙,陈冰婷,苏比努尔·巴克,马晓丽△
(1.武警兵团总队医院,新疆 乌鲁木齐 830063;2.新疆医科大学药学院,新疆 乌鲁木齐 830011)
2型糖尿病等代谢性疾病是仅次于心、脑血管病和癌症的世界性重大疾病。胰岛素抵抗(IR)是导致2型糖尿病的主要病理基础[1]。目前,氧化应激的“二次打击”学说已占据IR研究的核心地位[2]。氧化应激能进一步加重IR,是2型糖尿病及其并发症产生的病理之一[3-4]。因此,探究IR和氧化应激作用机制,发现更高效的具有抗氧化、减轻IR的物质为2型糖尿病前期IR的预防提供一个崭新的方法和思路。目前,合理的营养干预是国内外公认的预防和控制糖尿病的重要举措[5]。牛磺酸又称为β-氨基乙磺酸,具有很强的抗氧化活性,可有效清除体内大部分氧自由基,具有抑制脂质过氧化反应、降低组织氧耗等诸多作用[6]。Keap1-Nrf2通路是目前研究氧化应激的热点[7]。本研究在HepG2细胞IR模型中给予不同质量浓度牛磺酸,通过检测细胞存活率、评估氧化应激指标,以及Keap1-Nrf2通路关键因子的mRNA表达水平的测定,分析了牛磺酸对IR-HepG2细胞的氧化损伤保护作用及可能机制,旨在为牛磺酸改善糖尿病IR提供理论依据。
1 材料与方法
1.1材料
1.1.1实验细胞 HepG2人肝癌细胞株来源于凯基生物,细胞培养条件为MEM 培养基、10%胎牛血清联合1%PS,以及37 ℃、5%二氧化碳(CO2)、饱和湿度。
1.1.2仪器与试剂 Smart Cell HF-90 CO2细胞培养箱(上海力康仪器有限公司)、TGL-16GB台式低速离心机(上海飞鸽仪器有限公司)、DNP-9272恒温箱(上海精宏实验设备有限公司)、DHG型恒温鼓风干燥箱(上海精宏实验设备有限公司)、Eclipse TS100-F荧光倒置显微镜(日本尼康公司)、xMarkTM酶标仪(Bio-Rad公司)、恒温水浴锅、K5500核酸蛋白定量仪(北京凯奥公司)、2500凝胶成像系统(上海天能公司)、实时定量聚合酶链反应(PCR)系统(美国ABI公司)、胎牛血清(FND500,Excell Bio)、杜氏改良Eagle培养基(KGM41500-500,凯基生物)、青霉素-链霉素双抗(10 000 U,SC30010,GIBCO)、CCK8 试剂(FC101-03,北京全式金生物)、二甲基亚砜(D2650,美国SIGMA公司)、棕榈酸(P0500,美国SIGMA公司)、牛磺酸(T-0625,美国SIGMA公司)、丙二醛(MDA)试剂盒(A003-4,南京建成)、超氧化物歧化酶(SOD)试剂盒(A001-3,南京建成)、活性氧(ROS)试剂盒(E004,南京建成)、葡萄糖试剂盒(361500,上海荣盛生物药业有限公司)等。
1.2方法
1.2.1HepG2细胞培养 将解冻后的细胞快速加入至15 mL离心管中,离心弃上清液,将细胞接种到培养瓶中,加入10%胎牛血清、1%双抗的杜氏改良Eagle培养基的完全培养基,37 ℃、饱和湿度、5%CO2细胞培养箱中培养。取生长状态良好汇合率达90%的HepG2细胞,胰酶消化细胞后用完全培养基制备成5×104cells/mL单细胞悬液,每24小时接种至96孔板中(每孔100 μL,5个复孔),置于培养箱中37 ℃孵育用于实验。
1.2.2建立HepG2细胞IR模型 取生长状态良好汇合率达90%的HepG2细胞胰酶消化细胞后用完全培养基制备成5×104cells/mL单细胞悬液,接种至6孔板中(每孔2 mL,即每孔1×105cells);HepG2细胞正常培养贴壁后换用无血清MEM培养基添加1%牛血清清蛋白(BSA)和0.5 mmol/L棕榈酸培养基培养24 h,建立IR细胞模型。
1.2.3CCK8检测HepG2细胞增殖 取生长状态良好汇合率达90%的HepG2细胞胰酶消化细胞后用完全培养基制备成5×104cells/mL单细胞悬液,接种至96孔板中(每孔2 mL,即每孔5×103cells),37 ℃、5%CO2培养24 h 贴壁后弃上清液,加入100 μL无血清MEM培养基添加1%BSA、0.5 mmol/L棕榈酸配制的不同质量浓度(10、100、500、2 000、5 000 μg/mL)的牛磺酸溶液,每组5个重复,放入培养箱37 ℃、5%CO2培养24 h后弃上清液,每孔加入10%CCK8 100 μL,在细胞培养箱中继续培养2 h;采用酶标仪测定450 nm处的吸光度(OD)值,取均值并绘制生长曲线。
1.2.4分组与葡萄糖含量检测 将HepG2细胞分为空白对照组(加不含血清含1%BSA的MEM培养基)、模型组(加不含血清含1%BSA、0.5 mmol/L棕榈酸的MEM培养基)、10 μg/mL牛磺酸组(加不含血清含1%BSA、0.5 mmol/L棕榈酸、10 μg/mL牛磺酸溶液的MEM培养基)、100 μg/mL牛磺酸组(加不含血清含1%BSA、0.5 mmol/L棕榈酸、100 μg/mL牛磺酸溶液的MEM培养基)和500 μg/mL牛磺酸组(加不含血清含1%BSA、0.5 mmol/L棕榈酸、500 μg/mL牛磺酸溶液的MEM培养基)。每组5个重复,37 ℃干预24 h。弃掉旧的细胞培养基,每孔加入100 μL含1×10-9mol/L胰岛素的无血清MEM培养基培养3 h。收集每孔细胞上清液,检测葡萄糖含量。取10 μL细胞培养上清液、10 μL蒸馏水、10 μL葡萄糖标准品分别与1 000 μL工作液充分混匀置于37 ℃水浴15 min。显色后在2 h内用酶标仪测定505 nm处的OD值,根据所得的OD值计算葡萄糖含量[(样本OD值-空白OD值)/(标准OD值-空白OD值)]×标准品质量浓度。
1.2.5ROS、MDA、SOD检测 按1.2.4项方法,收集细胞上清液用于SOD检测,分别消化收集细胞用于ROS和MDA检测。按MDA、ROS、SOD试剂盒说明书操作,测定各指标,计算结果。
1.2.6半定量逆转录PCR检测Nrf2、Keap1、血红素氧合酶1(HO-1)、醌氧化还原酶(NQO1)mRNA的表达 按1.2.4项方法,弃上清液,用磷酸盐缓冲液洗涤贴壁细胞2次,加入1 mL Trizol裂解细胞,15 min后移至1.5 mL氯化聚氯乙烯管中,用于半定量逆转录PCR检测。各引物列表见表1。采用Trizol法提取总RNA,反转录成第一链cDNA,荧光定量PCR程序见表2。进行荧光定量分析后采用绝对定量法计算mRNA的表达量。
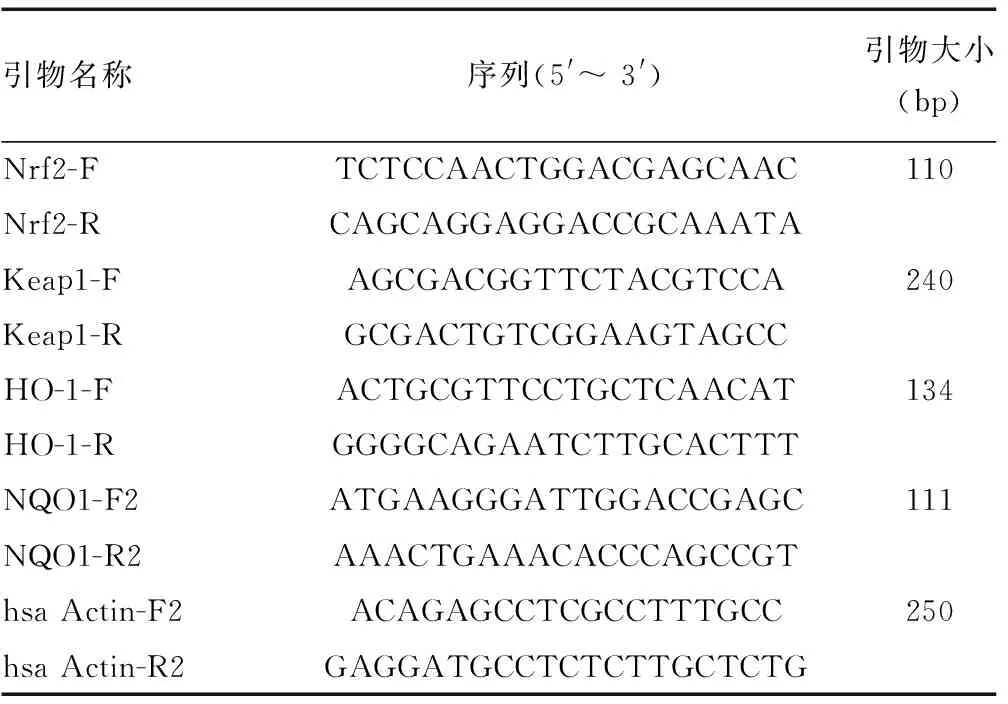
表1 荧光定量引物信息表

表2 荧光定量PCR程序
2 结 果
2.1不同质量浓度牛磺酸对HepG2细胞株干预24 h后的作用结果比较 使用0~5 000 μg/mL质量浓度对牛磺酸干预后细胞存活率的OD值均接近1.0。见图1。表明药物对细胞增殖无显著影响。干预剂量在5 000 μg/mL时细胞存活率有所下降,最终考察了10、100、500 μg/mL对HepG2细胞IR状态的调节作用。
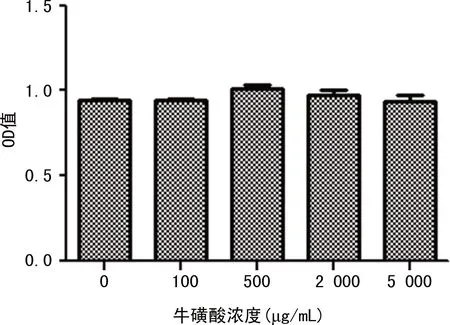
图1 不同质量浓度牛磺酸对HepG2细胞株干预24 h后作用结果比较
2.2牛磺酸对IR-HepG2细胞糖消耗的影响 模型组细胞糖消耗量[(3.867±0.226)mmol/L]明显低于空白对照组[(5.330±0.126)mmol/L],差异有统计学意义(P<0.05),说明建模成功。与模型组比较,10、100、500 μg/mL牛磺酸均能不同程度促进 HepG2 细胞糖消耗[分别为(4.455±0.055)、(4.342±0.204)、(4.940±0.205)mmol/L],差异均有统计学意义(P<0.05)。
2.3牛磺酸对IR-HepG2细胞ROS、MDA水平,以及SOD活性的影响 与空白对照组比较,模型组细胞ROS、MDA 水平明显升高,差异有统计学意义(P<0.05);SOD活性降低,但差异无统计学意义(P>0.05)。与模型组比较,10、100、500 μg/mL牛磺酸组细胞ROS水平均明显降低,100、500 μg/mL牛磺酸组细胞MDA水平均明显降低,500 μg/mL牛磺酸组细胞SOD水平明显升高,差异均有统计学意义(P<0.05)。见表3。
表3 牛磺酸对IR-HepG2细胞ROS、MDA水平及SOD活性的影响
2.4牛磺酸对Nrf2-Keap1通路中关键因子mRNA表达的影响 与空白对照组比较,模型组细胞Keap1 mRNA表达明显升高,HO-1、NQO1 mRNA表达明显降低,差异均有统计学意义(P<0.05);Nrf2 mRNA表达降低,但差异无统计学意义(P>0.05)。与模型组比较,100、500 μg/mL牛磺酸组细胞Keap1 mRNA表达明显降低,Nrf2、HO-1、NQO1 mRNA表达均明显升高,差异均有统计学意义(P<0.05)。见表4、图2。

表4 牛磺酸对Nrf2-Keap1通路中关键因子mRNA表达的影响
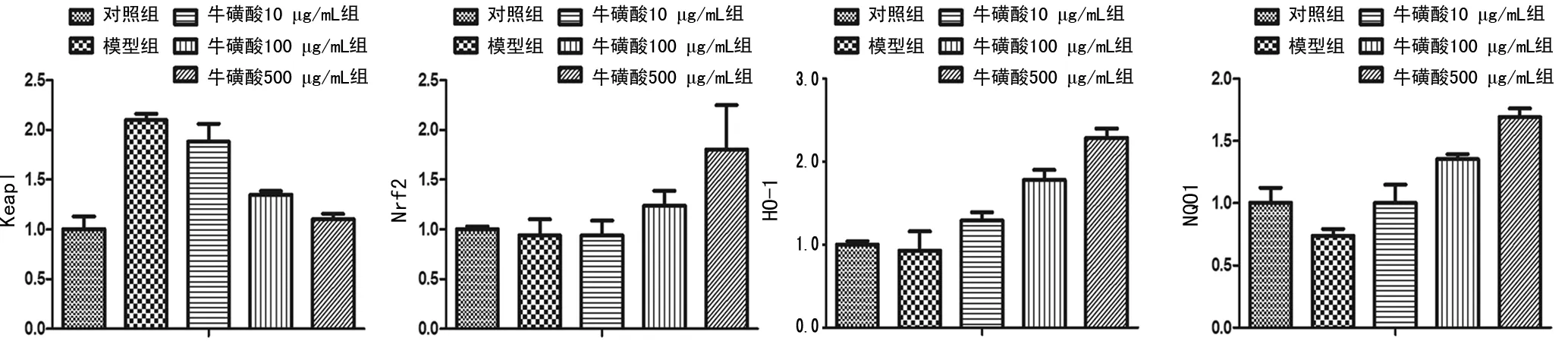
图2 牛磺酸对Nrf2-Keap1通路中关键因子mRNA表达的影响(n=3)
3 讨 论
本研究建立了棕榈酸诱导的 HepG2 细胞产生IR[8],通过不同质量浓度棕榈酸干预不同时间,通过葡萄糖消耗最终确定0.5 mmol/L棕榈酸诱导细胞24 h可成功建立IR细胞模型。通过CCK8预实验确定了牛磺酸干预的3个剂量组,分别为10、100、500 μg/mL,通过检测各组葡萄糖消耗量、ROS水平初步评价了牛磺酸对IR细胞模型糖代谢及氧消耗的影响。结果显示,牛磺酸干预前模型组细胞葡萄糖消耗明显降低,牛磺酸干预后各剂量组均能提高葡萄糖的消耗量及ROS水平,表明牛磺酸可明显改善细胞模型的糖代谢紊乱情况。
近年来,氧化应激损伤越来越多地被证明与IR密切相关,过多的氧自由基可促发机体进一步产生IR[9-10]。MDA、SOD均是机体发生氧化应激损伤的标志性指标[11]。MDA 作为脂质过氧化最重要的产物之一,可反映体内脂质过氧化程度,间接反映细胞氧化损伤程度;而体内的抗氧化系统,如SOD等则能减少氧自由基对细胞的损伤,其活性高低反映机体的抗氧化能力。IR会导致细胞内无氧酵解过程增强,发生糖代谢障碍,而细胞内持续高糖状态又会进一步导致脂质代谢产物生成增加,加重代谢紊乱。本研究对细胞水平SOD、MDA的研究结果显示,在有效质量浓度范围内,不同质量浓度牛磺酸组对细胞存活率无显著影响。模型组细胞MDA水平增高,SOD活性下降,说明IR细胞模型会产生氧化应激失衡,而给予牛磺酸干预后细胞水平的氧化应激损伤得到改善,尤其500 μg/mL牛磺酸能显著降低细胞MDA水平,升高SOD活力,说明牛磺酸能纠正细胞的糖代谢紊乱,改善氧化应激损伤从而减轻IR。
Keap1-Nrf2信号通路是近年来抗氧化研究领域的热点,以Keap1-Nrf2信号通路介导多种抗氧化基因和Ⅱ相解毒酶的转录,被认为是抗氧化机制中最重要的通路[12-13]。当细胞暴露于ROS时可引起细胞骨架相关性抑制蛋白的修饰(如磷酸化),从而使Keap1-Nrf2复合体解离,Nrf2由细胞质转位到细胞核,与受其调控的抗氧化酶基因的抗氧化反应元件结合,从而增加抗氧化蛋白水平,促进细胞存活。因此,激活Keap1-Nrf2信号通路、减少ROS的产生可改善氧化应激,而HO-1、NQO1是Nrf2调控氧化应激的主要酶类靶基因[14-15]。本研究结果显示,HepG2细胞发生IR时Keap1 mRNA 水平明显升高,而Nrf2 mRNA水平明显降低,说明IR模型成立后细胞水平的Keap1-Nrf2信号通路发生了解离,而牛磺酸干预后各靶基因的异常表达明显改善。通过进一步检测HO-1、NQO1 mRNA表达,结果也显示出干预后这2个靶基因表达明显升高,说明牛磺酸可明显干预Keap1-Nrf2信号通路。
综上所述,牛磺酸可能通过降低细胞内ROS水平、提升细胞内抗氧化酶的活性减少自由基对细胞的损伤,增加细胞的抗氧化功能,减轻细胞的氧化应激,从而减轻IR。其作用机制可能是通过调节Keap1-Nrf2通路相关基因的表达从而实现其对细胞IR的调控作用。
