低温胁迫下不同温敏性油菜保护酶活性及内源激素变化
2021-07-19马学才方彦刘丽君马骊曾瑞朱明川王亚林牛早霞李学才孙万仓李爱国武军艳
马学才,方彦,刘丽君,马骊,曾瑞,朱明川,王亚林,牛早霞,李学才,孙万仓,李爱国,武军艳
(1.甘肃农业大学农学院,甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.河北省农林科学院旱作农业研究所,河北 衡水 053000)
油菜是我国第一大油料作物,产油量占国产油料作物产油量的55%左右,是国产植物油第一大油源,油菜产业的发展对于保障国家粮油安全,具有重大的意义[1].随着全球气候的变化,作物新品种的育成,推广布局结构在逐渐变化,油菜的种植区划也逐年向北移动[2].世界范围内的极端温度在很多地区出现,且这一现象逐年增多,致使寒冷灾害对作物的生长及最终产量形成产生重要影响[3].在我国北方,低温是作物生长不良以及产量不高的重要原因之一.因此,增强油菜抵抗严寒的能力来保障其产量显得尤为重要[3-5].
低温条件下,植物生长活力下降,通过保护性酶活性和内源激素含量的变化调控生理反应,维系植株的生长[6].植物叶片在低温胁迫下,保护性酶发挥作用,而超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是公认的细胞膜保护酶,在理论上就存在相关性[6].脱落酸(absoisic acid,ABA)是传导和使抗冷的DNA分子转录成蛋白质的传播信息分子,可以借助提高保护酶的高效运行与无机盐的量的恒定,降低低温对叶片的损伤,提高较冷温度当下叶片里叶绿素的储存及光能的化学作用,使其更容易生长出根,特别是根的横向变粗,降低冬天的油菜死亡率,提高其耐低温性能[7-9].在低温胁迫下,植物为了适应寒冷的环境,生长素(auxin,IAA)含量会发生相应的变化,如低温胁迫后鹿蹄草的内源IAA含量会逐渐降低[10].赤霉素(gibberellin,GA)能够促进植物茎节的伸长生长,从而促进植物的生长,在植物逆境胁迫等各种生理现象中扮演重要的角色[11-12].本研究以3个温敏性不同的油菜品种为材料,低温处理后测定其根、生长点以及叶片中ABA、IAA、GA的含量,根及叶片保护酶活性.分析了短时低温胁迫下不同温敏性油菜各组织生理活性物质和内源激素含量的变化规律,得出这种变化的差异与抗寒性的关系,为油菜应答低温生长的机理研究提供理论依据.
1 材料与方法
1.1 试验材料
试验材料如表1,图1所示。

图1 陇油6号,天油4号,陇油10号生长点特性
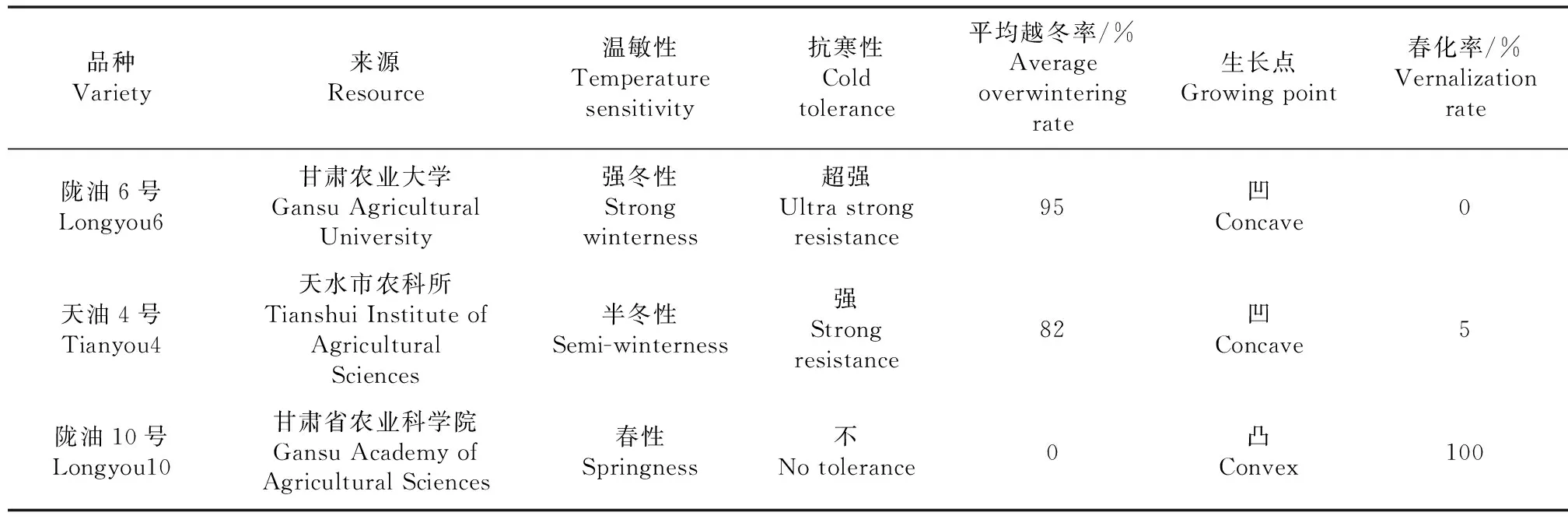
表1 试验材料特征及来源
1.2 试验设计及方法
2019年10月中旬种植于甘肃农业大学(N 36°5′,E 103°4′),种子经培养皿萌发后挑选播种于营养钵中,每盆4株,放置于室内,每天浇适量的水,待油菜幼苗长至5~6片真叶时置于人工气候箱进行低温(4℃)处理,日光照10 h,模拟苗期低温环境,每个处理3盆.处理后0(CK)、2、4、6、8、12、24、48 h分别取心叶外第3片功能叶、生长点及根系放到冰盒中立即进行内源激素的测定;用处理0(CK),LT1(24 h),LT2(48 h)的根和叶片进行生理活性物质的测定.采用酶联免疫吸附(ELISA)[13]法测定内源激素的含量,分别采用氮蓝四唑法、紫外吸收法、愈创木酚法、紫外吸收法测定SOD、CAT、POD、APX的酶活性[14].
1.3 数据分析
利用SPSS及Excel进行数据及作图分析.
2 结果与分析
2.1 低温胁迫下不同品种根系、叶片的生理指标分析
低温处理后,各品种根、叶保护性酶活性变强,冬性的品种比抗寒性弱的保护性酶活性高,且同一时间段下都达到了显著水平(P<0.05)(图2~3).与CK相比,SOD和POD变化趋势和增长率相近,根系叶片均表现持续增加的变化趋势.在感受低温的过程中,CAT的变化呈升高趋势,陇油6号较天油4号,陇油10号CAT活性高,根系含量高于叶片.APX活性随着低温处理时间的延长,呈现逐渐升高,根系增幅率高于叶片,3个品种根系APX活性增长率高,至LT2时,与CK相比分别增长了3.46倍,3.12倍.2.99倍;与此相比,3个品种叶片APX活性只增长了0.90倍,0.83倍,0.82倍.可见,在低温下冬性品种的四种酶活性响应较及时,根系变化更明显.
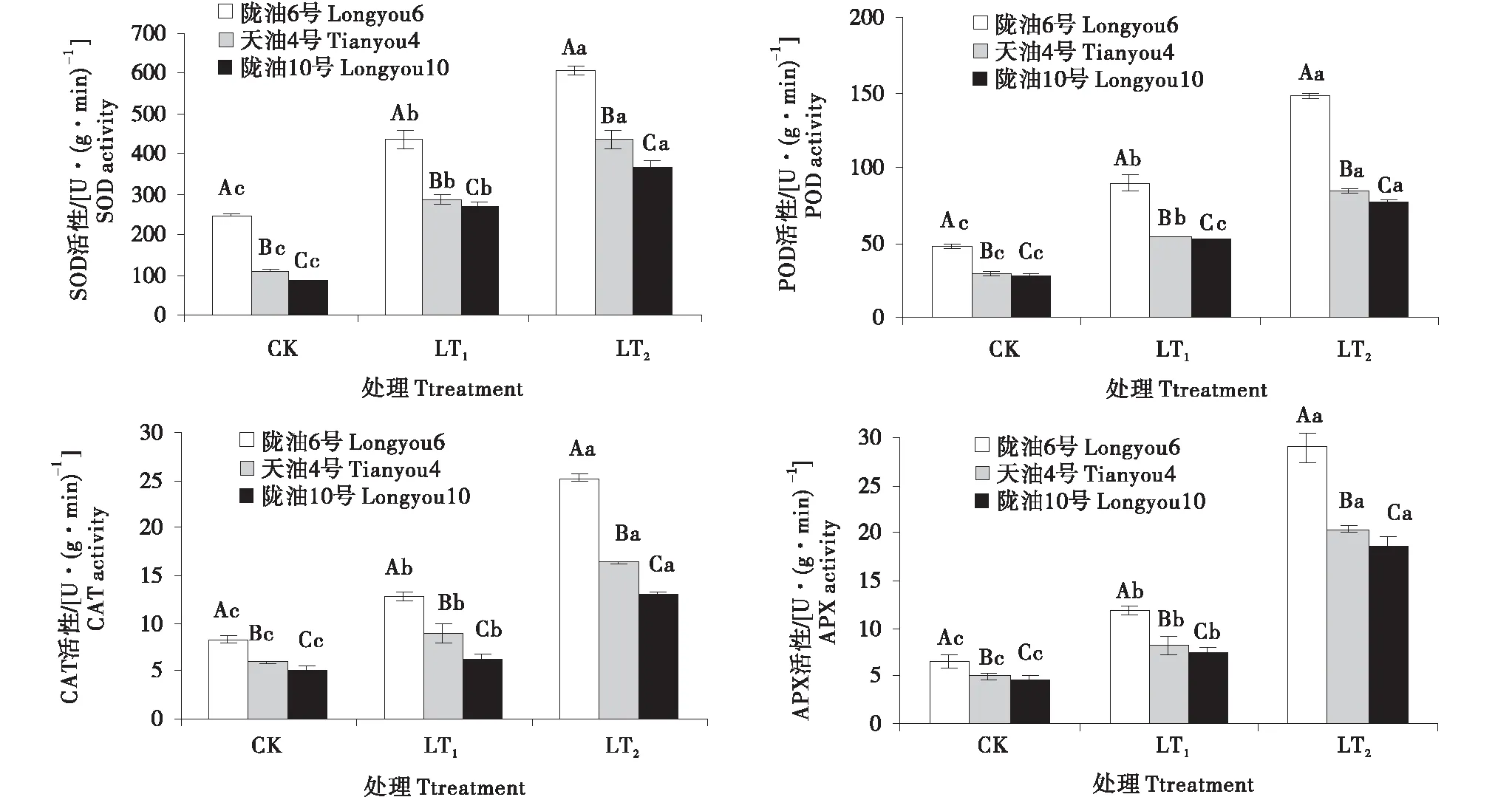
不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)
2.2 ABA含量的变化分析
在感受低温的过程中,不同品种ABA含量的变化不同(图4~6).在根系中,3个品种均呈先升高再降低的趋势,陇油10号在6 h达到峰值,陇油6号和天油4号在12 h达到峰值.生长点的结果表明,陇油6号、天油4号在处理2 h开始升高,陇油10号则逐渐升高,至处理48 h时高于对照(0 h),达到211.59 ng/g.在2~24 h,陇油6号的含量均高于天油4号和陇油10号(P≤0.05).叶片的含量表现为先短暂降低后逐渐升高,陇油10号在处理2 h之后逐渐升高,陇油6号、天油4号则在4 h后升高,可见,低温后春性品种的叶片反应更敏感,比冬性先做出出反应.从不同组织来看,冬性的生长点的ABA含量对低温的响应与春性不同.

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05).

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05).
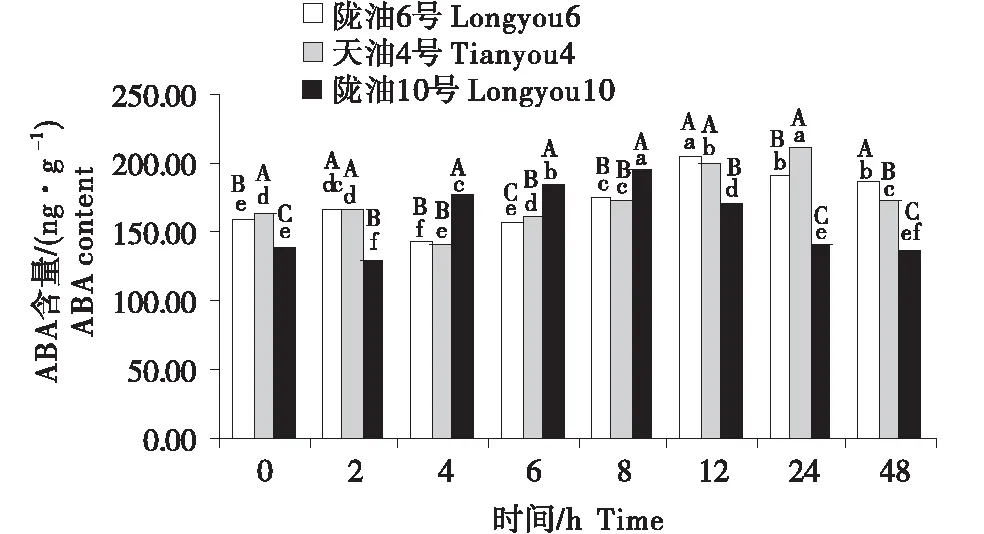
不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05).
2.3 IAA含量的变化分析
3个品种均表现为,叶片的IAA含量最高,根系次之,生长点最低(图7~9).在根系中,3个品种的变化均为先升高后降低;与天油4号相比,陇油6号升高幅度较大并在处理6 h达到峰值,陇油10号则在处理2 h达到峰值后降低.生长点和叶片的IAA变化趋势相似,陇油6号平缓上升,增幅稳定,天油4号和陇油10号为先升后降的趋势,且陇油10号的升高幅度和降低幅度均低于天油4号;低温6 h后冬性、半冬性品种的含量显著高于春性品种(P≤0.05).

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05).

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05).

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)
2.4 GA含量的变化分析
3个组织的含量变化为:生长点>叶>根.随着低温时间的延长,3个品种的根系的GA含量均表现为缓慢升高(图10~12).3个品种的生长点的含量先降低,至4 h后逐渐升高.低温胁迫后,与陇油10号相比,陇油6号、天油4号的变化更平稳,陇油10号变化幅度较大.由此推断,低温处理下,冬性品种GA含量的变化较小,春性品种变化较大,且春性品种的GA含量高于冬性品种.

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)

不同大写字母表示同一时间不同品种之间的显著差异(P<0.01),不同小写字母表示同一品种不同时间之间的显著差异(P<0.05)
2.5 内源激素的比值变化
随低温处理时间的延长各品种ABA、IAA、GA三者的比值较对照均有不同程度的变化;不同品种不同组织之间均有差异.3个品种各组织中ABA/IAA的比值最高,ABA/GA其次,IAA/GA最低.陇油6号、天油4号生长点的ABA/IAA、ABA/GA比值均高于根和叶片,根、生长点的ABA/IAA呈逐渐升高的趋势,陇油10号并未有这种趋势.随着处理时间的延长,3个品种的根的ABA/GA比值均降低.IAA/GA比值没有明显的变化趋势.
3 讨论
3.1 根系的酶活性的变化是不同感温性油菜低温生长的关键
SOD、POD、CAT、APX是植物遭受低温时保护性酶的典型代表,为了抵御低温,植物中的保护性酶通过相互配合共同协调来完成对自身的保护[15];低温逆境中SOD、POD、CAT、APX活性水平也是作为植物抗寒性检测的重要指标[16].研究表明,随着低温处理的持续,紫花苜宿保护性酶活性增加,抗寒性强的品种酶活增加的要快,抗寒性弱的品种酶活增加的慢[17].本研究结果表明,经过低温处理,叶片对低温敏感,叶片中几种酶的活性在感受到低温时会显著增加,发挥酶的保护作用.超强抗寒品种在低温胁迫下根中几种酶活性增加的迅速,不抗寒品种在低温胁迫下叶片中几种酶活性变化较为迟钝.说明抗寒性不同,品种油菜酶活性变化不同;根系是冬油菜低温生长和越冬的关键,其生理活性物活性高且变化强烈.
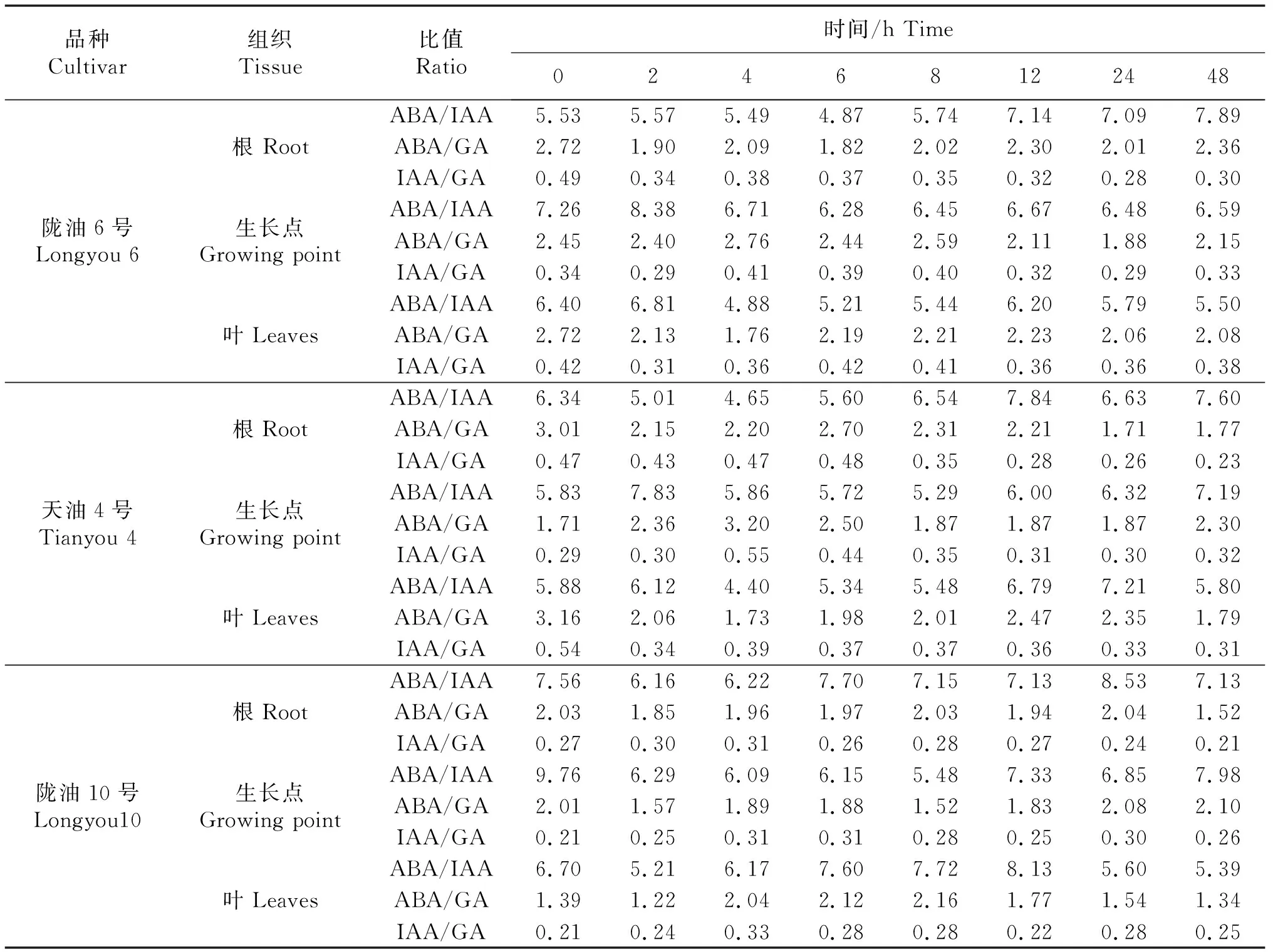
表2 低温条件下不同品种各组织内源激素比值
3.2 冬性品种的ABA积累量更高,激素之间的动态平衡更好
低温降低植物的生长活力,影响内源激素的产生和运输,使得植物的生理生化状态发生变化,从而影响逆境胁迫信息传递,诱发抗寒生理反应[14].调控内源激素的动态平衡是油菜适应逆境环境的关键[18].本研究表明,随低温处理时间的延长,ABA/IAA、ABA/GA比值升高,增加ABA的合成,同时适当减少IAA、GA的合成抵御低温;冬性强的品种ABA/IAA与ABA/GA的值均较高,ABA含量积累增多,IAA和GA的含量轻微降低,春性品种的积累速率及积累量均低于冬性品种,可见冬性、半冬性品种通过在较短的时间积累较多的ABA,缓解油菜所受的伤害,提高其抵御低温伤害的能力[19-23].小麦的研究结果也说明抗寒性强的品种IAA含量高于弱抗寒品种[24],田小霞等[25]结果表明低温会降低薰衣草的GA水平,使植株生长速度减慢,从而适应低温胁迫.
3.3 生长点的激素积累是保障强冬性油菜越冬的重要因素
不同组织在逆境对抗中扮演的角色不同,冬油菜由于具有适应低温的形态特性导致其更具抗寒力[26-27].冬油菜在越冬过程中,地上部全部干枯[28],只有根系存活于土壤中,次年新叶从其生长点重新长出(图10),完成生长,因此根系及生长点是其越冬生长的重要组织,也是其越冬后生长的启动点[29].本研究中在低温胁迫过程中冬性、半冬性品种的生长点的ABA含量均高于春性品种,且ABA/IAA、ABA/GA比值均高于根和叶片;冬性品种根系的ABA的含量变化最明显,呈上升趋势,春性则刚好相反.低温锻炼过程中,冬油菜叶片承受冷害能力强,春油菜叶片承受一定时期后,ABA、IAA、GA的合成减少,阻遏正常生长,这与陈奇[30]等的研究结果基本吻合.可见生长点的激素积累对强冬性白菜型油菜应答低温具有重要作用.抗寒性强的品种与抗寒性弱的品种生长点特性的不同,造成其内源激素富集比其它组织的要高,更能适应逆境.

图13 越冬前冬油菜叶片干枯,返青后心叶重新长出
4 结论
低温胁迫下,陇油6号、天油4号较陇油10号ABA积累量更高,GA和IAA含量更稳定,激素之间的相互作用更强且动态平衡更好,保护性酶活性水平更高.陇油6号、天油4号生长点对低温做出反应迅速且持续时间长,能耐受更长时间低温胁迫.
