低氧环境下甘肃鼢鼠延髓中c-Fos和HIF-1α的表达模式分析
2021-07-19戢爽陈志乔枫杨爱芳梁向平谢惠春
戢爽,陈志,乔枫,杨爱芳,梁向平,谢惠春
(青海师范大学生命科学学院,青海省青藏高原药用动植物资源重点实验室,青海 西宁 810008)
低氧作为一种应激因素,几乎影响机体所有的功能活动.在机体所有组织中,神经系统特别是大脑皮层,因没有氧储备而只能依赖于恒定、充足的氧供应,对低氧最为敏感,是机体各系统低氧反应的主导者.低氧环境下,动脉血氧分压低成为有效扩张脑血管和增加脑血流的重要调节因素.机体通过降低代谢即增加脑血流量等机制来代偿动脉血氧的减少.低氧可导致适度的血管收缩和血压升高,这些反应是由中枢神经系统的调节产生[1].位于中枢神经系统的延髓控制着呼吸、心率、血压等内脏活动,耗氧量高且无氧储,对低氧极为敏感[2],其可通过自身系统的调节来应对低氧协迫[3].这一过程可通过神经元活动标志物即刻早期基因c-Fos[4]和参与众多氧平衡调节的低氧诱导因子-1α(HIF-1α)[5]等在中枢神经系统的表达来反映.
c-Fos原癌基因属即早基因,正常生理状态在成年动物脑干极少表达或不表达,但各种中枢损害性刺激均可诱导其快速表达.因此,c-Fos表达可作为神经元是否参与刺激或伤害性信号传导的标志[6],可以定性分析神经元活动状态和显示脑活动部位与神经通路,c-Fos分布可显示参与某一神经活动的神经元.c-Fos作为神经元活动标志物,可以表达把外界信号转变为细胞内基因表达的刺激信号,对外界刺激做出应答,从而将细胞外短暂的刺激信号转换成长时程的细胞功能改变[6].
HIF-1是哺乳类O2动态平衡的主要调控因子[7-8],由HIF-1α和HIF-1β亚单位组成[7].HIF-1α是低氧诱导亚单位,其活性调控水平在转录[9]和转录后阶段[10].HIF-1α参与与有机体众多氧平衡调节有关的生理过程,与低氧诱导产生的特异应答密切相关,被认为是细胞间歇性慢性低氧反应所必需的核信号,在低氧诱导的基因调节中起关键作用.低氧刺激下,HIF-1α降解受阻使HIF-1表达增加,进而激活其对下游靶基因,启动了机体对缺氧的一系列适应机制,包括:促进组织缺氧后微循环的重建[11-15];改善组织缺氧后能量代谢障碍[16-22];作用于EPO而发挥组织保护作用[23-28];参与细胞凋亡的调控[29-32]等.
地下啮齿类,终生营地下洞穴生活,只能被动适应低氧浓度环境,在雨水多的季节,洞穴氧浓度甚至会更低,其对低氧的适应除了降低代谢效率,减少骨骼肌收缩等应对策略[33],更重要的是通过对细胞代谢及许多抗低氧因子诱导从分子水平上来适应低氧环境.甘肃鼢鼠(Myspalaxcansus)隶属啮齿目(Rodentia),鼢鼠亚科(Myospalacinae),鼢鼠属(Myspalax)[34],是我国黄土高原特有地下鼠,终生营地下洞穴生活.作为地下啮齿类代表性动物,甘肃鼢鼠能在各个层次上显示出良好的低氧适应机制,低氧能够诱导一系列特异性的与血管生成、能量代谢及肿瘤转移等密切相关的基因,帮助自身调节和适应低氧环境.
本研究以甘肃鼢鼠(Myspalaxcansus)和SD大鼠(Sprague-Dawwley)为试验对象,分别对甘肃鼢鼠、SD大鼠进行急性低氧应激4 h、间歇性慢性低氧15 d处理,分析比较两种动物延髓孤束核(NTS)、灰质(GC)及蓝斑核(LC)中c-Fos和HIF-1α的表达,同时分析了甘肃鼢鼠雌、雄对急性低氧和间歇性慢性低氧的差异性表现,以期为研究地下啮齿类动物低氧适应的中枢调节机制提供基础资料,也为未来低氧适应性药物的研发奠定基础.
1 材料与方法
1.1 试验动物
本研究所用甘肃鼢鼠于2019年5月捕自陕西省延安市,其中雌雄鼠各12只,体质量200~240 g,饲以胡萝卜.SD大鼠购于陕西省中医研究所,同样雌雄鼠各12只,体质量200~240 g,饲以鼠粮.两种动物均置于动物饲养箱内,以锯末作笼垫,棉花作巢材,室温(21±1)℃,光周期14L∶10D条件下饲养,适应3周后开始试验.
1.2 低氧模型制备与取材
1.2.1 低氧模型制备 将甘肃鼢鼠和SD大白鼠分别随机分为3组,每组雌雄各半.常氧对照组在正常氧浓度下进行培养;急性低氧组在氧浓度为6.5%的低氧舱内短暂培养4 h;间歇性慢性低氧组首先在氧浓度为14.1%的低氧舱内培养6 h,然后将其置于正常氧浓度下继续培养,持续处理7 d.7 d后,将舱内氧浓度降至10.5%,放置低氧仓内培养6 h,再次置于正常氧浓度下继续培养,持续处理7 d.7 d后将舱内氧浓度降至6.5%,放置低氧仓内培养6 h.结束后正常氧浓度适应1 d后立即处理.
1.2.2 取材 甘肃鼢鼠和SD大鼠低氧应激结束后,乙醚麻醉,开胸,左心室插管,灌注生理盐水200 mL冲洗血液,冲洗干净后,灌注4%多聚甲醛-PB200-300 mL预固定,之后断头取脑入4%多聚甲醛-PB 4℃下固定24 h,30%蔗糖-PB溶液过夜沉底.
1.3 免疫组化处理
延髓连续冠状冰冻切片(Leica CM1510-1/CM1900),厚40 μm;SABC法进行免疫组织化学染色(c-Fos、HIF-1,Santa cruz,1∶500;二抗、SABC,武汉博士德),DAB(Sigma)显色,脱水,透明,封片,10×10倍光镜下观察其延髓部位的孤束核、灰质、蓝斑核,以细胞内出现棕黄色颗粒为阳性细胞.每核团10倍镜下随机选择10个不同视野,计数每个视野中阳性细胞数.
1.4 数据统计
2 结果与分析
2.1 c-Fos表达
甘肃鼢鼠与SD大鼠在常氧、急性低氧4 h、间歇性慢性低氧15 d条件下延髓孤束核(NTS)、灰质(GC)以及蓝斑核(LC)中c-Fos表达量统计结果如表1所示.甘肃鼢鼠在常氧、急性低氧4 h、间歇性慢性低氧15 d条件下延髓c-Fos表达情况见图1~3,c-Fos表达量比较如图4所示.常氧条件下,甘肃鼢鼠和SD大鼠延髓三核团中c-Fos广泛表达,甘肃鼢鼠延髓NTC、LC中c-Fos的表达分别是SD大鼠的1.51倍、1.41倍,均极显著高于SD大鼠(P<0.01),而两种动物GC中c-Fos的表达并无显著性差异(P>0.05);急性低氧4 h条件下,虽较常氧组相比两种动物延髓三核团中c-Fos的表达进一步增加,但两种动物c-Fos表达并无显著差异(P>0.05);在间歇性慢性低氧15 d条件下,甘肃鼢鼠延髓三核团中c-Fos的表达分别是SD大鼠的1.47、1.74、1.29倍,均极显著高于SD大鼠(P<0.01).

图1 甘肃鼢鼠常氧延髓c-Fos的表达
图2 甘肃鼢鼠急性低氧4 h延髓c-Fos的表达

图3 甘肃鼢鼠间歇性慢性低氧15d延髓c-Fos的表达

图4 SD大白鼠与甘肃鼢鼠c-Fos表达量的比较

表1 SD大白鼠与甘肃鼢鼠c-Fos表达量的比较
2.2 HIF-1α表达
甘肃鼢鼠与SD大鼠在常氧、急性低氧4 h、间歇性慢性低氧15 d处理后延髓孤束核(NTS)、灰质(GC)以及蓝斑核(LC)中HIF-1α的表达量统计结果如表2所示,HIF-1α表达量比较如图5所示.常氧条件下,甘肃鼢鼠延髓三核团中HIF-1α的表达分别是SD大鼠的4.49、3.56、4.66倍;急性低氧4 h条件下,甘肃鼢鼠延髓三核团中HIF-1α的表达分别是SD大鼠的2.64、2.60、2.82倍;间歇性慢性低氧15 d条件下,甘肃鼢鼠延髓三核团中HIF-1α的表达分别是SD大鼠的1.82、1.78、1.63倍.3种条件下,甘肃鼢鼠三核团HIF-1α表达量均极显著高于SD大鼠(P<0.01).

表2 SD大白鼠与甘肃鼢鼠HIF-1α表达量的比较

图5 SD大白鼠与甘肃鼢鼠HIF-1α表达量的比较
2.3 甘肃鼢鼠雌雄个体c-Fos表达
甘肃鼢鼠雌雄个体在常氧、急性低氧4 h、间歇性慢性低氧15 d处理后延髓孤束核(NTS)、灰质(GC)以及蓝斑核(LC)中c-Fos的表达量统计结果如表3所示,c-Fos表达量比较如图6所示.常氧条件下,雌性甘肃鼢鼠个体延髓三核团c-Fos表达量为分别为雄性个体的2.05、1.54、2.01倍,均极显著高于雄性个体(P<0.01);急性低氧4 h条件下,雌性甘肃鼢鼠个体延髓孤束核(NTS)中Fos的表达量为雄性个体的1.16倍,呈显著性差异(P<0.05),而两者在延髓灰质(GC)以及蓝斑核(LC)中c-Fos的表达量均无显著差异(P>0.05);间歇性慢性低氧15 d条件下,雌性甘肃鼢鼠个体三核团c-Fos表达量为雄性的1.23、1.19、1.27倍,均极显著高于雄性个体(P<0.01).
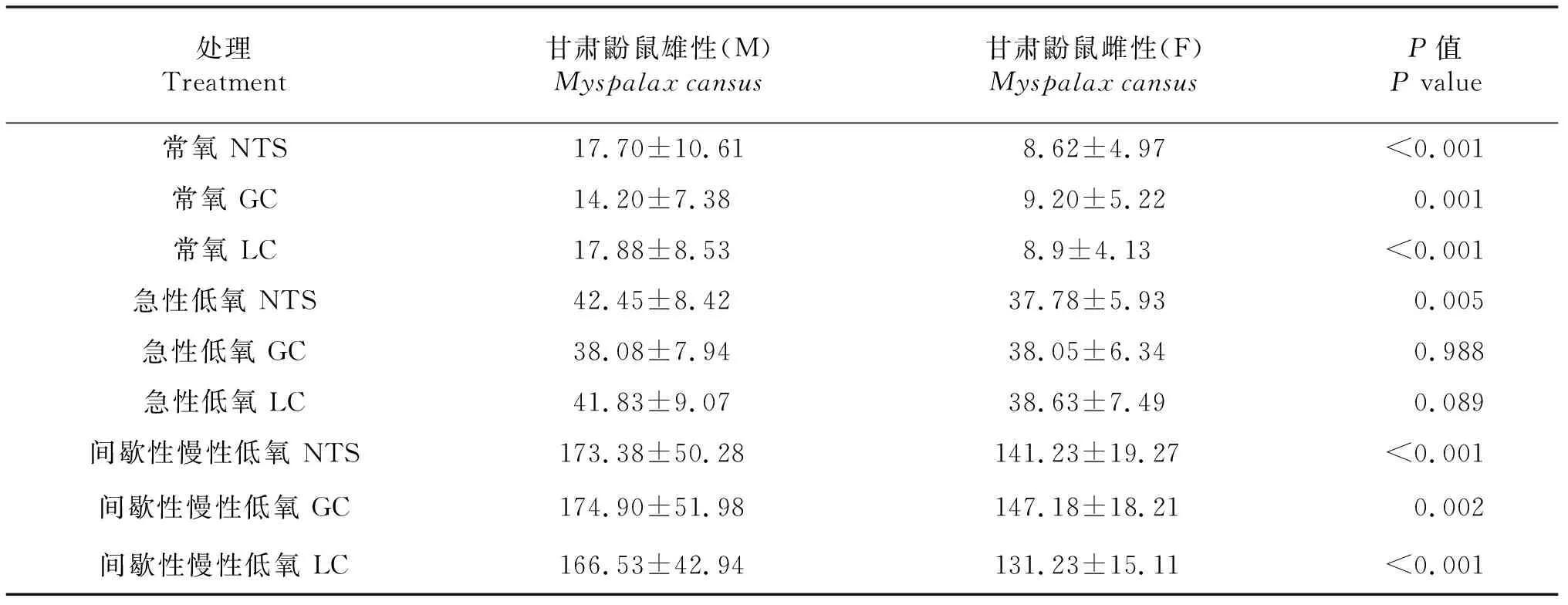
表3 甘肃鼢鼠雌雄3种条件下c-Fos表达量的比较(n=4)
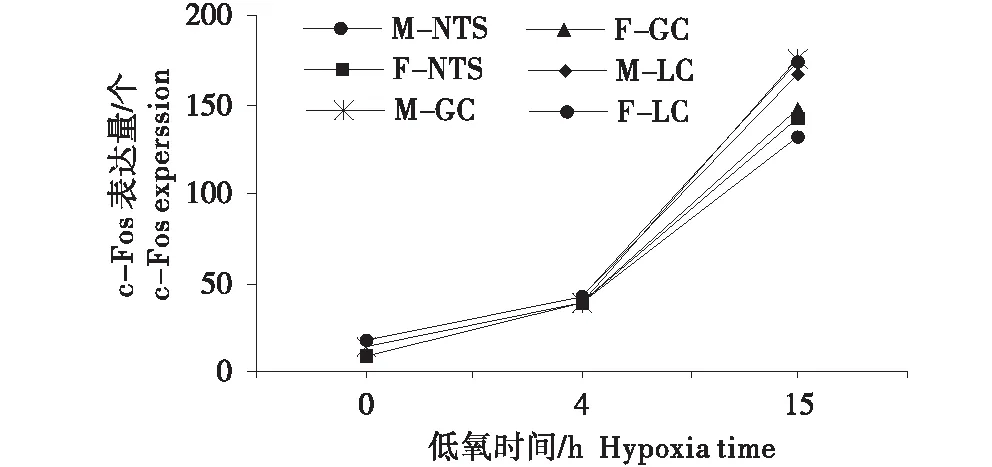
图6 甘肃鼢鼠雌雄3种条件下c-Fos表达量的比较
2.4 甘肃鼢鼠雌雄个体HIF-1α表达
甘肃鼢鼠雌雄个体在常氧、急性低氧4 h、间歇性慢性低氧15 d处理后延髓孤束核(NTS)、灰质(GC)以及蓝斑核(LC)中HIF-1α的表达量统计结果如表4所示,HIF-1α表达量比较如图7所示.常氧条件下,雌雄甘肃鼢鼠个体延髓三核团HIF-1α表达量均无显著差异(P>0.05);急性低氧4 h条件下,雌性甘肃鼢鼠个体延髓孤束核(NTS)中HIF-1α的表达量为雄性个体的1.06倍,呈显著性差异(P<0.05),而两者在延髓灰质(GC)以及蓝斑核(LC)中HIF-1α的表达量均无显著差异(P>0.05);间歇性慢性低氧15 d条件下,雌性甘肃鼢鼠三核团HIF-1α表达量显著高于雄性个体,雌性甘肃鼢鼠个体延髓孤束核(NTS)、灰质(GC)HIF-1α的表达量分别为雄性的1.03倍,1.06倍,均显著高于雄性个体(P<0.05),雌性甘肃鼢鼠个体延髓蓝斑核(LC)中HIF-1α的表达量为雄性个体的1.19倍,呈极显著差异(P<0.01).

表4 甘肃鼢鼠雌雄3种条件下HIF-1α表达量的比较

图7 甘肃鼢鼠雌雄3种条件下HIF-1α表达量的比较
3 讨论与结论
持续低氧刺激,不仅影响动物的生长发育和各种生理活动,而且对各种器官组织也会产生巨大损伤[35],但在长期的进化过程中,世居高原动物、水生动物[36]以及穴居地下动物的器官、组织及细胞,通过降低代谢效率、减少骨骼肌收缩、调控血象指标等策略,使其在不同程度显示出较强的低氧适应能力.同时在低氧刺激时,众多低氧诱导基因的差异表达,使得各类低氧适应的靶基因从分子水平上进行快速响应,使机体能够迅速做出低氧适应性反应.延髓被认为是神经动物的生命中枢,直接调控动物的心血管和呼吸运动功能,在动物低氧刺激早期发挥重要功能.因此,我们结合急性低氧与间歇性慢性低氧的方法,比较甘肃鼢鼠与SD大鼠c-Fos、HIF-1α在延髓孤束核(NTS)、灰质(GC)、蓝斑核(LC)3种核团内的表达,从中枢调控水平讨论地下鼠低氧应对策略.
3.1 c-Fos表达结果
c-Fos基因受到外界刺激后可迅速表达,中枢神经系统通过c-Fos基因的表达把外界信号转变为细胞内基因表达的刺激信号,从而对外界的刺激做出应答,因此c-Fos的表达可作为神经元是否参与刺激或伤害性信号传导的标志[6].本试验结果表明,甘肃鼢鼠在常氧条件下延髓c-Fos广泛表达,从急性低氧到间歇性慢性低氧条件下c-Fos表达呈现上升趋势.与SD大鼠比较,常氧条件下甘肃鼢鼠和大鼠延髓NTC,LC中c-Fos广泛表达,甘肃鼢鼠表达量极显著高于大鼠(P<0.01),这可能是由于甘肃鼢鼠终生营地下生活,其本身神经元活性较地上鼠有更强的活性,使其在低氧环境下的延髓调控中枢能够更好地应对低氧,同时除GC外两种核团c-Fos表达量在两种动物间也存在极显著性差异,可能因为甘肃鼢鼠由于营终生地下生活,实验室环境对其是相对“富氧”环境,因此在常氧条件下,其呼吸、心血管活动的延髓调控中枢可能会出现有异于试验动物神经元反应.而在GC处无差异则提示呼吸上行通路可能不仅仅严格受控于延髓,可能还直接受中脑或者下丘的调控.这与11%氧浓度下,对SD大鼠处理3 h(急性低氧)后,c-Fos蛋白在孤束核(NTC)、灰质(GC)表达明显增多,在蓝斑核(LC)表达增多不明显[37]的研究结果十分相似.急性低氧4 h条件下,虽较常氧组相比两种动物延髓三核团中c-Fos的表达进一步增加,但两种动物c-Fos表达并无显著差异(P>0.05).急性低氧对于二者均为应激刺激,在短时程内甘肃鼢鼠与SD大鼠均可产生应答反应,说明二者神经系统反应一致.在间歇性慢性低氧15 d条件下,甘肃鼢鼠延髓三核团中Fos的表达均极显著高于SD大鼠(P<0.01),SD大鼠c-Fos表达虽然继续增加,但是幅度不大,可能是间歇性低氧缓解了SD大鼠对低氧环境的适应程度,而甘肃鼢鼠在此阶段,延髓神经元仍能对环境做出反应,说明甘肃鼢鼠长期的低氧适应可增强机体低氧适应机制[38].
3.2 HIF-1α表达结果
HIF-1α广泛参与哺乳动物缺氧诱导的应答反应,是机体细胞适应低氧的主要中介物质,对机体组织在缺氧条件下维持内环境的平衡起着重要的调节作用[39].本试验发现,甘肃鼢鼠低氧条件下HIF-1α表达模式与高原鼠兔和鼹形鼠一致[33,40].其延髓束核(NTS)、灰质(GC)以及蓝斑核(LC)在常氧条件下就有广泛的HIF-1α表达,随着时间推移,HIF-1α表达量进一步增加,说明随着低氧时程增加,机体为改善组织缺氧后能量代谢障碍,加快组织缺氧的恢复过程,HIF-1α表达增多,激活下游靶基因,启动机体的缺氧适应机制,促进微循环重建、葡萄糖载体蛋白和醛缩酶乳酸脱氢酶等糖酵解酶表达增加、红细胞生成,提高血液携氧量等来达到机体众多氧平衡调节,说明HIF-1α表达与低氧或缺氧程度和时间有明显的依存关系.这与以往的研究结果一致[41].在本研究中,我们发现在3种不同条件处理下,甘肃鼢鼠NTS、LC、GC HIF-1α表达均极显著地高于SD大鼠.参照甘肃鼢鼠与SD大鼠急性低氧4 h后,c-Fos蛋白在延髓各核团的表达无显著差异,说明在同种条件下两种鼠感受的低氧刺激是相同的,而甘肃鼢鼠在急性低氧后各核团HIF-1α的表达极显著高于SD大鼠,说明甘肃鼢鼠对于短时程的低氧应激易于耐受,说明甘肃鼢鼠长期在地下低氧环境的生活史,使其能对长时程、低浓度刺激做出更积极的应对策略.此外,甘肃鼢鼠HIF-1α在NTS、LC、GC在同一处理条件下的表达无显著性差异,这与以往报道一致[42-44],甘肃鼢鼠脑部其他区域HIF-1α的表达是否具有组织或细胞特异性还需要进一步讨论.
3.3 甘肃鼢鼠雌雄个体c-fos、HIF-1α表达结果
机体应激反应是神经、内分泌、免疫等多系统的综合应答过程,在引起交感神经活性、神经内分泌功能改变的同时,也受到中枢系统的高级整合和中介作用[45],雌雄个体对机体内外环境做出的应答反应有所差异[46].常氧状态下,雌性甘肃鼢鼠c-Fos表达明显低于雄性个体,但HIF-1α差异不明显,提示雌性个体对相对“富氧”的环境因素并不敏感.急性低氧4 h后,雌性个体延髓孤束核(NTC)c-Fos表达明显低于雄性个体,但HIF-1α的表达却显著偏高;间歇性慢性低氧15 d后,雌性个体在三核团的c-Fos表达均明显低于雄性个体,HIF-1α的表达却明显高出.这些结果提示雌性甘肃鼢鼠对于急性、间歇性慢性低氧刺激可能较雄性个体具有更强的耐受性,其具体应答策略及在应答过程中是否主要依赖HIF-1α诱导的调控途径有待于进一步研究.
