污泥好氧堆肥对PAHs的处理效果和抗生素及抗性基因消解效果
2021-07-17李碧清肖先念
孙 伟, 匡 科, 严 兴, 李碧清, 雷 芳, 王 双, 肖先念
广州市净水有限公司, 广东 广州 510163
污泥资源化是目前城市污泥处理方式中应用较为广泛的一种方式[1]. 污泥堆肥致力于N、P、K等营养元素的保留以及有机质的稳定和腐熟,从而制备高肥效、低毒性的土壤改良剂[2]. 但污泥中也不可避免地含有病原菌、臭气和难降解有机物等有害物质,特别是生化工艺不能完全降解的合成洗涤剂、化妆品等难降解有机物在污泥中大量富集,我国各地区城市污泥中PAHs总量都超过10 mg/kg,其中广州市城市污泥中PAHs总量的平均值为33.1 mg/kg,二次污染风险较大[3-5],研究证明,堆肥处理产生的高温高热可有效地杀灭其中病原菌和寄生虫卵[6],但不能完全去除污泥中的难降解有机物[7-8]. 难降解有机物分子量较大、沸点高、不易挥发,污染风险较大,且降解除去困难,易在土壤和农作物体内积累[9-10]. 随着抗生素的广泛使用,活性污泥已成为抗生素和抗性基因的重要富集位点,其未经处理直接施用具有潜在的生态环境和人类健康风险[11-12]. 污泥堆肥可以消减城市污泥中的抗生素,并对抗性基因的传播和扩散具有一定的控制效果[13-14].
目前对污泥堆肥中难降解有机污染物的研究尚处于摸索阶段,研究也有待进一步深入,堆肥产品的土地利用还没有完整的科学理论依据[15-16]. 污泥堆肥后必然会有抗生素和抗性基因的残留[17-19],其在施用于土壤过程中,残留的抗生素是否会对土壤活性、微生物群落结构造成影响?残留的抗生素抗性基因是否会发生水平迁移?这些都是污泥堆肥土地利用过程中亟需解决的问题. 因此,该研究通过污泥混合木屑、微生物发酵菌、生物质炭和蘑菇渣进行共堆肥研究,探讨难降解有机物的降解去除以及抗生素和抗性基因的消解情况等,并进行了土壤改良试验,以期为堆肥产品的应用提供有效的技术和理论支持.
1 材料与方法
1.1 试验材料和试验装置
城市污泥取自广州市大坦沙污水处理厂,属于典型的城市污水处理厂剩余污泥,从离心脱水机污泥出料口取样,分别于06:00、10:00和14:00取等量样品混合均匀;蘑菇渣、生物质炭、微生物发酵菌、木屑相关指标满足堆肥要求,经检测,蘑菇渣和木屑中的PAHs含量极低,均低于检出限,而试验用的木屑取自森林,蘑菇渣经过优选,受抗生素影响较小,生物质炭和微生物发酵菌复配量少,可忽略其本底值[20];堆肥装置采用定制保温不锈钢罐,规格为直径60 cm、高60 cm,内置自动搅拌装置,加盖密封. 采用鼓风机曝气,鼓风机风量控制在0.2 m3/h左右[20].
16种PAHs混合标准样品1 mL (UREA-REPAH107,New Zealand),包括苊(Ace)1 000 μg/mL、蒽(Ant)100 μg/mL、苯并蒽(BaA)100 μg/mL、荧蒽(Fluo)200 μg/mL、1,2-苯并菲(Chry)100 μg/mL、芴(Flu)200 μg/mL、萘(Nap)1 000 μg/mL、菲(Phe)100 μg/mL、芘(Pyr)100 μg/mL、苊烯(Acy)2 000 μg/mL、苯并[b]荧蒽(BbF)200 μg/mL、苯并[k]荧蒽(BkF)100 μg/mL、苯并[a]芘(BaP)100 μg/mL、茚并(1,2,3-cd)芘(IcdP)100 μg/mL、二苯并[a,h]蒽(DBA)200 μg/mL和苯并[g,h,i]芘(BghiP)200 μg/mL.
1.2 堆肥试验
将木屑通过10目(相当于2 mm)的筛网,收集筛下的碎木屑,蘑菇渣切割成0.5 cm的碎片,生物质炭碾碎,通过0.2 cm的分子筛,按照不同的比例分别与蘑菇渣、酸性生物质炭和木屑混合进行堆肥试验,堆体高50 cm,质量约100 kg,混合物料粒径为0.05~5 cm,C/N为25∶1,含水率为78.5%. 根据前期研究成果[20],最佳堆体的成分比例:污泥66.9%、微生物发酵菌0.1%、木屑20%、蘑菇渣8%和生物质炭5%,堆肥产品的粒径集中在0.25~2 mm之间,占比为66.4%,有机质含量为50.5%,TN、TP和TK的含量分别达到3.88、0.64和1.10 g/kg,发芽指数为183%,各重金属主要形态为残渣态,Cr、Pb、Ni和Cu的含量分别为88.5、28.5、49.1和158.2 mg/kg.
1.3 土壤改良试验
将堆肥产品用于城市建筑半硬化荒地,地上生长有人工种植的景观乔木,荒地面积约 1 000 m2,土壤板结严重,含水率为8.5%,pH约为6.5,TN、TP和TK含量分别为0.05%、0.02%和0.30%. 将土壤改良剂混合肥料样品(土壤改良剂50 kg,按照1∶3混入普通的农田土壤)进行土壤改良试验. 种植前,先将荒地整平,挖直径30 cm、深30 cm的小坑,待植物种植后整平,每15 d再追加10 kg样品. 改良3个月后,种植的海芋叶片饱满,株径2.5 cm,株高60 cm. 取改良的土壤进行检测,含水率为22%~24%,pH为6.8,TN、TP和TK的含量分别为0.30%、0.25%和3.50%.
1.4 PAHs检测分析
取50 g固体样品,加入内标PCB209,在20 ℃、100 Hz条件下超声萃取3次,每次30 min,并加入10 mL HEX(正己烷)与DCM(二氯甲烷)(体积比为1∶1)的混合液,合并提取液,浓缩至2 mL. 制备好的样品以氧化铝、硅胶、无水硫酸钠先后填充的净化柱净化,再以HEX与DCM的混合液洗涤净化柱,接收洗脱液后浓缩定容至1 mL,待测.
样品采用气相色谱-质谱仪(7890A GC-5975BMSD,Agilent,美国)进行测定,使用HP-5M5柱(30 m,内径0.25 mm,膜厚0.25 μm). 定量分析以选择性离子监测(SIM)模式进行. 进样口温度为250 ℃,检测器温度为280 ℃,升温程序:初始温度为40 ℃,先以8 ℃/min的速率增至200 ℃,然后以8 ℃/min的速率升至300 ℃并保持10 min[21].
1.5 抗性基因检测
对污泥(S1)、堆肥产品(S2)和土壤改良样品(S3)抗性基因检测. 采用分析数据评估及质控,对测序的原始数据通过FastQC进行质量评估,并通过Trimmomatic进行过滤处理,得到相对准确的有效数据;拼接组装,使用IDBA_UD对各样本Clean reads进行拼接组装成长序列contig,根据reads间的overlap关系,获得contig,并对多个Kmer的组装结果进行综合评定,选择最佳Kmer组装结果;采用Prodigal对拼接结果进行ORF预测,选择长度大于等于100 bp的基因,并将其翻译成氨基酸序列[22].
2 结果与讨论
2.1 污泥堆肥试验
根据前期研究成果[20],堆体的最高温度达到68 ℃,超过50 ℃的时间达到15 d(见图1),堆肥产品肥效好,堆肥产品的重金属主要以较稳定的残渣态存在,不易在自然环境中溶解析出,发芽指数高.

图1 污泥堆肥温度变化情况
2.2 堆肥对PAHs的降解作用
PAHs溶解性较低、难降解,在污水处理过程中易被吸附到悬浮的固体颗粒上,从而在污泥颗粒上积累. PAHs具有致癌性,其含量是评估污泥农用安全性的重要指标[23-24].
污泥和堆肥产品的PAHs检测分析结果如图2所示. 由图2可见,污泥堆肥对PAHs的去除率基本都在50%以上,特别是芴、菲和蒽的去除率超过了80%. 统计分析显示,堆肥前∑16PAHs(16种PAHs总量)为29.7 mg/kg,堆肥产品中∑16PAHs降至6.3 mg/kg,去除率达到78.7%,∑PAHs-cancer(具有致癌活性的4~6 环PAHs总量)从14.5 mg/kg降至3.8 mg/kg,去除率达到74.1%,∑PAHs-ppc(被我国列入环境“优先污染物”的PAHs总量)从4.9 mg/kg降至1.5 mg/kg,去除率达到68.6%. 污泥堆肥对毒性最大的一种强烈致癌物——苯并[a]芘的去除率虽然只有65.4%,但剩余含量较低,仅为0.353 mg/kg. PAHs通过微生物体内功能性酶的降解作用转化为简单的有机物中间体,从而被生物进一步利用,如真菌通过分泌单加氧酶将单个原子引入PAHs,产生环氧化物中间体,耦合水分子形成反式二醇和酚类;细菌类主要通过分泌双加氧酶将两个氧原子引入PAHs,产生二氧化物中间体,再进一步氧化成顺式二醇,而后转化为二轻基化合物,接着苯环断开,并进一步代谢为三羧酸循环的中间产物. 一些环境微生物经过适应和诱导可以对PAHs进行代谢分解,甚至矿化[25-26]. 堆肥对PAHs的降解率较高,但产品中的∑16PAHs仍超过GB 4284—2018《农用污泥污染物控制标准》[27]A级污染物限值(5 mg/kg)和B级污染物限值(6 mg/kg).

图2 污泥和堆肥产品中PAHs的含量及其去除率
选出堆肥产品中含量最高的4种PAHs——蒽、苯并蒽、1,2苯并菲和苯并[k]荧蒽,进行重复试验和检测分析,其随时间的降解情况如图3所示.

图3 堆肥产品中含量最高的4种PAHs的降解情况
由图3可见,在污泥堆肥前期,4种难降解PAHs的含量变化比较明显,前8 d的其去除率均超过50%,这是因为各组分在堆肥过程中的降解主要取决于微生物的降解作用,温度越高,微生物活性越强,PAHs的去除率也越高. 在堆肥进行到第12天时,上述组分含量基本趋于稳定,到第16天时去除率基本维持不变,这是因为,在堆肥过程中PAHs的降解与污泥的腐殖化反应紧密相关,在污泥堆肥后期,污泥堆肥产品逐渐稳定,微生物活性降低,去除率随之降低.
分析结果显示,PAHs的降解情况受苯环数量影响也较大,2~3环PAHs(如蒽)的降解速率较快,去除率较高;5~6环PAHs如苯并[k]荧蒽的降解速率相对较慢,去除率也不高. 这是因为,许多微生物(如假单胞菌属、黄杆菌属、诺卡氏菌属等)能以环境中的低分子量(2~3环)PAHs作为唯一的碳源和能源,并将其完全无机化,高分子量(4~6环)PAHs的可溶性差,比较稳定,难以降解,只有少数微生物(如白腐菌、烟管菌等)可以通过与其他有机质的共代谢等作用进行降解[7-8].
2.3 抗性基因消解效果分析
堆肥过程中共检测出308种抗性基因,其中241种抗性基因的检出率为100%. 在污泥(S1)中共检出255种抗性基因,相对丰度范围为0~67.8%;堆肥产品(S2)中共检测出295种抗性基因,相对丰度范围为0~71.8%;土壤改良样品(S3)中共检测出299种抗性基因,相对丰度范围为0~70.2%(见图4). 该结果表明,随着堆肥时间的进行,抗性基因的种类呈轻微上升趋势. 大环内脂类和杆菌肽类抗性是检测出的2种最主要的抗性基因,其中,大环内脂类抗性基因种类在污泥样品、堆肥产品和施肥土壤中分别占所有抗性基因种类的24.4%、25.7%和25.3%,表明堆肥对大环内脂类抗性基因的消减效果并不明显;杆菌肽类抗性基因种类分别占所有抗性基因种类的10.8%、9.6%和9.9%,说明杆菌肽类抗性基因种类在堆肥过程中呈现轻微下降趋势,且施肥于土壤后出现迁移.BL2a_1(青霉素)、BL2b_rob(CP)、BL2e_y56(头孢菌素)、BL3_cphA(CCCP)、FosA(磷霉素)、VanXD(VT)、dfrA24(甲氧下氨嘧啶)、catA16(氯霉素)、catA7(氯霉素)、catB5(氯霉素)及tetPA(四环素)等抗性基因在堆肥过程中被完全消减,消减率达到100%. 同时,136种抗性基因在堆肥过程中出现了不同程度的消减,其中,BL1_asba(头孢霉菌素)、BL1_och(头孢霉菌素)、BL1_pse(头孢霉菌素)、BL2_veb(CP)、BL3_vim(CCCP)、EreA(红霉素)、ErmO(LSM)、FosX(磷霉素)、MdtM(CAN)、QnrB(氟喹诺酮)、QnrS(氟喹诺酮)、SmeB(氟喹诺酮)、VanWB(万古霉素)、VanWG(万古霉素)、VatC(链阳性菌素)、VgbB(链阳性菌素)、catB4(氯霉素)、cmL_e8(氯霉素)及(四环素)这19种抗性基因在堆肥过程中的消减率超过85%. 抗性基因的消解是因为微生物在酸化水解和吸附降解的过程中,部分功能微生物出现衰亡,细胞裂解释放的DNA与胞外DNA同时被水解或生物降解. 这一过程需要在特定的温度、湿度和pH条件下,并通过微生物体内功能性核酸酶的催化降解作用,触发抗性基因的消解,DNA分子逐渐脱稳,部分双链分子结构逐渐转变为单链分子结构,同时,磷酸二酯键断裂、氢键稳定性降低、末端碱基脱落,抗性基因得到有效消解,这与已有研究结果[28-30]基本一致.
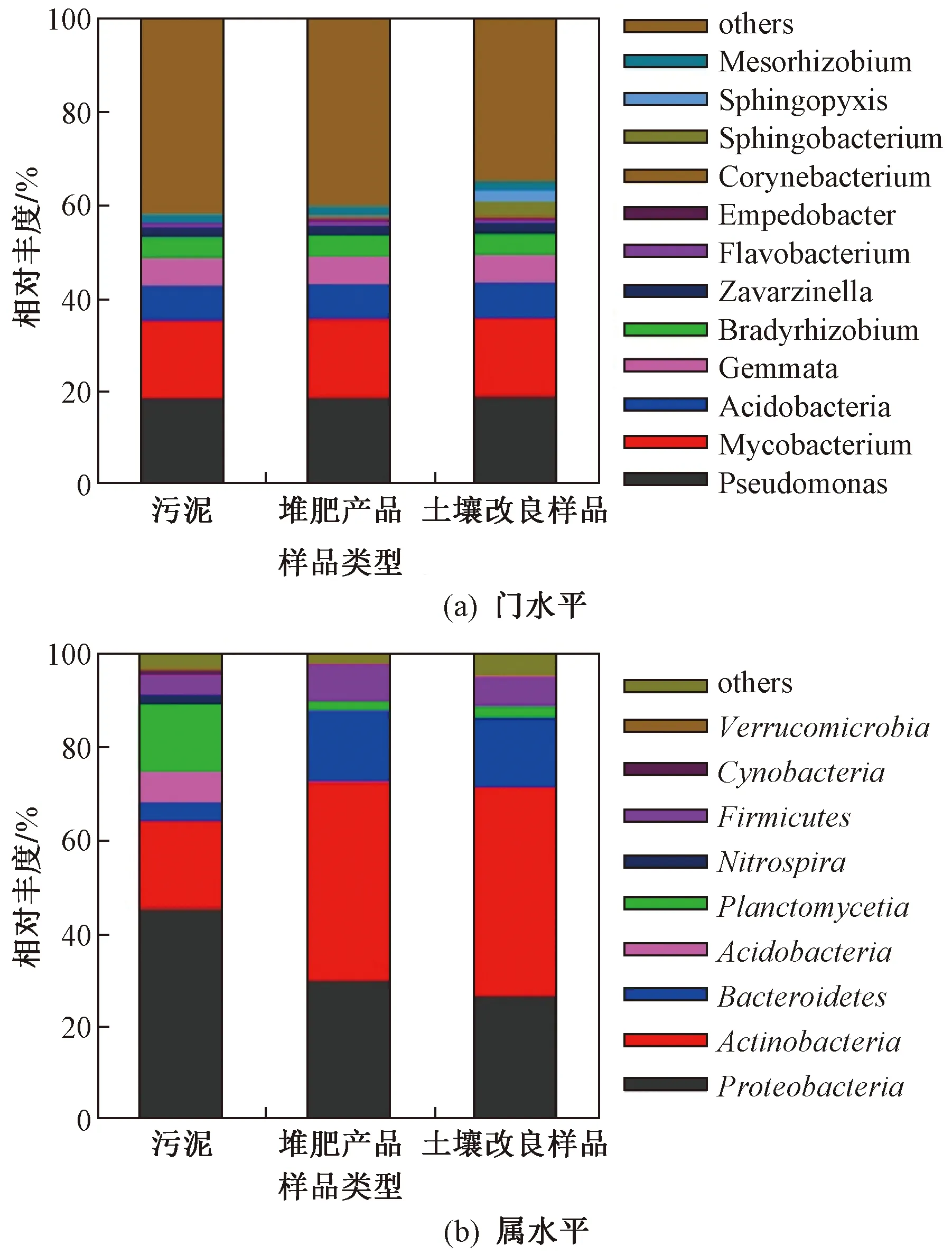
图4 堆肥过程中群落结构变化
研究表明,微生物群落结构的变化是决定抗性基因多样性的重要因素之一[31-32],笔者通过对堆肥过程中微生物群落结构分析发现,Shannon-Wiener指数在堆肥过程中变化不明显. 堆肥过程中门水平上的分析结果发现,污泥样品被分为103个门类,其中变形杆菌门、放线杆菌门、浮霉菌门、酸杆菌门、拟杆菌门、硝化螺旋菌门及厚壁菌门是其主要门类,分别占45.2%、19.0%、14.4%、8.5%、4.0%、1.8%及1.3%. 堆肥产品的微生物群落被分为102个门,其中放线杆菌门占比最大,达到42.8%,其次分别是变形杆菌门和拟杆菌门,分别占26.2%和21.5%. 施肥于土壤后微生物群落被分为104个门,其中放线杆菌门仍然占比最大,达到45.5%,其次是变形杆菌门和拟杆菌门,分别占26.9%和19.1%. 上述结果表明,堆肥及施肥过程中微生物群落在门水平结构上未发生明显变化,这与Shannon-Wiener指数变化情况相对应,其次放线杆菌门含量在堆肥过程中呈现逐渐递增的趋势. 进一步分析堆肥过程中属水平上微生物群落的变化,结果表明,污泥样品中假单胞菌属、分枝杆菌属、酸杆菌属、出芽菌属及短根瘤菌属是其主要的属,分别占17.1%、15.3%、6.7%、5.4%及4.1%. 堆肥产品中分枝杆菌属、黄杆菌属、隐杆菌属、棒状杆属和鞘氨醇杆菌属转变成为其主要的属,分别占34.4%、3.7%、2.3%、2.0%和1.8%. 施肥土壤中分枝杆菌属、鞘氨醇杆菌属、鞘脂单胞菌属、中慢生根瘤菌属及棒状杆菌属成为其主要菌属,分别占32.9%、2.9%、2.5%、2.0%及1.8%. 该结果表明堆肥及施肥过程中微生物群落在属水平上发生了较大变化,其中分枝杆菌属和鞘氨醇杆菌属的占比在堆肥过程中不断增加,属水平上微生物群落的变化可能与堆肥过程中抗生素类物质的降解有关[33-34].
3 结论
a) 添加辅料进行共堆肥,能够促进污泥堆肥的腐熟,对PAHs的降解效果较好. 共堆肥能够促进污泥中PAHs的降解,去除率基本都在50%以上,特别是芴、菲和蒽的去除率都超过了80%. ∑16PAHs的去除率达到78.7%,∑PAHs-cancer的去除率达到74.1%,∑PAHs-ppc的去除率达到68.6%. 但堆肥后∑16PAHs的总量为6.3 mg/kg,超过GB 4284—2018《农用污泥污染物控制标准》A级污染物限值(5 mg/kg)和B级污染物限值(6 mg/kg),且PAHs具有致畸性、致癌性和致突变性,在环境中难降解、易累积,PAHs经过低等生物体的吸收、富集而产生的危害可以通过食物链进入人体. 因此,施肥土壤仍存在一定的生态风险,需要进行风险评估后施用.
b) PAHs的降解受温度和持续高温时间的影响较大,温度越高,持续时间越长,PAHs的去除率也越高. PAHs各组分的降解与本身的结构亦相关,低分子量(2~3环)PAHs的去除率较高,高分子量(4~6环)PAHs的去除率相对较低.
c) 多种抗性基因在堆肥过程中出现了不同程度的消减,其中,BL2a_1(青霉素)、catB5(氯霉素)和tetPA(四环素)等11种抗性基因在堆肥过程中完全消减,消减率均达到100%,BL1_asba(头孢霉菌素)、EreA(红霉素)、QnrB(氟喹诺酮)和cmL_e8(氯霉素)等19种抗性基因在堆肥过程中消减率均超过85%,可见堆肥过程能有效消减该类抗性基因.
d) 堆肥过程中抗生素类物质的降解影响了属水平上微生物群落的变化,其中分枝杆菌属和鞘氨醇杆菌属在堆肥过程中变化明显,堆肥产品及施肥土壤中属水平上微生物菌落的不确定性影响了污泥产品的农业施用,有待进一步深入研究.
