先天性外中耳畸形的早期听力诊断与干预策略
2021-07-17史文迪陈佳慧王永华查诗华
史文迪 陈佳慧 王永华 查诗华
先天性外中耳畸形(microtia and atresia,MA)由于外观形态被称为小耳畸形,外中耳畸形合并外在形态、内在中耳结构和听觉功能的改变。
1 外中耳畸形的流行病学和病因学
先天性外中耳畸形是颌面部发病率仅次于唇腭裂的常见畸形,男性发病率高于女性,单侧发病率是双侧的3~4倍,单侧中右耳发病率高于左耳;在全球不同国家发病率有巨大差异,法国最低0.83/10000,厄瓜多尔最高17.4/10000[1]。我国30年前总发病率为1.4/10000,新疆发病率最高,内蒙古最低[2]。流调的1988~1992年是我国人口计划生育政策执行时期,在我国2016年全面放开二胎生育及目前的卫生条件、营养条件、孕期医学保健意识等出现巨大变化的情况下,发病率情况尚无报道。
先天外中耳畸形患者中大部分同时在耳廓、外耳道、中耳结构中至少存在2个以上部位的畸形,但也可能仅单一部位畸形,极少患者合并内耳畸形。目前发病机制不明确,有研究认为主要是颅神经嵴细胞(cranial neural crest cell,CNCC)衍化过程中受影响导致第一咽囊、第一鳃弓(下颌弓)、第二鳃弓(舌骨弓)、第一鳃裂及中胚层间充质组织在孕期发育畸变。已有报道的高危因素有缺氧(如高海拔地区)、妊娠早期存在烟、酒、致畸药物使用史(如抗癫痫药三甲双酮、卵泡激素雌三醇、促排卵药克罗米芬和维生素A等),以及上呼吸道感染、炎性反应、免疫抑制剂使用史、自然流产史及妊娠期糖尿病等;孕早期即开始服用叶酸制剂可能降低风险[3]。由于外、中耳从胚胎发育上来源与内耳不同,因此仅有不足10%的患者合并内耳畸形,伴发畸形常见的是颌骨发育畸形(如半面短小)、腭裂,其次是眼部畸形,有部分患者伴随先天性心脏及肾脏畸形以及脊柱畸形、肋骨畸形、尿道下裂等[4]。外中耳畸形遗传学外显率差异显著,同一遗传型但表型复杂、差异大,且由于发病机制不确定性,因此难以避免或控制外中耳畸形出生缺陷的发生。染色体片段的增加、缺失、异位可导致外中耳畸形的产生;部分单基因突变也可导致外中耳畸形的发生,常见是作为某一综合征的耳部症状出现,笔者整理了常见的12种外中耳畸形为主要表现的综合征致病基因、表型特点及遗传方式[5],见表1。
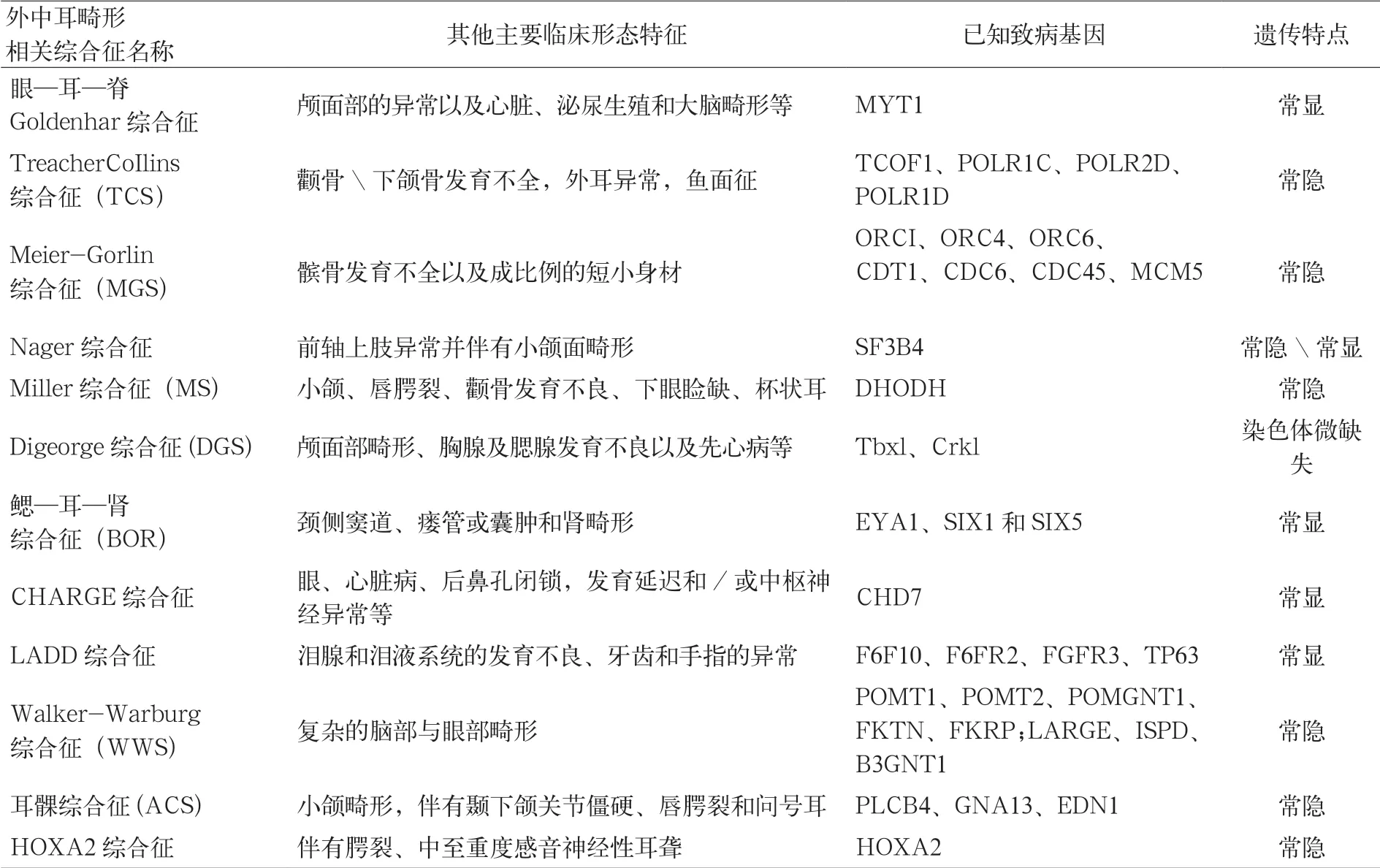
表1 以外中耳畸形为主要表现的综合征致病基因、表型特点及遗传方式
2 外中耳畸形的常见分类
临床中常用的耳廓畸形分类是Marx分类:Ⅰ度畸形为耳郭轻度残缺,比正常耳郭略小,各部分结构清晰可辨;Ⅱ度畸形为耳郭大小相当于正常耳郭的30%~50%,部分耳廓结构保留;Ⅲ度畸形为耳郭常呈现花生米样结构[6]。外耳道畸形一般使用Schuknecht分类,分为4类:A型和B型为外耳道狭窄(有耳道、鼓膜);C型和D型为外耳道闭锁(无鼓膜)[7]。中耳畸形常用Teunissen分类:I型为先天性镫骨固定;II型为先天性镫骨固定伴听骨链畸形:伴听骨链中断(a)、固定(b)和伴有面神经走行异常(c);III型为听骨链畸形,但镫骨足板可活动:伴听骨链中断(a),伴听骨链固定(b);IV型为先天性蜗窗或前庭窗发育不全或重度发育异常:伴砧骨发育异常(a),伴锤骨发育异常(b),伴镫骨发育异常(c),伴面神经走行异常(d)[8]。少数患者是单纯中耳畸形,大部分中耳畸形与外耳道、耳廓畸形合并发生,中耳畸形中最常见的有听小骨缺如、部分缺如、听小骨间融合,以及听小骨和相邻结构融合。单纯中耳畸形易被漏诊、误诊、误干预[9]。分型的形态结构初步决定了功能,也对听力检测使用何种检测耳机、听力干预方法的选择具有重要指导意义。
高分辨率CT在外中耳畸形诊断中的应用非常重要,颞骨为含气骨骼结构,影像学骨窗算法的扫描对比度高,可以清晰观察外中耳相关解剖结构,为诊断和听力干预与手术治疗策略的选择提供重要参考。
3 外中耳畸形的听力学检测方法及特点
由于外中耳畸形患者不仅仅需要检测常规的气导听力,还需要检测骨导听力、计算气骨导差,了解外中耳畸形对声音的传导阻滞情况。以气导和骨导的ABR差值是发现、诊断并治疗干预传导性听损儿童的重要条件[10]。因此,如要对外中耳畸形的患儿进行听力检测,必须进行气导和骨导的ABR、ASSR或行为测听,干预必须进行频率特异性骨导听觉脑干诱发电位(bone conduction auditory brainstem response,BC-ABR)、骨导听性多频稳态反应(bone conduction auditory steady-state response,BC-ASSR)、骨导行为测听(bone conduction pure tone auditory,BC-PTA),如果要进行助听干预一定要明确本中心的分频率BC-ABR或BC-ASSR与骨导行为测听的生物学矫正值,确保精准干预[11]。
对外中耳畸形患儿的早期听力学诊断重要的方法是客观电生理检测,如不能进行0.5、1、2、4 kHz的气导和骨导ABR、ASSR检测,则严重影响外中耳畸形患儿的精准诊断和助听干预。对婴幼儿进行ABR、ASSR检测时根据患者畸形程度分类,由于耳间衰减和头颅与声波的接触面积呈反比,头颅与声波接触面积越小耳间衰减值越大,因此外中耳畸形能够使用插入式耳机尽可能使用插入式耳机,插入式比耳罩式耳机有更大的耳间衰减[12]。
外中耳畸形婴幼儿的气导ABR检测特点出现I波延迟及I-V波的波间期无变化,如果90 dB nHL还未引出气导ABR的反应阈值,则要考虑存在神经性听力损失因素,考虑混合性耳聋,骨导ABR的检测特点是阈值较好,且外耳道闭锁的患儿往往在500 Hz由于堵耳效应的影响,阈值在0~5 dB nHL;成人骨导ABR潜伏期比气导长,而婴幼儿骨导ABR潜伏期比气导短。新生儿期骨导测试的耳间衰减为20~35 dB,1岁时达到10 dB,成人的低频骨导耳间衰减值接近0 dB,随着频率的提高,骨导的耳间衰减值也提高,在2~4 kHz频率骨导的耳间衰减值约能达到10~15 dB[13]。建议采用B-81骨导振子进行检测,B81骨振子比B71骨振子性能更稳定,失真更小,测试范围更大[14]。
对于双侧闭锁的外中耳畸形患儿测试骨导ABR、ASSR测试时,由于难以施加掩蔽使得测试结果存疑。但由于婴幼儿颅骨发育不完全,颅骨骨缝及软骨的存在使得更多地聚焦骨导能量在颞骨。出生后一个月内的婴幼儿骨导耳间衰减高达20~35 dB,随着年龄增长耳间衰减值逐渐下降,因此,婴幼儿期在测试时对侧耳有无掩蔽声不影响测试耳的骨导反应阈和潜伏期[15]。但也有可能存在其他未成熟的传导和感音神经方面的机制[16]。从检测准确性的角度看,先天外中耳畸形婴幼儿越早进行听力诊断,听力学检测中的掩蔽难度越低,检测结果越准确。
外中耳畸形患儿听力图表现常见为骨导听力曲线为下降型,气导听力曲线为上升型,出现这样听力曲线与外中耳传音的结构功能特点相关。完全骨性闭锁的外中耳畸形气导听力损失>55 dB:外耳道闭锁导致耳廓及外耳道的集音放大功能损失15 dB;鼓膜不存在、听骨链畸形导致中耳的阻抗匹配(鼓膜镫骨足板面积差及两次杠杆效应)损失约30 dB;声波传播至卵圆窗和圆窗时,如果镫骨足板固定则两窗运动相位差丧失导致听力损失15 dB;受皮肤和颅骨对不同频率的声压衰减,低频气导听力损失则更严重[17]。骨导听力的低频好于高频有两个原因:①当外耳道骨性闭锁时,产生堵耳效应,低频骨导听力测试时没有开放的外耳道泄出能量,导致阈值变低;②中耳畸形会存在听骨链固定或镫骨足板固定使得2 kHz出现类似耳硬化征“卡哈切记”的听力下降。如果圆窗闭锁则表现为重度以上混合性聋,气导听力损失往往大于80 dB。听力损失程度常与外耳道闭锁(骨性闭锁或膜性闭锁)以及中耳畸形的程度呈正相关[17,18]。
4 先天外中耳畸形早期干预的重要性与必要性
目前在先天性外中耳畸形的干预上存在常见误区,例如:双侧外中耳畸形患者的干预可以待其1~2岁再进行,甚至不进行干预;对于一侧正常,一侧外中耳畸形患者是否应该进行干预,一直存在争议,部分医生认为只有要一侧耳听力正常,不影响言语和智力发育。这些误区与儿童听力学“早诊断、早干预、早康复”的三早原则相悖[19],不论是我国还是欧美儿童听力学干预指南一致认为不论是单侧还是双侧永久性听力损失,应在出生后3个月内确诊和3~6个月尽早干预,以减少听力障碍对言语、认知发育的影响[20],不能因在临床短暂、未做全面评估和对比研究的主观经验印象而给出错误的临床干预决策,对婴幼儿患者的听力言语障碍以及伴随的认知、性格、心理的方面的发育会产生深远的负面影响[21]。
先天外中耳畸形婴幼儿早期干预的意义在于能够积累足够多的言语输入量和言语输入质量,这是婴幼儿听觉功能及言语语言学习的必要条件。存在听力损失的外中耳畸形均会一定程度影响婴幼儿的言语、认知、性格的形成及发育,传导性听力损失患儿言语发育迟缓,注意力欠佳,影响其正常社交及工作学习,因此,应尽早对外中耳畸形患儿进行听力诊断和干预[22,23]。
5 外中耳畸形的助听干预与评估验证
永久性传导性听力损失是外中耳传导结构导致听损,排除神经性听力损失,建议在3个月龄内进行听力学诊断并听力干预,因为婴幼儿0~36个月是听觉语言和心智飞跃性发育的关键期,是人听觉皮层和言语中枢可塑性最强的时期,先天性听障儿童听觉助听干预的越早,认知能力发展越好、进步越快[24,25]。笔者在实际临床工作中,最早干预的双侧外耳道闭锁的患儿为出生后28天,经过精准听力检测和助听评估后进行了软带骨导助听器的干预。
依据我国临床干预指南,对单侧外中耳畸形一经确诊听力损失也应该积极干预[19],使患者拥有双耳听觉带来的功能与优势,提高噪音环境下的言语识别,减少单侧外中耳畸形导致的听觉、言语困难及身心疲惫感[26]。
外中耳畸形婴幼儿早期放大干预策略如下:当先天外中耳畸形患儿的耳廓和外耳道足以支持助听器耳模外壳的耦合和助听设备固定时应首选气导助听器[27],见图1。

图1 外中耳畸形患儿配戴定制气导助听器
此类外耳廓、外耳道畸形患者对助听器耳模、外壳的制作要求极高,需要3D扫描打印基础上由有经验工程师手工制作相结合,以确保配戴的牢固性和密封性,建议选择足够增益与输出的双受话器及双重反馈抑制功能的气导助听器[28]。
如果解剖不足以耦合(外耳道闭锁或其它解剖畸形)可用骨导助听器。骨导助听器经皮传导时对1 kHz以上频率声音逐渐衰减,影响言语识别,且经皮传导需要在设备皮肤接触处达到一定的压力才能达到最佳传递效果,因此在骨导助听器种类的选择上,软带式骨传导助听器效果与钢制发卡或眼镜式骨导助听器无差异,且软带配戴舒适,不会导致小龄婴幼儿颅骨变形,黏贴式骨导助听器的贴片式基座比软带的皮肤压力和配戴牢固性更差,可能存在皮肤过敏及经常更换贴片产生的经济成本等问题,故软带式骨传导助听器为1个月~6岁婴幼儿首选配戴方式[29]。
双耳配戴骨导助听器较单耳配戴时的言语接受阈降低、言语识别率提高,但定位能力改善有限,由于两台骨导助听器每台的振动放大都会刺激双侧耳蜗,导致耳间强度差和时间差有限,因此,笔者建议对双侧对称性传导性听损进行双侧配戴助听器。如双侧耳骨导听力相差大于10 dB以上,特别是高频区听力相差较大会导致两台骨导助听器之间相互干扰,影响聆听效果[30]。一侧闭锁一侧未闭,可使用骨导助听器+气导助听器双模干预。
选择骨导助听器时,骨导听力小于10~15 dB可选择小功率骨导助听器;骨导听力在15~40 dB选择大功率骨导助听器;骨导听力40~55 dB选择超大功率骨导助听器;当气骨导差(air-bone gap,ABG)足够大且气导助行器补偿不足时,建议使用超大功率(maximum foree output,MFO>80)的骨导助听器[31]。骨导听力测不出气导极重度听力损失,超大功率骨导助听器经评估无效,符合人工耳蜗植入条件也可植入人工耳蜗。
使用骨导助听器干预时,可以选择NL-NAL1或DSL处方公式进行参数调试,DSL-BC处方公式比NALNL1-BC更少的低频增益;为更严重的混合性听力损失提供更高的增益(和压缩比),特别在高频区,更关注于提高用户的可听范围,且有儿童版本。最大振动输出MFO升高可带来更多自然的声音,因为更大动态范围的声音可被设备拾取放大,骨导助听器输入和输出动态范围的改变,可以有效提高音质、改善失真,提升MFO可以提升13%的工作记忆能力[32]。更高的MFO意味着更好地利用用户的听觉动态范围,在嘈杂的聆听环境中,享受更多自然的声音;更高的MFO可提供更大的动态验配范围/更多声音可以自然放大。当然,更高的增益需要更好的反馈控制功能,更好地克服皮肤对振动能量的衰减。
2013年美国听力学会儿童放大指南中认为骨导助听器无法进行真耳探测麦克风测试,助听听力图可能是最有用的验证方法,尽管助听听力图可以提供的信息有限,但它可能是现有可利用的技术中量化助听反应最有效的方法。外中耳畸形患儿进行助听评估和验证主要有以下方法,主观评估:①行为测听声场评估:根据年龄选择行为观察、视觉强化、游戏测听;②言语评估:根据年龄选择言语测试工具进行儿童封闭式言语觉察阈、言语识别率测试。目前,先天性外中耳畸形由于外观可见,出生后患者家属较为重视,有利于早期进行听力诊断和助听干预,但主观测试对0~6个月大的婴幼儿来说有很大局限性,对于早期干预的婴幼儿配合难度较大,需要反复建立条件化并加以训练。因此客观评估手段显得尤为重要。客观评估包括:①声场下分频ABR、ASSR、听觉皮层诱发电位(CAEP):500 Hz~4 kHz每个倍频程的声场下给声的神经反应阈值[33,34];②骨导助听器可根据气骨、导听力进行应用颅骨模拟器在真耳分析设备的测试箱中进行验证,对助听器各个频率上的55/65/75 dB以及最大输出(MFO)进行测量,还可以对方向麦克风和降噪功能等高级特征进行验证[35]。气导助听器进行真耳分析验证,可以采集患儿RECD值后,在测试箱2CC耦合腔中进行测试,处方公式要输入并应用各频率骨导阈值,避免放大不足。
效果评估还可以通过问卷开展。常见的问卷调查表有格拉斯哥助听器效益评估表(Glasgow hearing aid benefit profile,GHABP)、助听器效果缩略简表(abbreviated profile of hearing aid performance,APHAB)及单侧聋问卷(single-sided deafness questionnaire,SSD)等。此外,针对患儿还有专门的儿童生活质量问卷调查,如儿童受益调查问卷(the Glasgow children’s benefit inventory,GCBI)及儿童聆听困难家庭量表(children’s home inventory of listening difficulties,CHILD)。干预后及时进行复查,每次复查对效果进行主-客观交叉评估验证,每3~6个月进行复查调试,对于1岁以下幼儿,其颅骨未闭合,建议每3个月复查。
未来对先天性外中耳畸形的研究应该进行多中心的临床合作,如病因学诊断需要基因检测技术更加广泛深入的研究,寻找到相关致病基因并进行准确的临床表型和遗传型诊断和预防;涉及综合征的患者面临多部位、多系统病变,如何在最佳时间进行有效的序列治疗方案;对听力学的检测的物理校准、生物学矫准需要广泛的标准化开展;进行体积小型化和更大的振动力级的助听辅具研发和临床应用等。
