cVEMP在极重度听力障碍患儿耳石器功能评估中的价值
2021-07-17腾白玉王晓力杨洋孙凯李红涛梁巍黄伟洛
腾白玉 王晓力 杨洋 孙凯 李红涛 梁巍 黄伟洛
儿童前庭功能障碍(vestibular impairments,VIs)由于症状不明确并具有误导性,往往难以准确评估,儿童眩晕和头晕可以在偏头痛、肠道、眼科疾病或前庭损伤等疾病出现,经历前庭功能障碍的儿童报告症状耐受性和准确性随着年龄变化差异性很大[1]。儿童眩晕和头晕患病率5.3%~8%[2,3],青少年患病率可高达17%[4],而且青少年由于对头晕耐受度比儿童和成年人更好,因此,儿童青少年眩晕和头晕可能会被低估。
由于耳蜗与前庭末梢器官在胚胎学和解剖学上的联系,听障儿童会表现出前庭和平衡功能异常。感音神经性听力损失(sensorineural hearing loss,SNHL)儿童前庭末梢器官功能障碍患病比例可达20%~70%[5],与耳蜗功能损失程度具有相关性[6,7]。随着对前庭器官评价技术的不断增加,儿童人工耳蜗植入患者不断增多,考虑到双侧人工耳蜗植入的安全性和双侧前庭功能损伤潜在风险,对于SNHL儿童前庭末梢器官功能评价越来越受到临床的关注。
儿童前庭功能评价分为主观和客观两种,主观评估技术可以通过量表方式进行,目前儿童眩晕量表相关问卷较多[8],如儿童前庭症状问卷(pediatric vestibular symptom questionnaire,PVSQ)、儿童视觉诱发性眩晕问卷(pediatric visually induced dizziness,PVID)和儿童眩晕障碍调查问卷(dizziness handicap inventory for patient caregivers,DHI-PC),客观评价技术有冷热试验(caloric test)、甩头试验(head impulse test,HIT)/视频头脉冲试验(video head impulse test,vHIT)、转椅测试(rotary chair test)和前庭诱发肌源性电位(vestibular evoked myogenic potential,VEMP),根据记录部位和神经传导反射弧机理,前庭诱发肌源电位包括颈源性和眼源性,分别反映球囊和椭圆囊功能。本研究选用颈源性前庭诱发肌源性电位(cervical vestibular evoked myogenic potential,cVEMP)技术进行研究,分析cVEMP在极重度听力障碍患儿耳石器功能的特征表现,探索该技术在极重度听力障碍患儿干预前后前庭功能评估中的应用价值。
1 材料与方法
1.1 研究对象
实验组:受试者28名(56耳)年龄2~8岁均为极重度听力损失患儿,其中男24人,女4人。鼓室图均为A型图,经过完整听力学检查,结果均被诊断为重度-极重度感音神经性听力损失患儿。受试患儿均采用双模助听干预方式,一侧配戴助听器(hearing aid,HA)组,一侧行人工耳蜗植入(cochlear implant,CI)组。根据受试者影像学资料显示:其中12人内耳系统结构正常;16人存在内耳结构异常,主要包括内听道狭窄、mondini畸形、前庭导水管扩大、双侧前庭增宽、耳蜗神经发育不全、前庭耳蜗半规管融合等。
对照组:受试者为6名(12耳)双耳配戴助听器的在训儿童,年龄2~6岁,听力学检查结果为重度-极重度感音神经性听力损失,双侧鼓室图均为A型图,影像学资料均提示内耳结构正常。实验组和对照组全部受试者均行双侧cVEMP检测。
1.2 cVEMP检测方法
本研究采用测试设备为Neuro-Audio听觉诱发电位仪(Neurosoft LTD.,俄罗斯),检测方法采用与于澜等[9]同样测试协议和方法,测试时采用坐立姿势,患儿坐在椅子上保持身体直立挺直状态,通过IP 30插入式耳机进行给声,记录电极放置于胸锁乳突肌上1/3和上中1/3交界部位,参考电极放置在胸骨上窝部位,地极放置在眉心位置,电阻均小于5 kΩ,刺激速率为5.1 Hz,叠加次数为60次,带通滤波30~2000 Hz,极性为交替给声。刺激声信号采用短纯音500 Hz,短纯音包络选择Blackman窗口,上升、下降和平台时间分别为2 ms,刺激声强度为110 dB nHL,每个强度至少采集2条可重复的曲线进行标记和编辑。
为保证双侧胸锁乳突肌肌张力保持在一致范围,本研究使用肌电图校正软件,设置肌电(electromyogram,EMG)正常参考值范围为30~70 μV,测试时头转向刺激耳的对侧,保持测试耳侧胸锁乳突肌处于强直状态,以让EMG指针保持在绿色区间(正常参考值范围)内,然后开始同侧记录反应信号,测试完毕记录cVEMP测试结果。
1.3 统计学方法
运用SPSS 21.0软件对本次研究结果进行统计学分析,检出率使用描述性统计分析,三组差异比较使用ANOVA方差分析,P<0.05为差异显著。
2 结果
2.1 颈源性前庭诱发肌源性电位(cVEMP)检出率:对照组检出率是100%;HA组检出率为67.80%,32.20%未引出;CI组检出率为39.30%,60.70%未引出,提示未行手术治疗只配戴助听器干预的耳侧,如果存在结构异常的话,同样也可能会出现患儿耳石器功能异常。
2.2 颈源性前庭诱发肌源性电位(cVEMP)波形统计学分析
在全部能够引出颈源性前庭诱发肌源性电位(cVEMP)的结果中,分别评价P1波、N1波潜伏期和P1-N1波间振幅,见图1。对照组上述3个指标平均值分别是12.26 ms、18.33 ms和92.02 μV;植入人工耳蜗组分别是14.00 ms、19.06 ms和88.81 μV;助听器组分别是12.84 ms、18.83 ms和114.80 μV,对三组三个评价指标行ANOVA方差分析,结果是三组间除了P1波潜伏期具有统计学差异外(P=0.003),另外两个指标N1波潜伏期和P1-N1波间振幅均没有统计学差异(P=0.248和P=0.234),见表1。
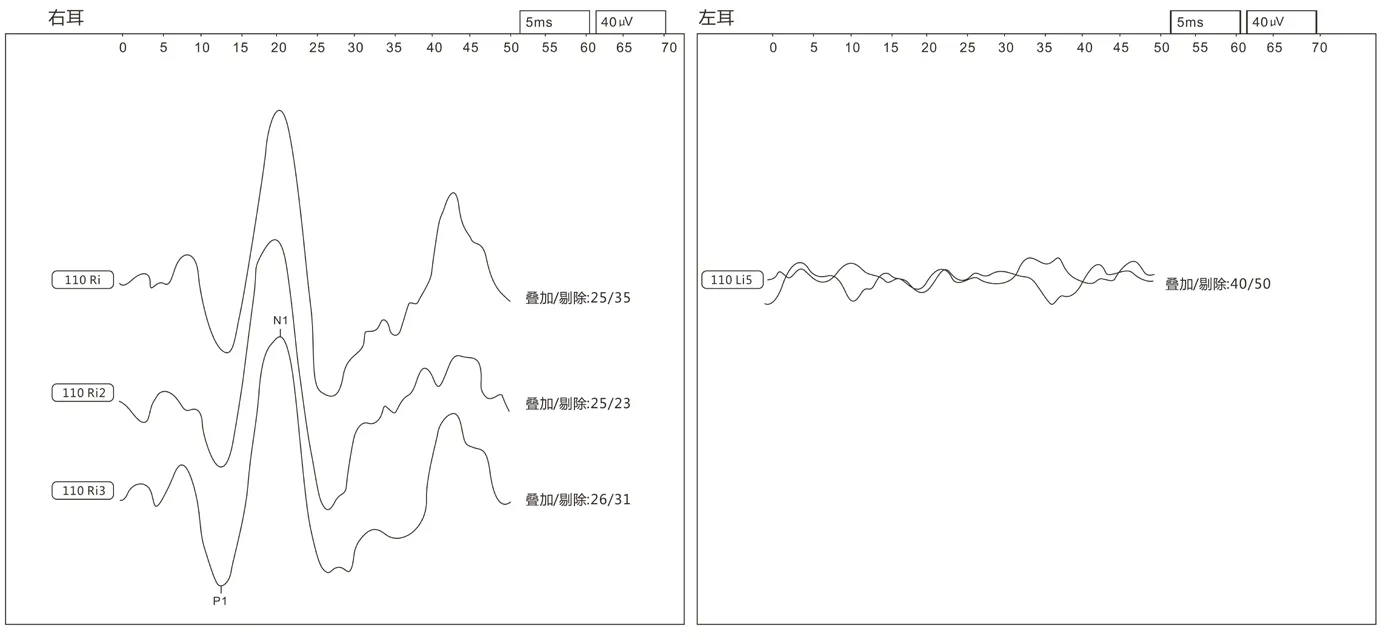
图1 一例3岁10个月患儿双侧cVEMP的结果图示(左侧图示显示正常引出cVEMP,右侧为未引出cVEMP)
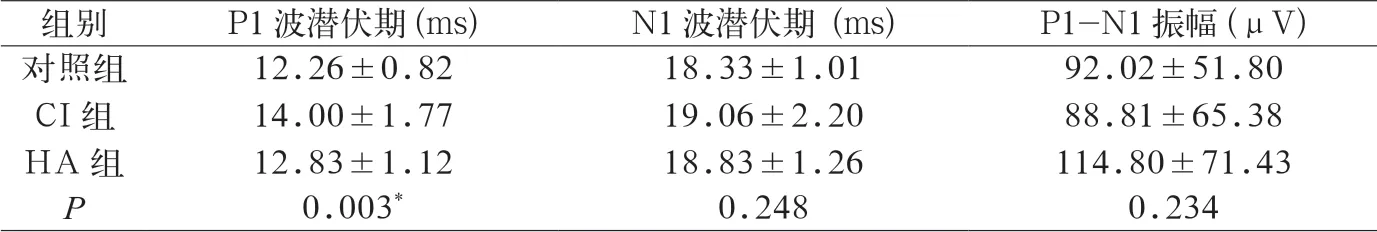
表1 cVEMP 各波潜伏期情况
3 讨论
本研究结果可见,人工耳蜗植入组(CI组)cVEMP未引出率为60.70%,而助听器组(HA组)未引出率为32.20%,提示除了CI手术可能对患儿前庭系统造成影响以外,未行手术治疗的助听器配戴侧的耳石器功能也有约三分之一的患儿功能存在异常,因此,意味着这些孩子可能会因为内耳结构异常而出现前庭功能异常。法国Vacher等[1]针对CI植入术前儿童前庭功能功能评估检测(包括vHIT、转椅和cVEMP等技术),50%受试者具有正常前庭功能,7.5%有对称性前庭功能损失,22.5%有不对称性前庭功能损失和20%双侧完全性前庭功能损失。
3.1 人工耳蜗手术对前庭功能影响
Cushing等[10]研究119例SNHL患儿CI术后发现50%出现水平半规管功能异常;21%出现双侧球囊功能异常,30%出现单侧球囊功能异常。Licameli等[11]对15名儿童在CI术后采用cVEMP球囊功能测试,其中20%患者能引出正常的cVEMP,80%无法引出。徐勇等[12]对17例CI术后1~3年患者行cVEMP检测,关机状态下,76.47%患者未能引出,在非手术耳侧,cVEMP检出率为76%。Vacher等[1]对468名儿童行单侧或双侧CI植入术后发现有78.6%儿童出现前庭功能异常。Ibrahim等[13]对CI手术对前庭功能影响荟萃分析研究发现,术后球囊功能异常(cVEMP异常结果)比例从17.64%[14]到80%[15]不等,见表2。
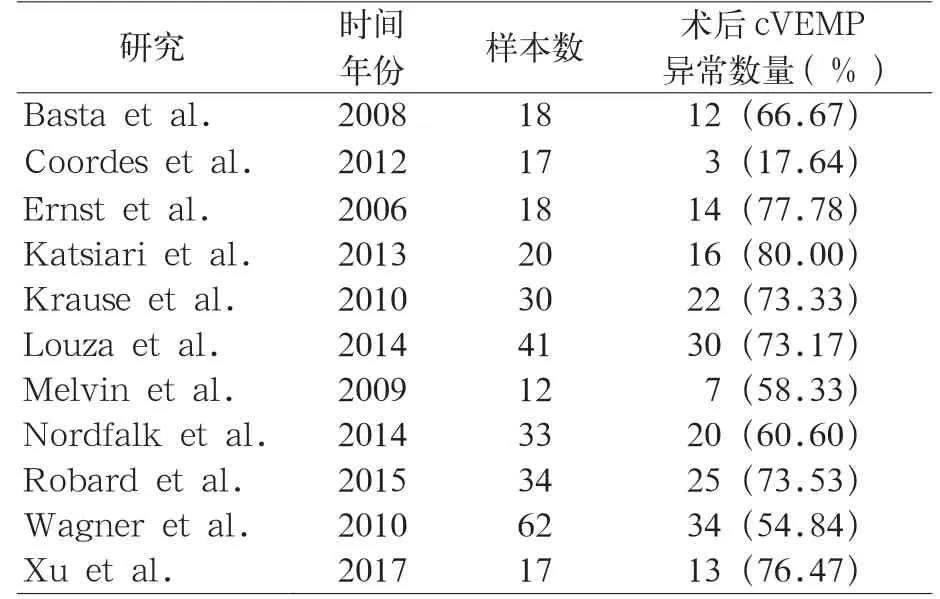
表2 不同学者采用cVEMP 技术对CI 术后患者检测所得异常率汇总[13]
复习文献,尽管CI手术对前庭功能影响的报道各不相同,但关于球囊功能较为一致的说法是cVEMP引出代表球囊功能正常,引不出(包括低振幅)代表球囊功能异常。对应本研究结果,人工耳蜗植入术后cVEMP无法引出在手术侧(CI组)占比约60.7%,与文献报道一致(见表2),因此提示手术过程中的损伤可能是术后球囊功能异常的重要影响因素。而非手术侧(HA组)在本研究中仍有32.2%未引出,而影像学正常的对照组未引出的比例为0%,因此提示除了手术损伤的影响,患儿内耳结构的问题也可能是导致球囊功能异常的重要原因。对于进一步研究导致术后球囊功能异常的可能性原因,建议针对需要进行人工耳蜗植入术的患儿,术前、术后可以常规进行前庭功能评估,才能更全面的了解患儿平衡功能的变化,补充更多的病例信息。
3.2 CI术后眩晕发生情况
李玉洁等[16]对1396例(其中0.7~7岁患儿比例为86.2%)人工耳蜗手术术后出现眩晕比例是16.55%,李静等[17]对178例人工耳蜗植入患者术后发生眩晕临床特点进行研究,发现内耳畸形患者眩晕发生率为41.2%,无畸形为3.7%,其中mondini畸形患者5例中3例发生眩晕(3/5,60%),大前庭导水管畸形12例中有4例发生眩晕(4/12,33.33%),笔者通过临床调查统计发现,人工耳蜗植入术后发生眩晕主要与年龄有关,年龄越大越易发生眩晕,有内耳畸形患者较无畸形患者发生率高,并认为年龄大儿童眩晕发生可能与小儿神经反射不健全有关。李琦等[18]分析了国内外相关文献,认为人工耳蜗手术会引起轻度水平半规管和球囊损伤,也可能是在CI手术操作过程中植入电极引起的直接创伤,破坏了迷路结果所致。
3.3 听力损失和内耳畸形对前庭功能影响
Vacher等[1]对1022名非CI手术SNHL儿童行前庭功能评价,发现有54.5%患儿存在前庭功能障碍,其中出现VI患儿主要集中在巨细胞病毒(cytomegalovirus,CMV)感染、内耳畸形(inner ear malformation)、遗传性综合征(如Usher、CHARGE、Waardenburg、Pendred综合征)等病患,其中20%患儿具有双侧完全性前庭损失,另外80%具有部分前庭功能损失或正常前庭功能,内耳畸形患儿中有67.8%出现前庭功能障碍,该群患儿在行人工耳蜗植入术后发生前庭功能障碍风险也要比结构正常耳高(内耳畸形为35%和正常耳为10%)。Bernard等[19]对一组52例CMV儿童前庭功能评估后,发现92.3%儿童前庭功能受累,其中33.3%双侧完全障碍,43.7%部分双侧障碍,22.9%部分单侧障碍。本研究中HA组受试者,均是配戴了助听器作为干预方式,没有手术损伤可能影响,32.2%患儿cVEMP未能引出,提示存在球囊功能异常,HA组患儿中有过半数(16/28,57.14%)存在内耳结构异常,可能是导致球囊功能异常的原因,因此,对于那些采用HA干预同时存在内耳结构异常的极重度SNHL患儿很有必要对前庭功能进行评价。
非综合征听力障碍患者伴有前庭功能障碍情况较少,常见致聋DFNB1基因(Connexin 26)也较少影响前庭功能,DFNB3基因(POUF4)与内听道扩大有关并伴有渐进性前庭功能障碍,DFNB9基因(otoferlin)则没有影响前庭功能,DFNB4与Pendred综合征相同内耳畸形有关。国外多个学者对需行CI植入术的患儿术前行VEMP检测,结果发现术前VEMP检测结果异常比例从11.1%[20~22]到50%[13],而本研究中HA组中则有32.20%cVEMP异常结果,提示如果患儿存在结构异常的话,出现球囊功能异常的可能性也会更高。
4 结论
不管是CI植入侧还是配戴助听器侧,极重度SNHL患儿都有较高耳石器功能异常率,前庭诱发肌源性电位(cVEMP)是一个简易、快捷检测患者耳石器功能的客观评价技术,可为患儿制定康复训练时行前庭康复训练提供客观依据,本研究由于测评样本量有限,所得数据和结果可能会存在一定局限性,但可为未来探索极重度SNHL患儿耳石器功能临床研究工作提供参考。
