全反式视黄酸诱导ARPE-19细胞凋亡的信号途径
2021-07-16吴娟崔冬梅杨晓曾骏文
吴娟 崔冬梅 杨晓 曾骏文
中山大学中山眼科中心 眼科学国家重点实验室,广州 510060
视觉循环也被称为类维生素A循环,是人类视觉的基础。全反式视黄酸(all-trans retinoic acid,ATRA)是维生素A的代谢产物[1],对维生素A的代谢是视网膜色素上皮(retinal pigment epithelium,RPE)细胞的主要功能之一[2-3]。RPE细胞也可为光感受器细胞提供营养,维持光感受器外段的日常吞噬作用,使其保持兴奋性并实现自我更新[4-5]。由于光感受器外段的吞噬作用、特殊的解剖位置和高代谢活性,RPE细胞尤其容易受到损害[6]。研究发现,ATRA在RPE细胞内的过度积累可引起细胞毒性并导致细胞凋亡[7-8],使眼底发生变性疾病。既往研究表明,由ATRA诱导并通过NADPH氧化酶介导的活性氧簇(reactive oxygen species,ROS)参与了光感受器和RPE细胞的变性退化[9],但关于RPE细胞变性的分子机制仍不清楚。本研究拟探讨ATRA体外诱导ARPE-19细胞凋亡的信号途径,以期为视网膜病变中ATRA的毒性作用提供参考依据。
1 材料与方法
1.1 材料
ARPE-19细胞系购自美国ATCC细胞库。DMEM/F12培养基、质量分数0.25%胰蛋白酶-乙二胺四乙酸(ethylenediamine tetraadetic acid,EDTA)(美国Gibco公司);胎牛血清(bovine serum albumin,BSA)、ATRA、二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma公司);青链霉素(100 μg/ml)、Trizol试剂(美国Invitrogen公司);细胞计数试剂盒-8(cell counting kit-8,CCK8)(日本Dojindo公司);膜联蛋白V-荧光素异硫氰酸盐(annexin V-fluorescein isothiocyanate,Annexin-V)凋亡试剂盒(美国Becton公司);Multicaspase分析试剂盒(MCH100109)、ROS检测试剂盒、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Merck Millipore公司);Powerwave XS微孔板分光光度计(美国BioTek公司);Brilliant SYBR Green试剂盒(日本Takara公司);引物序列(上海Sangon Biotech公司);RIPA裂解缓冲液(上海碧云天公司);兔源caspase 12单克隆抗体(ab62484)、兔源caspase 3单克隆抗体(ab90437)(美国Abcam公司);兔源caspase 8单克隆抗体(#4790)、兔源caspase 9单克隆抗体(ab669514)、兔源cleaved caspase 3单克隆抗体(#9964)、兔源GAPDH单克隆抗体(#5174)(美国Cell Signaling Technology公司)。流式细胞仪(美国Beckman公司);ECL蛋白印迹检测系统(美国Millipore公司);酶标仪(日本Olympus公司);Quantity One成像软件、实时荧光定量PCR检测系统(美国Bio-Rad公司)。
1.2 方法
1.2.1细胞培养 ARPE-19细胞用含质量分数10% BSA、青链霉素的DMEM/F12培养基,置于37 ℃、体积分数5% CO2的加湿培养箱中培养。每2~3 d更换1次培养基。采用0.25%胰蛋白酶-EDTA溶液消化2 min,在25 mm2培养瓶中以1∶ 4~1∶ 6传代培养。在100 mm2培养皿中培养至70%~80%融合,提取蛋白质。
1.2.2ATRA制备 将ATRA溶解于DMSO至1×10-2mol/L,分装成10 ml于-20 ℃下冷冻保存,避光,使用前使用DMEM/F12稀释ATRA至工作浓度。
1.2.3ARPE-19细胞形态变化观察 将ARPE-19细胞以2.5×105/ml密度接种于6孔板,分别采用0、2.5、5、10和20 μmol/L ATRA处理细胞24 h,观察不同ATRA浓度下ARPE-19细胞形态变化。
1.2.4CCK-8法检测细胞存活率 将ARPE-19细胞以5×104/ml密度接种至96孔板中,培养基为100 μl。在含有10% BSA的DMEM/F12培养基中预培养24 h后,分别添加0、2、4、6、8、10、12、14、16、18和20 μmol/L ATRA进行实验,其中不添加ATRA者设为空白对照组。培养24 h或48 h后,去除上清液,每孔加入含有10 μl CCK8的DMEM/F12 100 μl,在37 ℃下再培养4 h。采用CCK-8法检测细胞增生情况,使用微孔板阅读器在450 nm处测量吸光度(A)值。所有实验均独立重复3次。CCK-8细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.2.5流式细胞术检测细胞凋亡水平 采用Annexin-V凋亡试剂盒检测细胞凋亡水平。取ARPE-19细胞以2.5×105/ml密度接种于6孔板,分别采用0、2.5、5、10、15和20 μmol/L ATRA处理细胞,其中不添加ATRA者设为空白对照组,处理24 h后收集细胞培养液备用,使用0.25%胰蛋白酶消化收集细胞,用预冷磷酸盐缓冲液(phosphate buffer saline,PBS)洗1次,离心半径13.5 cm,1 000 r/min离心3 min收集细胞,预冷PBS洗1次,收集细胞并将其悬浮在含有Annexin-V和碘化丙啶(propidium iodide,PI)的1倍结合缓冲液中30 min,用流式细胞仪在488 nm激发波长下检测红色荧光及光散射情况,根据阴性对照组设定阴性对照区,检测各分区的数值,所有实验独立重复3次。
1.2.6流式细胞术检测细胞multicaspase水平 采用Multicaspase分析试剂盒快速测定caspase的激活、细胞质膜渗透和细胞死亡情况。取ARPE-19细胞以2.5×105/ml密度接种于6孔板,分别采用0、2.5、5、10和20 μmol/L ATRA处理细胞,其中不添加ATRA者设为空白对照组,处理后24 h收集细胞培养液备用,使用0.25%胰蛋白酶-EDTA溶液消化收集细胞,用预冷PBS洗1次,1 000 r/min离心3 min收集细胞,预冷PBS洗1次,每组加入含有7-氨基放线菌素D(7-Aminoactinomycin D,7-AAD)和PI的1倍结合缓冲液,孵育30 min,用流式细胞仪在488 nm激发波长下检测红色荧光及光散射情况,根据阴性对照组设定阴性对照区,检测各分区的数值,列入统计计算的为死细胞区+晚凋细胞区+早凋细胞区,所有实验独立重复3次。
1.2.7流式细胞术检测细胞ROS水平 采用DCFH-DA染色法检测总ROS水平。取ARPE-19细胞以2.5×105/ml密度接种于6孔板,分别采用0、2.5、5、10和20 μmol/L ATRA处理细胞,其中不添加ATRA者设为空白对照组,处理后24 h收集细胞培养液备用,使用0.25%胰蛋白酶-EDTA溶液消化收集细胞,用预冷PBS洗1次,1 000 r/min离心3 min,收集细胞,预冷PBS洗1次,每组加入1 μmol/L ROS和荧光探针DCFH-DA孵育30 min,用流式细胞仪在488 nm激发波长下检测红色荧光及光散射情况,红色波形代表ROS阳性细胞,荧光染色阳性数值即为ROS水平。所有实验独立重复3次。
1.2.8实时荧光定量PCR检测caspase相关靶基因mRNA相对表达量 取ARPE-19细胞以2.5×105/ml密度接种于6孔板,分别采用0、2.5、5、10和20 μmol/L ATRA处理细胞,其中不添加ATRA者设为空白对照组,处理后24 h收集细胞培养液备用,使用Trizol试剂提取细胞总RNA,采用Brilliant SYBR Green试剂盒进行实时荧光定量PCR反应。引物序列由中国上海Sangon Biotech公司提供(表1)。空白对照组(无cDNA)每个基因没有扩增,Ct值大于33。对至少3个不同的实验样品进行实时荧光定量PCR反应,并对每个样品进行3次评估。以GAPDH为内参,采用2-ΔΔCt法计算每个靶基因的相对表达量。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences of quantitative real-time PCR基因基因库号码引物序列(5’-3’)扩增片段长度(bp)Caspase 3 NM_004346 正向:CATGGAAGCGAATCAATGGACT反向:CTGTACCAGACCGAGATGTCA139 Caspase 8 NM_033356 正向:GTTGTGTGGGGTAATGACAATCT反向:TCAAAGGTCGTGGTCAAAGCC222 Caspase 9 NM_001229.4 正向:CTCAGACCAGAGATTCGCAAAC反向:GCATTTCCCCTCAAACTCTCAA116 Caspase 12 NM_001191016.2 正向:AACAACCGTAACTGCCAGAGT反向:CTGCACCGGCTTTTCCACT118 GAPDH NM_001256799.2 正向:GGAGCGAGATCCCTCCAAAAT反向:GGCTGTTGTCATACTTCTCATGG197 注:PCR:聚合酶链式反应;GAPDH:甘油醛-3-磷酸脱氢酶 Note:PCR:polymerase chain reaction;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
1.2.9Western blot法检测caspase相关靶蛋白相对表达量 采用0、2.5、5、10、15和20 μmol/L ATRA处理ARPE-19细胞后24 h收集细胞,PBS洗涤后RIPA裂解缓冲液溶解细胞,用SDS-PAGE凝胶电泳。将蛋白质转移至PVDF膜,并在室温下用质量分数5%脱脂牛奶封闭1 h。用质量分数5% BSA稀释caspase 12(1∶ 1 000)、caspase 3(1∶ 1 000)、caspase 8(1∶ 1 000)、caspase 9(1∶ 1 000)、cleaved caspase 3(1∶ 1 000)、GAPDH(1∶ 500)抗体,摇床上孵育30 min,4 ℃过夜,孵育时间不少于12 h,TBST洗膜5 min共3次。置于HRP标记的山羊抗兔二抗中摇床上孵育1 h,采用ECL化学发光法显色,使用Bio-Rad Quantity One成像软件分析条带。
1.3 统计学方法
采用SPSS 20.0统计学软件和GraphPad Prism 6图形软件进行统计分析和作图。计量资料数据经W检验证实呈正态分布,以mean±SD表示;经Levene检验方差齐性。各组细胞生存率和凋亡率、multicaspase水平、ROS水平及caspase相关mRNA和蛋白相对表达量总体比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度ATRA对ARPE-19细胞活性的影响
ARPE-19细胞在ATRA浓度为2.5 μmol/L和5 μmol/L时形态保持正常,10 μmol/L时细胞开始皱缩,20 μmol/L时细胞皱缩明显,数量显著下降(图1)。CCK-8法检测结果提示,不同浓度ATRA处理ARPE-19细胞24 h和48 h细胞存活率总体比较差异均有统计学意义(F=176.60、350.30,均P<0.01)。2 μmol/L、6 μmol/L ATRA组细胞培养24 h和48 h后细胞存活率较空白对照组升高,差异均有统计学意义(均P<0.05);细胞培养24 h时,12、14、16、18、20 μmol/L ATRA组细胞存活率低于空白对照组,细胞培养48 h时,10、12、14、16、18、20 μmol/L ATRA组细胞存活率低于空白对照组,差异均有统计学意义(均P<0.01);20 μmol/L ATRA处理24 h后细胞存活率下降到30%以下(表2)。ATRA对细胞存活具有剂量依赖性,高剂量抑制细胞存活,ATRA处理24 h和48 h后的半数抑制浓度(half maximal inhibitory concentration,IC50)分别为13.88 μmol/L和11.99 μmol/L,选择处理24 h进行后期实验。

图1 不同浓度ATRA处理ARPE-19细胞24 h细胞形态变化(标尺=50 μm) A:0 μmol/L ATRA B:2.5 μmol/L ATRA C:5 μmol/L ATRA D:10 μmol/L ATRA E:20 μmol/L ATRA
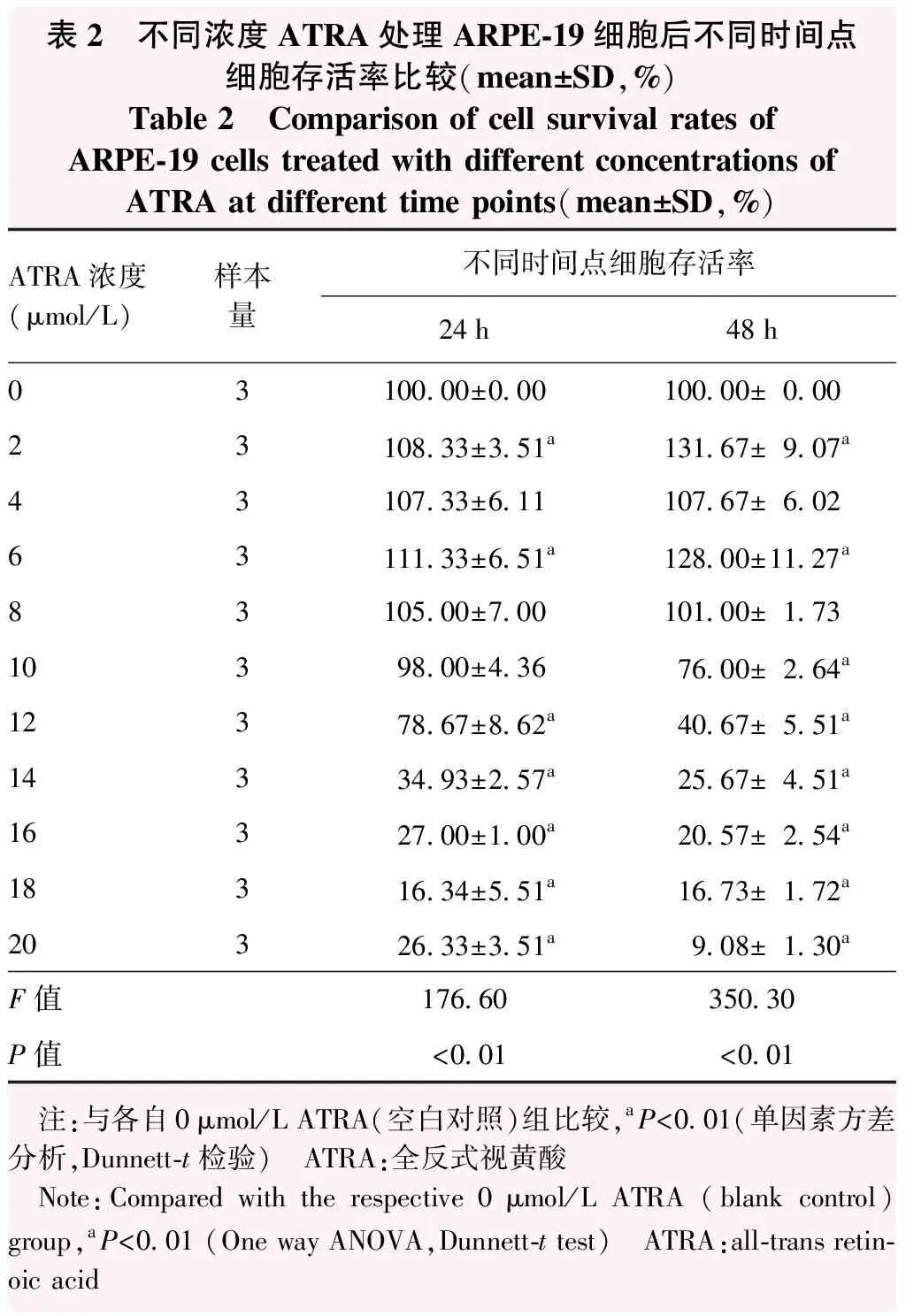
表2 不同浓度ATRA处理ARPE-19细胞后不同时间点细胞存活率比较(mean±SD,%)Table 2 Comparison of cell survival rates of ARPE-19 cells treated with different concentrations of ATRA at different time points(mean±SD,%)ATRA浓度(μmol/L)样本量不同时间点细胞存活率24h48h03100.00±0.00100.00±0.0023108.33±3.51a131.67±9.07a43107.33±6.11107.67±6.0263111.33±6.51a128.00±11.27a83105.00±7.00101.00±1.7310398.00±4.3676.00±2.64a12378.67±8.62a40.67±5.51a14334.93±2.57a25.67±4.51a16327.00±1.00a20.57±2.54a18316.34±5.51a16.73±1.72a20326.33±3.51a9.08±1.30aF值176.60350.30P值<0.01<0.01 注:与各自0μmol/L ATRA(空白对照)组比较,aP<0.01(单因素方差分析,Dunnett-t检验) ATRA:全反式视黄酸 Note:Compared with the respective 0μmol/L ATRA (blank control) group,aP<0.01 (One way ANOVA,Dunnett-t test) ATRA:all-trans retin-oic acid
2.2 不同浓度ATRA对ARPE-19细胞凋亡及细胞中multicaspase和ROS水平的影响
0、2.5、5、10、15、20 μmol/L ATRA处理后 ARPE-19细胞凋亡率分别为(7.52±0.00)%、(5.81±0.13)%、(3.93±0.07)%、(19.31±4.47)%、(51.79±7.35)%和(56.42±6.69)%,总体比较差异有统计学意义(F=86.39,P<0.01),其中2.5 μmol/L和5 μmol/L ATRA组细胞凋亡率较空白对照组明显下降,10、15和20 μmol/L ATRA组细胞凋亡率呈浓度依赖性升高,差异均有统计学意义(均P<0.01),当ATRA浓度高于10 μmol/L时,细胞凋亡率明显上调。不同浓度ATRA处理ARPE-19细胞24 h后细胞multicaspase和ROS相对表达量总体比较差异均有统计学意义(F=166.84、101.40,均P<0.01)。2.5、5、10、20 μmol/L ATRA组multicaspase和ROS的相对表达量均较空白对照组升高,差异均有统计学意义(均P<0.01)(图2,表3)。

图2 流式细胞仪检测不同浓度ATRA组ARPE-19细胞凋亡及细胞中multicaspase、ROS水平 A:凋亡水平检测 B:multicaspase水平检测 C:ROS水平检测 7-AAD:7-氨基放线菌素D;ROS:活性氧簇;ATRA:全反式视黄酸
2.3 不同浓度ATRA处理ARPE-19细胞中caspase相关靶基因mRNA和蛋白相对表达量比较
Western blot检测结果显示,不同浓度ATRA组caspase 8蛋白相对表达量总体比较,差异无统计学意义(F=2.91,P=0.06);caspase 9、caspase 12、caspase 3、cleaved-caspase 3蛋白相对表达量总体比较差异均有统计学意义(F=10.31、8.19、3.78、138.51,均P<0.05)。与空白对照组比较,2.5、5、10、15、20 μmol/L ATRA组caspase 9蛋白相对表达量升高,差异均有统计学意义(均P<0.01);2.5 μmol/L ATRA组caspase 12蛋白相对表达量升高,5、10、15、20 μmol/L ATRA组逐渐降低,2.5、15、20 μmol/L ATRA组差异均有统计学意义(均P<0.05)。与空白对照组比较,5、10、20 μmol/L ATRA组caspase 3蛋白相对表达量升高,差异均有统计学意义(均P<0.05)。与空白对照组比较,2.5、5、10、15、20 μmol/L ATRA组cleaved caspase 3蛋白相对表达量显著升高,差异均有统计学意义(均P<0.01)(图3,表4)。

图3 Western blot法检测不同浓度ATRA组caspase 8、caspase 9、caspase 12、caspase 3及cleaved caspase 3表达水平 1:0 μmol/L ATRA组;2:2.5 μmol/L ATRA组;3:5 μmol/L ATRA组;4:10 μmol/L ATRA组;5:15 μmol/L ATRA组;6:20 μmol/L ATRA组 GAPDH:甘油醛-3-磷酸脱氢酶
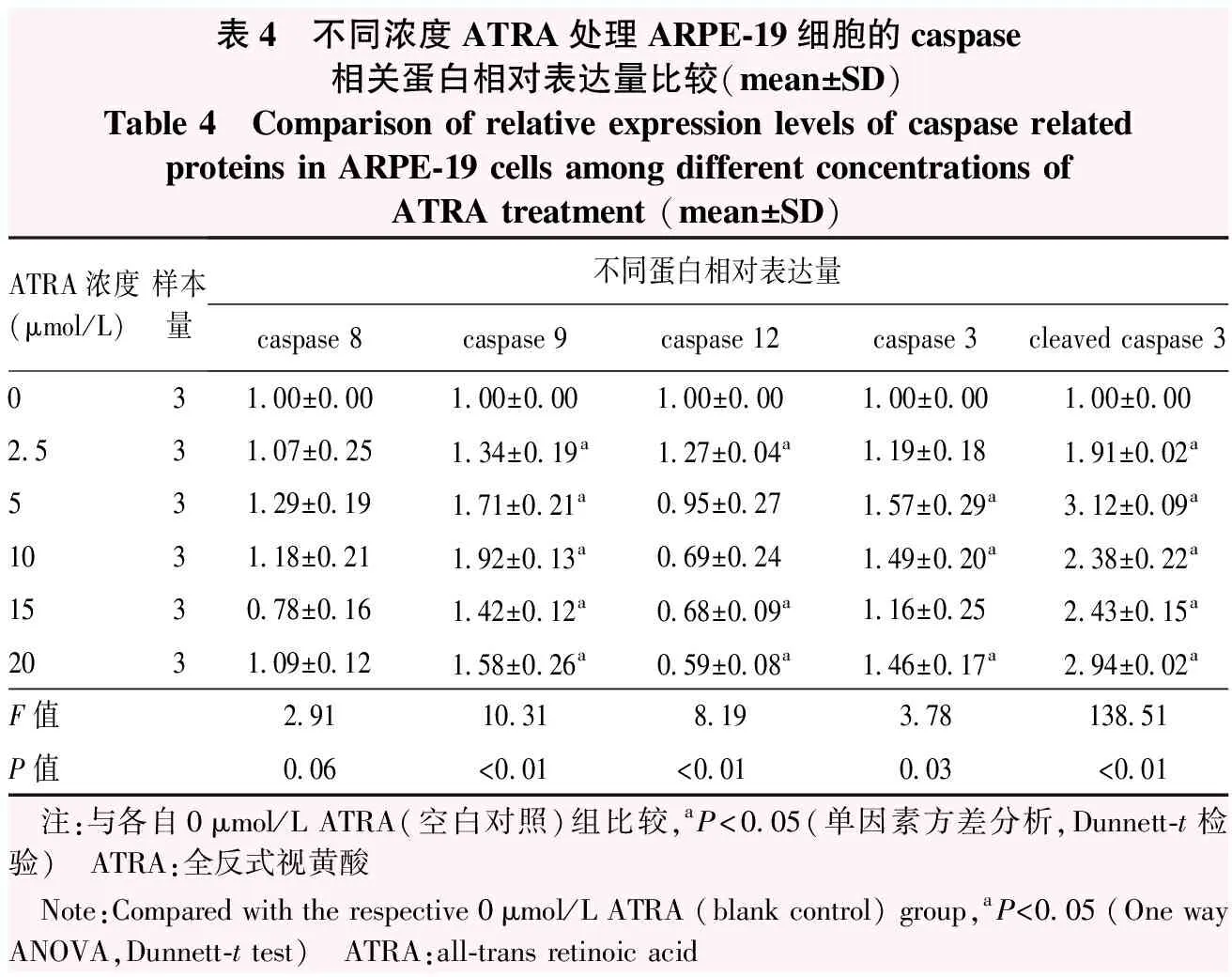
表4 不同浓度ATRA处理ARPE-19细胞的caspase相关蛋白相对表达量比较(mean±SD)Table 4 Comparison of relative expression levels of caspase related proteins in ARPE-19 cells among different concentrations of ATRA treatment (mean±SD)ATRA浓度(μmol/L)样本量不同蛋白相对表达量caspase 8caspase 9caspase 12caspase 3cleaved caspase 3031.00±0.001.00±0.001.00±0.001.00±0.001.00±0.002.531.07±0.251.34±0.19a1.27±0.04a1.19±0.181.91±0.02a531.29±0.191.71±0.21a0.95±0.271.57±0.29a3.12±0.09a1031.18±0.211.92±0.13a0.69±0.241.49±0.20a2.38±0.22a1530.78±0.161.42±0.12a0.68±0.09a1.16±0.252.43±0.15a2031.09±0.121.58±0.26a0.59±0.08a1.46±0.17a2.94±0.02aF值2.9110.318.193.78138.51P值0.06<0.01<0.010.03<0.01 注:与各自0μmol/L ATRA(空白对照)组比较,aP<0.05(单因素方差分析,Dunnett-t检验) ATRA:全反式视黄酸 Note:Compared with the respective 0μmol/L ATRA (blank control) group,aP<0.05 (One way ANOVA,Dunnett-t test) ATRA:all-trans retinoic acid
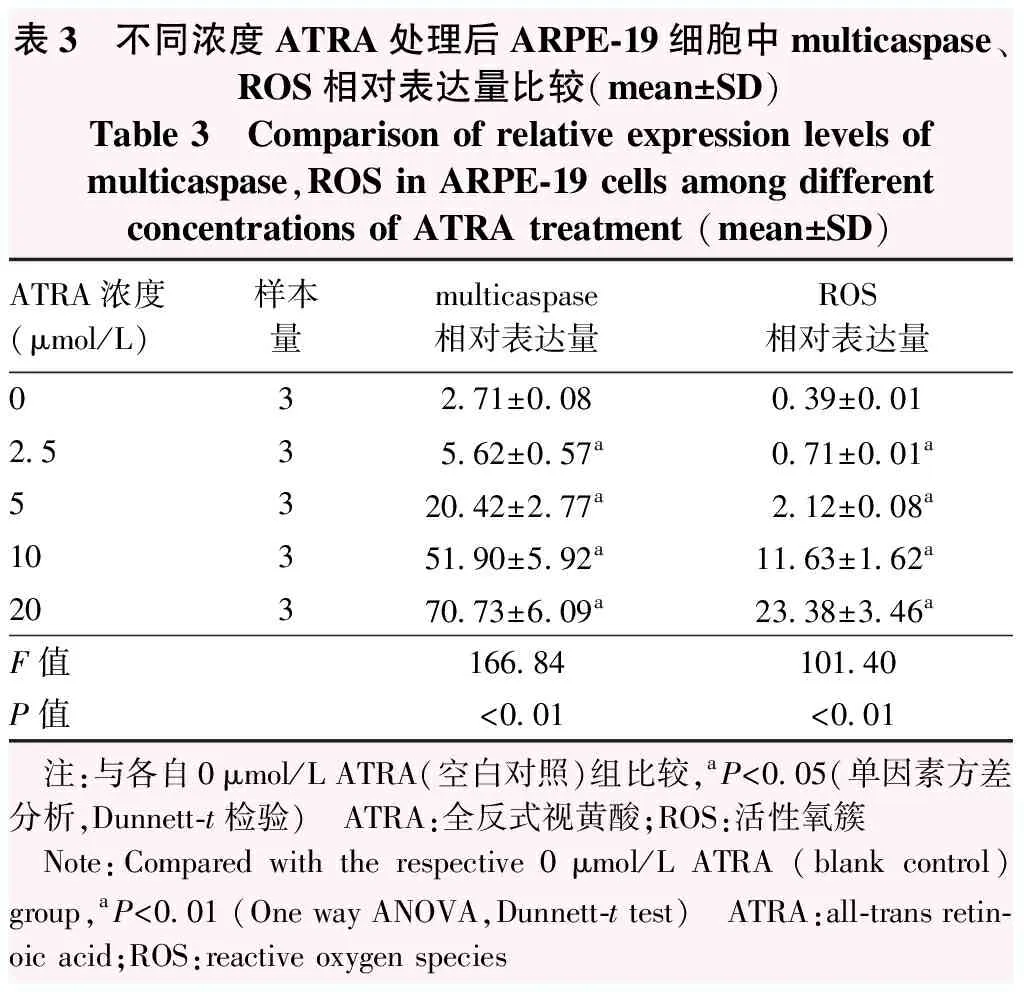
表3 不同浓度ATRA处理后ARPE-19细胞中multicaspase、ROS相对表达量比较(mean±SD)Table 3 Comparison of relative expression levels of multicaspase,ROS in ARPE-19 cells among different concentrations of ATRA treatment (mean±SD)ATRA浓度(μmol/L)样本量multicaspase相对表达量ROS相对表达量032.71±0.080.39±0.012.535.62±0.57a0.71±0.01a5320.42±2.77a2.12±0.08a10351.90±5.92a11.63±1.62a20370.73±6.09a23.38±3.46aF值166.84101.40P值<0.01<0.01 注:与各自0μmol/L ATRA(空白对照)组比较,aP<0.05(单因素方差分析,Dunnett-t检验) ATRA:全反式视黄酸;ROS:活性氧簇 Note:Compared with the respective 0μmol/L ATRA (blank control) group,aP<0.01 (One way ANOVA,Dunnett-t test) ATRA:all-trans retin-oic acid;ROS:reactive oxygen species
实时荧光定量PCR结果显示,不同浓度ATRA组caspase 8 mRNA相对表达量总体比较差异无统计学意义(F=3.02,P=0.07),caspase 9、caspase 12、caspase 3 mRNA相对表达量总体比较差异均有统计学意义(F=212.90、60.85、32.77,均P<0.01)。与空白对照组比较,2.5、5、10、20 μmol/L ATRA组caspase 9 mRNA相对表达量明显升高,差异均有统计学意义(均P<0.01);2.5 μmol/L及5 μmol/L ATRA组caspase 9 mRNA相对表达量逐渐升高,随着浓度继续升高其相对表达量逐渐下降;2.5、5、10、20 μmol/L ATRA组caspase 12 mRNA相对表达量较空白对照组明显升高,差异均有统计学意义(均P<0.01),2.5、5及10 μmol/L ATRA组其相对表达量逐渐升高,20 μmol/L ATRA组其相对表达量轻度下降;5 μmol/L、10 μmol/L ATRA组caspase 3 mRNA相对表达量较空白对照组明显升高,差异均有统计学意义(均P<0.01);ATRA浓度小于10 μmol/L时,caspase 9和caspase 12的mRNA相对表达量呈浓度依赖性升高,当浓度达20 μmol/L时,其相对表达量呈下降趋势(表5)。

表5 不同浓度ATRA处理ARPE-19的caspase 8、caspase 9、caspase 12、caspase 3 mRNA相对表达量比较(mean±SD)Table 5 Comparison of the relative expression levels of caspase 8,caspase 9,caspase 12 and caspase 3 mRNA in ARPE-19 cells among different concentrations of ATRA treatment (mean±SD)ATRA浓度(μmol/L)样本量不同mRNA相对表达量caspase 8caspase 9caspase 12caspase 3031.00±0.001.00±0.001.00±0.001.00±0.002.530.97±0.034.49±0.19a1.73±0.19a1.02±0.10531.16±0.2016.33±1.60a2.16±0.26a1.23±0.04a1031.18±0.0811.30±0.66a4.98±0.73a1.26±0.04a2031.03±0.061.78±0.23a2.63±0.70a0.83±0.04aF值3.02212.9060.8532.77P值0.07<0.01<0.01<0.01 注:与各自0μmol/L ATRA(空白对照)组比较,aP<0.01(单因素方差分析,Dunnett-t检验) ATRA:全反式视黄酸 Note:Compared with the respective 0μmol/L ATRA (blank control) group,aP<0.01(One way ANOVA,Dunnett-t test) ATRA:all-trans retinoic acid
3 讨论
ATRA是视觉循环中不可缺少的部分,但是过度累积也会造成光感受器细胞和RPE细胞的凋亡。作为视网膜内的一种内源性化合物,ATRA可通过视黄醛脱氢酶还原而被清除,或形成一系列困在RPE细胞溶酶体中的视网膜衍生物[10-11]。其可以解释RPE细胞对低浓度的ATRA耐受,光感受器细胞和RPE细胞有一套内在的机制清除游离ATRA,但当ATRA过度累积会导致RPE细胞受损,最终引起细胞凋亡。
本课题组之前的研究已证实,1×10-9~1×10-6mol/L ATRA可激活ARPE-19细胞中的丝裂原活化蛋白激酶途径,从而调节细胞增生[12],推测低浓度ATRA可能促进细胞增生,减少细胞凋亡,与本研究中低浓度ATRA降低凋亡水平结果相符。流式细胞术检测结果显示,随着ATRA浓度的升高,multicaspase水平及ROS水平显著升高。Western blot及实时荧光定量PCR检测结果显示,caspase 9、caspase 12、caspase 3及cleaved caspase 3分子在凋亡过程中被激活,而caspase 8分子未被激活,说明ATRA过量累积激活了ARPE-19细胞内源性caspase依赖性凋亡途径。
氧化应激可由ROS引起,持续过度的ROS产生和有限的抗氧化屏蔽可产生氧化应激,与各种生物反应,如凋亡相关[13-14]。研究表明,过多的ROS可引起线粒体功能紊乱,导致线粒体膜电位耗散和细胞凋亡[14]。先前的研究表明,经ATRA处理的细胞表现出明显的线粒体膜电位下降[15]。任何通过线粒体呼吸链的电子传递损伤都会导致氧的不完全还原,最终导致ROS的形成[16],这可以解释ROS在线粒体中定位的原因。ATRA诱导线粒体中的ROS过度产生可能是直接导致线粒体功能障碍的另一种途径。
细胞凋亡包括内源性途径(线粒体途径)、外源性途径、细胞毒性CD8+T细胞介导途径和caspase途径,所有途径均以caspase激活为最终手段。细胞凋亡过程中caspase活化和线粒体释放细胞色素C(cytochrome C,CytC)的相对时间决定了细胞凋亡的2条主要途径:(1)外源途径 通过激活死亡受体,效应器caspase在线粒体改变之前被激活;(2)内在途径 CytC在caspase激活之前从线粒体膜间隙释放。值得注意的是,caspase 3是最重要的效应蛋白caspase,2种途径通过caspase 3融合[17-18]。
Caspase是含有半胱氨酸蛋白酶的一个促细胞凋亡家族,该家族通常以无活性酶原形式存在于细胞中,由于caspase可自我活化并能相互激活,因此凋亡过程一旦触发,即呈级联放大效应。Caspase 9位于级联反应上游,当凋亡起始信号作用于线粒体后,引起线粒体释放CytC,接着CytC与凋亡蛋白酶活化因子-1(apoptotic protease activating factor,Apaf-1)结合并使Apaf-1构象改变形成八聚体,后者与caspase 9结合并诱导其发生自我催化,活化的caspase 9进一步激活下游的caspase,使级联反应进一步放大,因此caspase 9是细胞线粒体依赖的凋亡途径中重要起始因子[19]。Canton等[20]用补骨脂素联合A波段紫外线的暴露疗法处理淋巴细胞株Jurkat细胞发现,caspase 9激活与线粒体功能障碍密切相关。
Rao等[21]用布雷菲德菌素A和毒胡萝卜素作用于293T细胞时发生内质网应激,最后引起细胞凋亡,经检测caspase 12的含量明显增加,而用三苯氧胺诱导的细胞凋亡并未引起内质网应激,相应的caspase 12含量未发生变化。Nakagawa等[22]研究发现,减少体外培养的神经胶质细胞氧和葡萄糖的摄入,引起内质网应激,导致caspase 12被切割成了许多片段而被激活。这些研究结果都证明,caspase 12的激活是内质网应激引起的凋亡途径之一,其可以引起其他caspase家族活化。Sanges等[23]研究发现,当视网膜出现变性时,细胞内部出现钙离子储存失衡,导致钙蛋白酶激活,影响线粒体系统导致凋亡诱导因子产生,同时影响内质网系统产生caspase 12。本研究中,ATRA诱导后caspase 12蛋白表达量下降,mRNA表达量上升,说明在凋亡过程中,caspase 12很有可能激活后被切割成了片段,从而引起内质网应激反应。Datta等[24]研究证实,激活的caspase 12从内质网进入到细胞液中作用于caspase 9,激活caspase 3最后引起细胞凋亡。Hitomi等[25]也认为,caspase 12直接激活了caspase 3最后引起细胞凋亡。在所有caspase家族中,最频繁激活的是caspase 3,进而形成cleaved caspase 3,其催化主要细胞蛋白的分裂和染色质的凝聚。Caspase还可激活DNA酶,该酶通过核间小体碎片化导致DNA断裂[26]。本研究结果显示,ATRA处理后cleaved caspase 3蛋白相对表达量大幅上调,说明最终caspase 3的激活,导致细胞凋亡。
有研究证实,ATRA介导过度产生的ROS是内质网应激诱导RPE细胞凋亡的早期事件,通过抗氧化剂清除ROS可能是保护细胞凋亡的有效策略[27]。尽管ATRA对视力的维持是必不可少的,但这种分子在RPE细胞内的过度积累会导致细胞毒性。本研究结果显示,ATRA体外诱导ARPE-19细胞凋亡是通过激活ROS及内源性caspase依赖性凋亡途径导致的。这些途径的诱导导致细胞内ROS水平升高,线粒体膜电位降低,进而导致内质网应激反应和caspase依赖途径的激活,最终导致细胞死亡。本研究扩大了我们对ATRA对人RPE细胞毒性的认识,其特征是ATRA清除延迟,在减轻ATRA对细胞器有害作用的基础上,为RPE细胞的靶向治疗开辟了新的途径。
利益冲突所有作者均声明不存在任何利益冲突
