核黄素-紫外线A巩膜胶原交联照射时间与视网膜损伤的关系
2021-07-16颜东刘丽梅明春秀张少斌
颜东 刘丽梅 明春秀 张少斌
1滨州医学院,烟台 264033;2潍坊眼科医院 261041
病理性近视是全球性的公共卫生问题,是低视力和致盲的主要原因之一。病理性近视的眼底常出现多种异常改变,包括视盘斜入、视盘颞侧萎缩弧或视盘周围萎缩环、后巩膜葡萄肿、豹纹状眼底等。这些改变的根本原因在于眼轴的进行性增长,后巩膜变薄,生物力学强度减弱,眼底出现退行性变化[1]。核黄素-紫外线A巩膜胶原交联术可增强巩膜的生物力学强度[2-6],但是在紫外线A照射时可能会有视网膜损伤的风险。既往研究主要通过病理组织学方法研究核黄素-紫外线A巩膜胶原交联术的安全性[7-8]。由于其潜在的损伤机制可能为交联过程中释放的活性氧自由基导致的光化学损伤[9],因此本研究在组织学研究的基础上,进一步探讨该技术对视网膜氧化及抗氧化水平的影响,寻找其照射的安全时间。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 选取健康成年新西兰大白兔60只,雌雄各半,体质量2.0~2.5 kg(青岛大学提供),实验兔均在SPF动物房饲养并进行实验。实验动物的饲养和使用均遵循ARVO制定的科研动物使用规范和国家科学技术委员会颁布的《实验动物质量管理办法》要求。本研究经滨州医学院实验动物伦理委员会审核批准(批文号:2017-80)。采用随机数表法将60只实验兔随机分为对照组(0 min)和照射10、20、30及40 min组,每组12只,均以左眼为实验眼。
1.1.2主要试剂及仪器 质量分数0.1%核黄素溶液(意大利Sooft公司);丙二醛(malondialdehyde,MDA)检测试剂盒(TBA法)、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(WST-1法)、过氧化氢酶(catalase,CAT)测定试剂盒(钼酸铵法)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(南京建成生物工程研究所);兔抗GAPDH抗体、兔抗CAT抗体(美国Abcam公司);兔抗SOD抗体(美国Affinity公司);HRP标记的山羊抗兔二抗(南非Aspen公司);RIPA裂解液(中国Beyotime公司);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司)。LED紫外线发射仪(Mod.VEGA 10 mW,意大利Sooft公司);石蜡切片机(德国Leica公司);光学显微镜(日本尼康公司);透射电子显微镜(美国FEI公司);电泳仪、转膜仪、凝胶成像系统(北京六一仪器厂)。
1.2 方法
1.2.1核黄素-紫外线A巩膜胶原交联术及术后处理 实验前3 d采用氧氟沙星滴眼液点眼,每天4次。在每次照射前对交联仪进行能量测试,确保能量的准确性。采用质量分数1%戊巴比妥钠溶液(2 ml/kg)经兔耳缘静脉注射行全身麻醉。实验眼采用盐酸丙美卡因滴眼液点眼行表面麻醉,开睑器撑开左眼睑,眼科剪剪开球结膜,分离结膜下组织,5-0尼龙线在角膜缘处牵拉,暴露鼻上象限赤道部巩膜9 mm×9 mm以上。于照射前15 min采用0.1%核黄素溶液点眼,每3 min点眼1次。照射参数:波长为370 nm,能量密度为10 mW/cm2,光圈直径为9 mm,照射期间仍每3 min核黄素溶液点眼1次。术后采用氧氟沙星滴眼液点眼,每天4次。于照射结束后24 h,采用耳缘静脉注射空气法处死实验兔后摘取眼球。
1.2.2苏木精-伊红染色观察视网膜组织形态 将眼球置于质量分数4%多聚甲醛溶液中固定24 h,取实验眼交联区域和对照组相应区域的组织,于4%多聚甲醛溶液中固定24 h,乙醇脱水,石蜡包埋,用苏木精-伊红染色4 μm厚石蜡切片,光学显微镜下观察视网膜组织的病理学改变。所有实验独立重复3次。
1.2.3醋酸铀-柠檬酸铅双重染色观察视网膜超微结构 取新鲜视网膜组织迅速投入配置好的固定液中,标本先后经体积分数2.5%戊二醛固定液和质量分数1%四氧化锇固定液双重固定;梯度乙醇脱水;环氧丙烷过渡,Epon812包埋;半薄切片定位,制作超薄切片,厚度为60 nm;采用醋酸铀-柠檬酸铅双重染色。采用Tecnai G2 20 Twin透射电子显微镜观察视网膜超微结构变化。所有实验独立重复3次。
1.2.4MDA测试盒检测视网膜中MDA浓度 取新鲜视网膜组织,称重,置于玻璃匀浆器中,加入预冷的生理盐水,质量分数10%蛋白匀浆,离心半径16 cm,3 000 r/min离心10 min,取上清液备用。在空白管、标准管、测定管及对照管分别加入无水乙醇0.1 ml、10 nmol/ml标准品0.1 ml、测试样品0.1 ml,向每管加入试剂一0.1 ml,混匀。向每管中依次加入试剂二3.0 ml和试剂三1.0 ml,对照管中加入质量分数50%冰醋酸1 ml代替试剂三。离心管盖上盖子,用针在盖子上扎1个小孔,振荡混匀器混匀,95 ℃水浴40 min,取出后冷却,3 500 r/min离心10 min,取上清。蒸馏水调零,532 nm处测定各管吸光度(A)值后计算其含量。所有实验独立重复3次。
1.2.5SOD、CAT、GSH-Px测定试剂盒检测视网膜中SOD、CAT和GSH-Px活性 取1.2.4已制备好的上清液待用。(1)SOD活性检测 在对照孔、对照空白孔、测定孔及测定空白孔依次加入待测匀浆上清、蒸馏水、酶工作液、酶稀释液及底物应用液各20 μl,混匀,37 ℃孵育20 min,450 nm处酶标仪上读取A值,计算SOD抑制率和SOD活性。SOD抑制率=(对照A值-测定A值)/对照A值;SOD活性[μmol/(s·mg)]=SOD抑制率/50%×反应体系稀释倍数/待测样本蛋白浓度(mgprot/ml)/60。(2)CAT活性检测 取组织匀浆液50 μl加到测试管内,对照管内不加组织匀浆液,向2个管内依次加入试剂一1 ml和试剂二100 μl,混匀,37 ℃反应60 s后依次加入试剂三1 ml和试剂四100 μl,对照管内补加50 μl组织匀浆液,混匀。双蒸水调零,测定各管波长405 nm处A值后计算CAT活性,CAT活性[μmol/(s·mg)]=(对照A值-测定A值)×271/60。(3)GSH-Px活性检测 酶管与非酶管内各加1 mmol/L GSH溶液200 μl,然后酶管内再加200 μl组织匀浆液。混匀,37 ℃水浴5 min。加入试剂一应用液100 μl,37 ℃水浴反应5 min。加入试剂二应用液2 ml终止反应,非酶管内补加200 μl组织匀浆液,混匀,3 500 r/min离心10 min。分别向空白管、标准管中加入GSH标准品溶剂应用液、20 μmol/L GSH标准液1 ml,向非酶管和酶管中各加入上清液1 ml,向各管中依次加入试剂三、四、五进行显色反应。混匀,室温下静置15 min。蒸馏水调零,测定各管波长412 nm处A值。GSH-Px抑制率=(非酶管A值-酶管A值)/非酶管A值×100%,抑制率在45%或50%左右为最佳取样浓度。GSH-Px活力[μmol/(s·mg)]=标准管浓度×取样量×样本蛋白含量(mgprot/ml)/60。所有实验独立重复3次。
1.2.6Western blot法检测视网膜中SOD、CAT蛋白相对表达量 取新鲜视网膜组织,用RIPA总蛋白裂解液提取视网膜总蛋白,BCA试剂盒检测蛋白浓度并调平。各组分别取等量蛋白用质量分数10% SDS-PAGE凝胶分离蛋白,转移蛋白至PVDF膜。采用质量分数5%脱脂牛奶封闭2 h,加入一抗(CAT:1∶ 2 000;SOD:1∶ 1 000;GAPDH:1∶ 10 000),于4 ℃孵育过夜。次日弃去一抗,加入二抗(1:10 000),室温下封闭1 h,滴加ECL液曝光显影,用凝胶成像系统获取蛋白条带图片。以GAPDH为内参,计算各蛋白相对表达量。蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。所有实验独立重复3次。
1.3 统计学方法
采用SPSS 17.0统计学软件(美国SPSS公司)进行统计分析,计量资料数据经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示。采用随机分组单因素干预多水平研究设计。不同照射时间组视网膜中MDA浓度,SOD、CAT和GSH-Px活性,SOD和CAT蛋白相对表达量的总体比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同照射时间对视网膜组织形态的影响
对照组和照射10 min组视网膜各层结构排列均规则有序,界限清晰,视网膜整体结构较正常。照射20 min组视网膜各层结构轻度水肿,光感受器细胞层排列偶见疏松,神经节细胞轻度水肿,细胞质淡染。照射30 min组视网膜各层结构明显水肿,细胞整体淡染,光感受器细胞层排列紊乱,神经节细胞层细胞数量减少,神经纤维层轻度增生。照射40 min组视网膜光感受器层和色素上皮层分离,光感受器层细胞水肿,细胞质淡染,神经节细胞层内神经节细胞消失,神经纤维显著增生,神经纤维层厚度增加,可见内界膜脱落(图1)。

图1 光学显微镜下观察不同照射时间对视网膜组织形态的影响(HE ×200,标尺=100 μm) A:对照组视网膜各层结构排列规则有序,界限清晰,视网膜整体结构较正常 B:照射10 min组与对照组表现类似 C:照射20 min组视网膜各层结构轻度水肿,光感受器细胞层排列偶见疏松(绿色箭头),神经节细胞轻度水肿,细胞质淡染(黑色箭头) D:照射30 min组视网膜各层结构明显水肿,细胞整体淡染,光感受器细胞层排列紊乱(绿色箭头),神经节细胞层细胞数量减少(黑色箭头),神经纤维层轻度增生(红色箭头) E:照射40 min组视网膜光感受器层和色素上皮层分离,光感受器层细胞水肿,细胞质淡染(绿色箭头),神经节细胞层内神经节细胞消失(黑色箭头),神经纤维显著增生,神经纤维层厚度增加(红色箭头),内界膜脱落(黄色箭头)
2.2 不同照射时间对视网膜超微结构的影响
对照组光感受器细胞外节膜盘层状结构完整,层次清晰,排列整齐;光感受器细胞内节线粒体结构完整,线粒体嵴结构连续,呈长椭圆形,细胞核染色均匀,核膜结构完整,与细胞质界限清晰,形态规则。照射10 min组与对照组相比无明显变化。照射20 min组视网膜光感受器细胞外节膜盘层状结构完整,层次清晰,排列整齐,少量外节膜盘结构溶解,层次结构消失;部分内节线粒体嵴结构溶解,模糊,不连续。照射30 min组部分视网膜光感受器细胞外节膜盘层状结构解离,空泡化,紊乱呈髓样结构;部分线粒体嵴结构溶解、模糊,形成髓样小体。照射40 min组视网膜光感受器外节细胞减少、稀疏,细胞间隙较大;内节线粒体肿胀,线粒体嵴结构消失,形成空泡化(图2)。
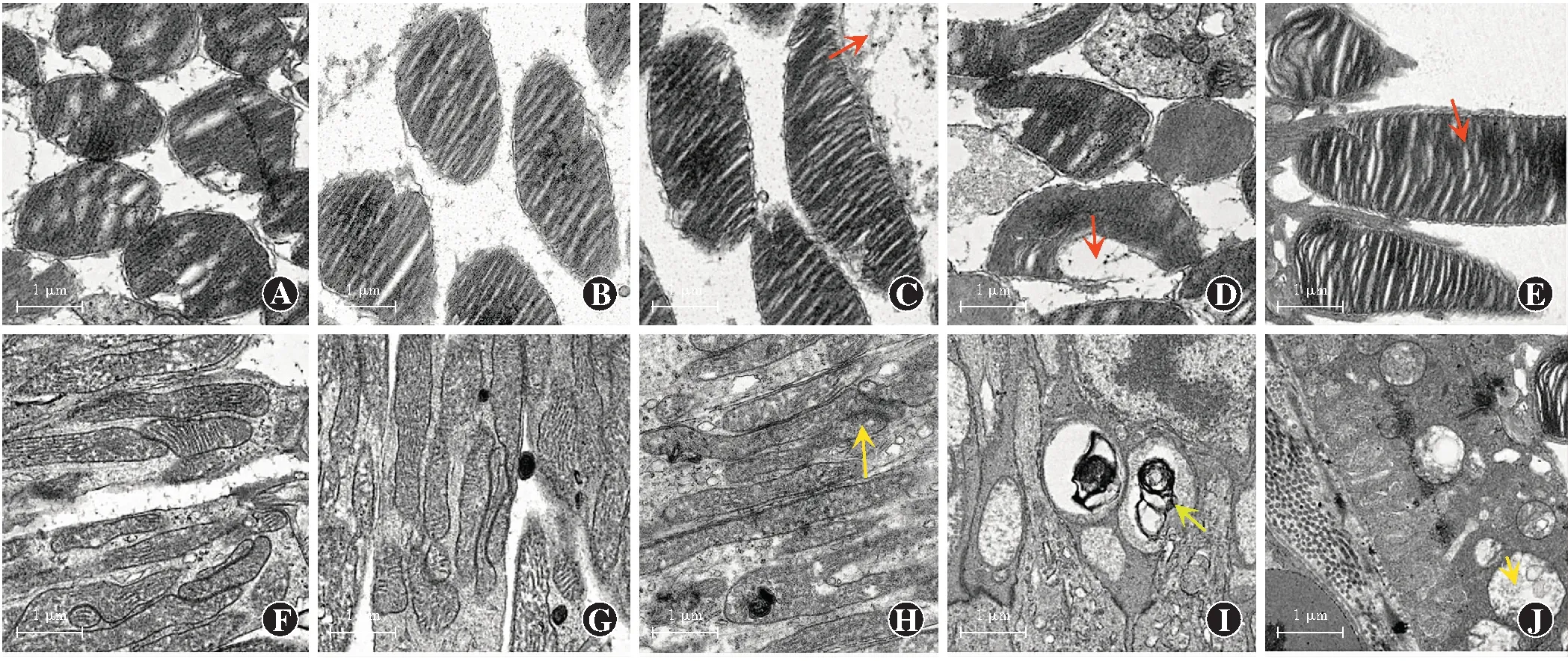
图2 电子显微镜下观察不同照射时间对视网膜光感受器细胞外节和内节超微结构的影响(醋酸铀-柠檬酸铅 ×5 000,标尺=1 μm) A:对照组光感受器细胞外节膜盘层状结构完整,层次清晰,排列整齐 B:照射10 min组光感受器细胞外节表现与对照组类似 C:照射20 min组视网膜光感受器细胞可见少量外节膜盘结构溶解,层次结构消失(红色箭头) D:照射30 min组部分视网膜光感受器细胞外节膜盘层状结构解离、空泡化、紊乱,呈髓样结构(红色箭头) E:照射40 min组视网膜光感受器外节细胞减少、稀疏,细胞间隙较大(红色箭头) F:对照组光感受器细胞内节线粒体结构完整,线粒体嵴结构连续,呈长椭圆形,细胞核染色均匀,核膜结构完整,与细胞质界限清晰,形态规则 G:照射10 min组光感受器内节表现与对照组类似 H:照射20 min组光感受器内节部分线粒体嵴结构溶解、模糊、不连续(黄色箭头) I:照射30 min组部分线粒体嵴结构溶解、模糊,形成髓样小体(黄色箭头) J:照射40 min组光感受器内节线粒体肿胀,线粒体嵴结构消失,形成空泡化(黄色箭头)
2.3 不同照射时间对视网膜组织中MDA浓度的影响
随着照射时间的延长,各组视网膜组织中MDA浓度逐渐升高,总体比较差异有统计学意义(F=65.25,P<0.05),其中照射20 min、30 min和40 min组MDA浓度明显高于对照组,照射20 min、30 min和40 min组MDA浓度依次升高,两两比较差异均有统计学意义(均P<0.05)(表1)。
2.4 不同照射时间对视网膜组织中SOD、CAT和GSH-Px活性的影响
随着照射时间的延长,各组视网膜组织中SOD、CAT和GSH-Px活性逐渐降低,总体比较差异均有统计学意义(F=44.09、34.18、35.60,均P<0.05),其中照射20 min、30 min、40 min组SOD、CAT和GSH-Px活性明显低于对照组,照射20 min、30 min、40 min组SOD、CAT和GSH-Px活性依次降低,两两比较差异均有统计学意义(均P<0.05)(表1)。
2.5 不同照射时间对视网膜组织中SOD和CAT蛋白相对表达量的影响
随着照射时间的延长,各组视网膜组织中SOD和CAT蛋白相对表达量逐渐降低,总体比较差异均有统计学意义(F=115.75、78.86,均P<0.05),其中照射20 min、30 min、40 min组SOD和CAT蛋白相对表达量明显低于对照组,照射20 min、30 min、40 min组SOD和CAT蛋白相对表达量依次降低,两两比较差异均有统计学意义(均P<0.05)(图3,表2)。

表1 各组兔眼视网膜组织中MDA浓度及SOD、CAT、GSH-Px活性比较(mean±SD)Table 1 Comparison of MDA concentration and SOD,CAT,GSH-Px activities in retinal tissues of rabbits among different groups (mean±SD)组别样本量MDA浓度(nmol/mgprot)SOD活性[μmol/(s·mg)]CAT活性[μmol/(s·mg)]GSH-Px活性[μmol/(s·mg)]对照组31.13±0.020.25±0.030.11±0.013.00±0.29照射10min组34.13±1.210.25±0.010.11±0.022.81±0.39照射20min组311.31±1.84a0.19±0.03a0.07±0.01a2.13±0.15a照射30min组314.94±1.04ab0.13±0.01ab0.06±0.01ab1.67±0.12ab照射40min组318.25±1.42abc0.08±0.01abc0.04±0.01abc0.92±0.17abcF值65.2544.0934.1835.60P值<0.05<0.05<0.05<0.05 注:与各自对照组比较,aP<0.05;与各自照射20min组比较,bP<0.05;与各自照射30min组比较,cP<0.05(单因素方差分析,LSD-t检验) MDA:丙二醛;SOD:超氧化物歧化酶;CAT:过氧化氢酶;GSH-Px:谷胱甘肽过氧化物酶 Note:Compared with the respective control group,aP<0.05;compared with the respective 20 minutes irradiation group,bP<0.05;compared with the respective 30minutes irradiation group,cP<0.05 (One-way ANOVA,LSD-t test) MDA:malondialdehyde;SOD:superoxide dismutase;CAT:catalase;GSH-Px:glutathione peroxidase

图3 Western blot法检测各组视网膜组织中SOD和CAT蛋白表达电泳图 随着照射时间的延长,各组视网膜组织中SOD和CAT蛋白表达条带逐渐减弱 1:对照组;2:照射10 min组;3:照射20 min组;4:照射30 min组;5:照射40 min组 CAT:过氧化氢酶;SOD:超氧化物歧化酶;GAPDH:甘油醛-3-磷酸脱氢酶

表2 各组兔眼视网膜组织中SOD和CAT蛋白相对表达量比较(mean±SD)Table 2 Comparison of relative expression levels of SOD and CAT proteins in retina of rabbits among different groups (mean±SD) 组别样本量SOD蛋白相对表达量CAT蛋白相对表达量对照组31.82±0.143.82±0.14照射10min组31.64±0.083.50±0.49照射20min组31.23±0.11a1.93±0.11a照射30min组30.79±0.06ab0.94±0.13ab照射40min组30.08±0.02abc0.29±0.09abcF值115.7578.86P值<0.05<0.05 注:与各自对照组比较,aP<0.05;与各自照射20min组比较,bP<0.05;与各自照射30min组比较,cP<0.05(单因素方差分析,LSD-t检验) SOD:超氧化物歧化酶;CAT:过氧化氢酶 Note:Compared with the respective control group,aP<0.05;compared with the respective 20 minutes irradiation group,bP<0.05;compared with the re-spective 30 minutes irradiation group,cP<0.05 (One-way ANOVA,LSD-t test) SOD:superoxide dismutase;CAT:catalase
3 讨论
关于巩膜胶原交联术安全性的研究相对较少,Zhang等[10]用3 mW/cm2的紫外线照射兔眼不同的时间,光学显微镜下观察发现照射时间在40 min以内不会对视网膜造成损伤,照射时间过长可引起视网膜损伤。本实验中未选用3 mW/cm2的能量照射,而是采用10 mW/cm2的能量照射,因为根据本生罗斯科互易律,照射能量和照射时间的乘积相等,其光化学反应是等价的,胶原交联效果与组织吸收的总能量成正比[11-12],通过增加紫外线的能量密度,减少照射时间可以加速交联反应。本实验结果显示,从照射20 min开始,视网膜的正常结构开始出现改变,这与Zhang等[10]对巩膜胶原交联安全性研究的结果一致,均证明了照射时间过长可引起视网膜损伤。本实验通过电子显微镜观察同样发现,从照射20 min开始,视网膜光感受器细胞外节和内节均逐渐发生改变,照射10 min组视网膜组织在光学显微镜和电子显微镜下均未出现明显的组织结构变化,因此本实验通过组织病理学观察得出核黄素-紫外线A巩膜胶原交联照射10 min是安全的。
视网膜的光损伤分为机械损伤、热损伤和光化学损伤[13]。光化学损伤机制主要包括自由基和脂质过氧化损伤、钙离子和内质网应激反应蛋白及细胞凋亡机制[14-17]。紫外线照射时会产生大量活性氧自由基[18-19],活性氧自由基可直接损伤DNA,促进细胞凋亡,也可攻击蛋白质使蛋白质功能受损,还可以与生物膜中的不饱和脂肪酸发生脂质过氧化反应,造成细胞膜正常结构的破坏。脂质过氧化反应的产物为MDA,通常MDA的浓度可以反映视网膜内脂质过氧化水平,提示视网膜的损伤程度。本研究结果表明,核黄素-紫外线A巩膜胶原交联照射20 min后视网膜中MDA浓度升高,说明视网膜中产生大量活性氧自由基,脂质过氧化水平升高,视网膜出现损伤。在以往的实验研究中,Wang等[20]用核黄素-紫外线(365 nm,3.0 mW/cm2)照射兔眼30 min,通过TUNEL染色分析发现视网膜层凋亡细胞,由此也可猜测胶原交联治疗过程中细胞的凋亡可能是由细胞氧化损伤引起。
生理状态下,视网膜中存在清除自由基的抗氧化防御系统包括酶类和非酶类抗氧化物质,SOD、GSH-Px和CAT作为主要的酶类抗氧化物质可保护视网膜免受氧化损伤[21],其中SOD可将O2-分解为H2O2,而GSH-Px、CAT又能分解SOD催化产生的H2O2和其他来源的H2O2,它们与体内的自由基处于动态平衡。本实验将SOD、CAT、GSH-Px作为观察指标,结果显示从核黄素-紫外线A巩膜胶原交联照射20 min开始,SOD、CAT、GSH-Px活性和SOD、CAT蛋白相对表达量随照射时间延长均逐渐下降,说明此时视网膜内产生了过多活性氧自由基,大量消耗了视网膜中抗氧化物质同时使其失活,视网膜内氧化和抗氧化系统间的相对平衡受到破坏,视网膜发生氧化损伤,这与检测MDA浓度得到的结论一致。核黄素-紫外线A巩膜胶原交联照射10 min组MDA浓度,SOD、CAT活性和相对表达量,以及GSH-Px活性与对照组相比差异均无统计学意义,说明此时视网膜组织氧化系统和抗氧化系统处于动态平衡,胶原交联术并未对视网膜造成损伤。因此从视网膜组织氧化和抗氧化角度同样认为核黄素-紫外线A巩膜胶原交联照射10 min是安全的,照射20 min会对视网膜造成损伤。另外,根据本生罗斯科互易律和以往实验证明,总能量为5.4 J/cm2的核黄素-紫外线A巩膜胶原交联照射可增强巩膜生物力学强度[11-12,22]。本实验照射10 min组总能量为6.0 J/cm2,结果显示核黄素-紫外线A巩膜胶原交联照射10 min是安全的,推测其还可增强巩膜生物力学强度,但其影响及机制仍需进一步研究。
综上所述,本研究结果表明10 mW/cm2核黄素-紫外线A巩膜胶原交联照射10 min是安全的,照射时间过长可引起视网膜的损伤。本研究在病理组织学基础上进一步研究了视网膜抗氧化能力的变化,从而为核黄素-紫外线A巩膜胶原交联术应用于临床提供理论依据,但核黄素-紫外线A巩膜胶原交联术对视网膜功能的影响还有待进一步研究。
利益冲突所有作者均声明不存在任何利益冲突
