外源调节物质对豆梨叶变色期及生理特性的影响
2021-07-16邱玉宾张海良杨志莹魏海霞赵庆柱
邱玉宾,张海良,杨志莹,魏海霞,赵庆柱
(1.潍坊市农业科学院,山东 潍坊 261071;2.山东省林业科学研究院,山东 济南 250014)
我国在彩叶植物的引种研究方面取得了可喜成绩,筛选出一批表现突出的树种,丰富了我国秋色叶植物种质资源,但我国在彩叶树种的新品种选育、栽培关键技术应用中存在一定的滞后性[1]。如何科学地对引进树种进行栽培管理、提高其抗寒性和观赏价值是彩叶植物领域现阶段面临的问题[2]。
豆梨(Pyrus calleryana)原产于我国华东、华南、华北各地,后引种至美国。美国经多年栽培选育,培育出如“首都”“贵族”“红塔”等一批观赏价值较高的新品种,其树冠大而丰满,秋季叶色呈现鲜红或橙红色,是集观花、观果、观叶于一体的优良景观树种[3],应用前景十分广阔。但豆梨变色期及效果在不同气候、不同地域条件下表现不同,叶变色期长短、艳丽程度差异较大,在某些地区、某种气候条件下甚至会出现失去变色效果的现象,因而实现北美豆梨变色期及效果的调控,使其表现出较高的景观观赏价值,是当前栽培中面临的一大难题[4]。陈继卫等[5]研究认为花色苷含量与叶片所呈现红色的深度具有明显的正相关关系;胡永红等[6]研究认为日照时数高有利于光合产物的积累继而有利于花色苷的增加,较大的昼夜温差有利于多糖的累积,促进花青素的合成。本试验以北美豆梨‘首都’为材料,研究其在植物生长调节剂等外源物质影响下的叶片变色期及相关生理指标表现,旨在为今后豆梨培育及栽培技术应用提供理论依据。
1 材料与方法
1.1 试验材料
试验于2019年在潍坊市农业科学院青州谭坊试验基地进行。试材为‘首都’豆梨嫁接苗,2017年定植,株行距2 m×2 m。采用相同栽培条件和管理措施。
试验用外源调节物质:蔗糖、白醋(乙酸含量50 g/L)、植物生长调节剂(三碘苯甲酸、吲熟酯和多效唑的质量比为1.5:0.7:1.5)、微肥(硫酸亚铁、硫酸锌、硫酸铜、钼酸铵和硼砂的组合,质量比为2:2:1:1:2)。
1.2 试验设计
试验以清水为对照,将植物生长调节剂、微肥、蔗糖、白醋按不同配比设置混合处理,共3个(表1),每处理10株。9月上旬第1次喷施,每隔15 d喷施1次,共3次。喷施后3日内如出现降雨,进行补喷。

表1 试验设计方案
1.3 测定项目及方法
1.3.1 物候期观测 观测主要内容包括不同处理条件下的叶变色始期、可供观赏期、全部变色期、落叶始期等。植株叶片约有5%开始呈现紫红色即为叶变色始期,有30%~50%叶片呈现紫红或红色并且具有一定的观赏效果即为可供观赏期,全部叶片完全变色即为全部变色期[7];植株约有5%叶片开始脱落即为落叶始期。叶变色期天数为叶变色始期到落叶始期的间隔天数。
1.3.2 光合指标测定 采用英国PP Systems公司生产的CIRAS—2型便携式光合测定仪,于10月上旬外源调节物质喷施结束后3~5 d,选择晴天上午9:00—10:00测定。测定时选取健壮无病虫害枝条上的成熟叶片,并做好标记,测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr),每片叶重复3次。
1.3.3 花色苷含量测定 参考何奕昆等[8]的方法。于各处理最早开始变色时取样,每隔5 d取样1次,于晴天上午9:00—10:00采集无病虫害植株枝条中上部叶片。
1.3.4 可溶性糖含量测定 采用蒽酮比色法[9]。
1.4 数据处理
采用Microsoft Excel进行数据处理和作图,用SPSS软件进行统计分析,用Duncan’s法进行显著性分析。
2 结果与分析
2.1 不同处理对豆梨叶变色期的影响
由表2可以看出,T3处理叶变色始期最早,为10月14日,T1、T2、T3处理叶变色始期比CK分别早2、4、5 d。3个处理中T3落叶最晚,比CK晚4 d。T1、T2、T3处理叶变色期天数分别为23、27、29 d,比CK分别长3、7、9 d。由此可见,喷施外源调节物质能有效延长豆梨叶观赏期,T3处理效果最好。

表2 不同处理豆梨物候期及变色天数对比
2.2 不同处理对豆梨叶片光合特性的影响
由表3可以看出,3个处理对净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)的影响各不相同。与CK相比,各处理的净光合速率、气孔导度、蒸腾速率均呈不同程度的增加,说明外源调节物质处理后植株的光合性能得到提升,利于碳水化合物的积累。不同处理条件下,T3的净光合速率和气孔导度最大,分别为8.33μmol/(m2·s)和115.67mmol/(m2·s),分别比CK增加8.32%、6.78%,差异显著;T1处理的净光合速率和气孔导度最小,分别为7.88 μmol/(m2·s)和108.65 mmol/(m2·s),显著低于T3,与其它处理差异不显著。CK胞间CO2浓度最大,为284.67μmol/mol,与T1、T2处理差异显著。
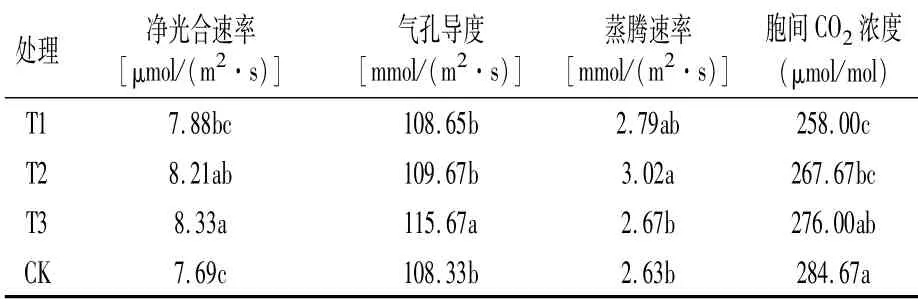
表3 各处理豆梨光合参数比较
2.3 不同处理叶片变色期花色苷含量的变化
图1显示,各处理豆梨叶片花色苷含量随生长进程而增加,变色初期各处理与CK花色苷含量差异不大。结合表2可以看出,T3处理最早开始变色,且整个变色期花色苷含量明显高于其它处理及对照,对照花色苷含量低于其它处理,变化较平稳。10月14—24日各处理花色苷含量有明显上升趋势,T3尤其明显,说明T3更能通过外源调节物质及植物体内相关酶的作用有效调控叶片各类色素的比例及组成,进而影响花色素合成;10月24日—11月3日各处理花色苷含量变化较平稳;11月3日后各处理花色苷含量急剧上升,11月8日均达到最大值,T3的峰值明显高于其它处理。

图1 不同处理叶片变色期花色苷含量的变化
2.4 不同处理叶片变色期可溶性糖含量的变化
图2显示,不同处理叶片可溶性糖含量均随生长进程先增后降,至10月29日达到峰值,其中T3处理的可溶性糖净增长量最大。结合表1和表2可知,喷施不同浓度和配比的外源调节物质后,T3处理的可溶性糖积累最多,落叶最晚,抗寒性最强。推测可溶性糖可以作为豆梨抗寒性的一个重要指标。T1与CK可溶性糖含量变化规律相似,变化较平稳,可溶性糖含量略高于CK;T2和T3在10月24日前曲线变化趋势相似,均呈缓慢上升趋势,10月29日升至峰值,之后缓慢下降。

图2 不同处理叶片变色期可溶性糖含量的变化
3 讨论与结论
光合作用引起植物叶片内色素的比例发生变化从而导致叶片呈现不同色彩,叶片变红是花青素大量积累造成的[10]。改变叶片光合作用和呼吸作用可以调节植物体内碳水化合物的合成,进而影响花色素合成。温度也是影响植物叶色的重要因素,它可以改变花色苷和叶绿素在植物体内的含量从而引起叶色变化;温度在色素合成过程中起重要作用,它通过改变关键酶的活性进而直接调控各类色素所占比例及组成[11]。本试验以豆梨‘首都’为材料,叶面喷施不同浓度和比例的外源调节物质,发现T3处理(0.5 mg/L植物生长调节剂+1 500mg/L微肥+8 000mg/L蔗糖+20 mL/L白醋)叶片净光合速率和气孔导度最大,可溶性糖和花色苷含量最高。叶片喷施外源物质后改变其光合和呼吸,进而影响到花色素及可溶性糖含量。有研究表明,植物叶色的变化与叶片细胞内色素种类、含量以及在叶片中的分布有关[12,13],糖类物质可以为花色苷的合成提供能量和碳骨架[13]。本试验对豆梨叶片喷施不同浓度和比例的外源调节物质,在其与低温产生的协同作用下导致叶片变色,提高了可溶性糖及花色苷含量,这与前人的研究结果一致。
郭衍银[14]、胡静静[15]等研究认为,可溶性糖与花色苷含量呈现明显正相关。可溶性糖含量的增加可显著促进叶片中花色苷的积累[16]。李清亚[17]通过研究低温胁迫对北美豆梨可溶性糖含量的影响认为,随温度降低其可溶性糖含量逐渐增高。可溶性糖含量是植物抗寒性的一个重要指标,其含量越高,抗寒力也越强[18]。可溶性糖增加的同时,花青素含量也随着上升。可溶性糖是植物抵御低温的重要保护性物质,可以增强植物对低温的适应能力[19,20]。花色苷在不同的酸碱条件下会呈现不同的颜色,酸性条件下会呈现红色[21]。本试验表明,喷施蔗糖能增加豆梨叶片可溶性糖含量,增强抗寒能力,延长落叶期,为花色苷合成提供能量;喷施白醋使叶片处于微酸环境,有利于花色苷呈色;喷施植物生长调节剂,能改善叶片光合和呼吸作用,调节碳水化合物的合成,进而影响花色素的合成。喷施外源调节物质,有效延后叶片脱落时间,增加豆梨观赏期。本试验中,实施处理后花色苷含量呈上升趋势,可溶性糖曲线先升后降,与前人研究结论不尽一致。
植物叶片颜色的变化是遗传因素和外界环境等多种因素综合作用的结果,本试验通过研究喷施不同浓度和比例的外源调节物质对豆梨叶变色及相关生理指标的影响,可为豆梨在我国适生区的栽培推广提供理论依据,其它影响因素及其综合影响还有待进一步研究。
