氧化应激参与溴乙酰胺致斑马鱼胚胎神经发育毒性
2021-07-15何梦婷王伟许洁张洁
何梦婷,王伟,许洁,张洁
苏州大学医学部公共卫生学院卫生毒理学教研室,江苏 苏州 215123
作为20世纪公共卫生事业的重大进步之一,氯化消毒是目前饮用水处理中最常用的消毒方法。然而,研究发现氯化消毒过程中产生的消毒副产物具有较强的致畸性和致癌性[1]。随着水污染状况的变化和水处理工艺的改进,卤代酰胺作为一种新型的含氮消毒副产物开始受到关注,目前已确认的有13 种[2]。研究发现在许多国家的饮用水,由于通过氯化和氯胺化消毒后检出多种卤代酰胺[3]。毒理学研究证实,卤代酰胺的细胞毒性比卤代乙酸高99 倍,遗传毒性比卤代乙酸高19倍[4]。
溴乙酰胺是13 种卤代酰胺中的一种,Chu 等[5-6]发现因氯化和氯胺化消毒导致的自然水域和水处理厂的水中溴乙酰胺浓度超过了检测限值。本实验室最近研究发现,溴乙酰胺可引起斑马鱼发育毒性,主要表现为死亡率增加,孵化率、体长及运动能力的下降[7],但具体机制尚不明确。Hong 等[8]发现单卤代酰胺的暴露可能会增加活性氧的产生。吉贵祥等[9]发现斑马鱼胚胎暴露于2,2’,4,4’-四溴联苯醚(BDE-47)后引起神经受损并激活抗氧化防御系统。因此,我们假设溴乙酰胺是否通过诱导氧化应激导致斑马鱼的神经发育毒性。
斑马鱼(Danio rerio)是一种重要的水生脊椎动物,胚胎透明,便于在显微镜下观察,对低浓度的环境污染物非常敏感,并且与人类基因高度同源[10]。因此,它被广泛用于评估水中有害物质和药理学、药物筛选、毒理学研究等方面。本研究以斑马鱼作为实验对象,探究斑马鱼胚胎期暴露于溴乙酰胺后所致的神经发育毒性及其可能机制。
1 材料与方法
1.1 实验动物与试剂
受精后2 h(2 hours of post-fertilization,2 hpf)的野生型AB 系斑马鱼鱼卵(木芮生物科技有限公司,中国)。溴乙酰胺(纯度≥98%,CAS:683-57-8)以及二氯二氢荧光素二乙酸酯(dichlorodihydrofluorescein diacetate,DCFH-DA)均购自Sigma-Aldrich(美国)。
1.2 主要仪器
DS-Qi2 荧光显微镜(Nikon,日本),Zebrabox 斑马鱼行为追踪分析仪(ViewPoint,法国),Milli Q 纯水仪(Millipore,美国),NanoDrop2000 分光光度计(Thermo Fisher,美国),荧光定量PCR仪(ABI,美国)。
1.3 实验方法
1.3.1 急性毒性实验溴乙酰胺溶入双蒸水(ddH2O)配制为100 mg·L-1的母液,4℃避光保存备用。按经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)鱼类急性毒性实验标准方法[11]设置分组,分别为对照组和溴乙酰胺染毒组(0.625、1.25、2.5、5、10 mg·L-1,同步设置3个平行组)。将受精后2 h(2 hours post-fertilization,2 hpf)的斑马鱼受精卵随机放入6 孔板中,每孔30 枚鱼卵。将6孔板置于标准培养环境中,该环境保持(28.5±0.5)℃[12]恒温,14 h∶10 h 光-暗周期。每天更换培养液并及时取出死亡胚胎并统计,直至96 hpf。72 hpf 时记录斑马鱼的孵化情况,96 hpf 时记录斑马鱼的死亡数、畸形数以及镜下测量斑马鱼的体长。
1.3.2 幼鱼运动能力测试在溴乙酰胺暴露至96 hpf时,用养殖系统水(后称:卵水)将幼鱼清洗2次,然后全部换成卵水继续培养至120 hpf。从6孔板中挑出无畸形的幼鱼置于96孔板中,每孔一条,加入200 μL卵水,保证幼鱼可以自由游动。将96孔板放置于Zebrabox斑马鱼行为追踪分析仪中,设置仪器每20 min 照明-黑暗交替出现,持续140 min,开始记录前适应20 min。并记录下每分钟幼鱼的运动距离和运动时间。
1.3.3 幼鱼体内活性氧(reactive oxygen species,ROS)检测在96 hpf时,以DCFH-DA为探针测量ROS的产生。将斑马鱼(每组n≥12)放入含有5 μmol·L-1DCFH-DA 的1 mL 卵水的24孔板中避光孵育40 min,然后用卵水洗涤3次。荧光显微镜拍摄荧光图像,用Image J 1.50i 软件对头部荧光强度进行分析。
1.3.4 斑马鱼胚胎总RNA提取及基因检测按本实验室方法[13]进行RNA提取,每组收取≥20个胚胎,使用Trizol 法提取总RNA。逆转录试剂盒逆转录合成cDNA(complementary DNA),向cDNA 中加入SYBR green 以及正反向引物进行实时定量PCR实验,引物序列见表1。采用2-ΔΔCt法分析目的基因表达的相对差异。

表1 引物序列Table 1 Primer sequences
1.4 统计学分析
实验数据使用SPSS 20.0统计软件分析。资料经正态性检验后符合正态分布,因此计量数据以均数±标准差(±s)表示;各染毒组间比较用单因素方差分析(One-way ANOVA),进一步使用LSD 进行两两比较,检验水准为α=0.05。
2 结果
2.1 溴乙酰胺对斑马鱼胚胎发育的影响
斑马鱼胚胎期暴露于溴乙酰胺至96 hpf 时,各染毒组间死亡率的差异具有统计学意义(F=32.733,P<0.001),5、10 mg·L-1染毒组的死亡率分别为48.10%和96.06%,高于对照组(15.92%),差异具有统计学意义(分别P<0.01,P<0.001)(图1A)。由于10 mg·L-1染毒组的死亡率过高,剩余胚胎不能进行统计分析,因此以下结果均无10 mg·L-1染毒组。96 hpf 时各组间畸形率的差异具有统计学意义(F=23.384,P<0.001),2.5、5 mg·L-1染毒组的胚胎畸形率分别为21.38%和43.43%,高于对照组(1.94%),差异具有统计学意义(分别P<0.01,P<0.001)(图1B)。斑马鱼72 hpf时各组间孵化率差异具有统计学意义(F=15.273,P<0.001),在5 mg·L-1染毒组下降了11.6%,差异具有统计学意义(P<0.05)(图1C)。96 hpf时各组间体长差异具有统计学意义(F=18.841,P<0.001),2.5、5 mg·L-1染毒组中斑马鱼体长较对照组分别缩短了3.52%和8.52%,差异具有统计学意义(分别P<0.05,P<0.05)(图1D)。

图1 溴乙酰胺对斑马鱼胚胎发育的影响Figure 1 Effect of bromoacetamide on zebrafish embryonic development
2.2 溴乙酰胺对斑马鱼运动行为的影响
溴乙酰胺染毒至96 hpf时,各组间的运动距离和运动时间差异具有统计学意义(F1=47.545,F1=43.860,均P<0.001),染毒组斑马鱼胚胎运动总距离和运动总时间明显下降,差异具有统计学意义(均P<0.001)(图2)。

图2 溴乙酰胺对斑马鱼运动距离(A)、运动时间(B)的影响Figure 2 Effect of bromoacetamide on zebrafish embryoic movement distance (A) and time (B)
2.3 溴乙酰胺对斑马鱼神经发育相关基因表达的影响
斑马鱼胚胎各染毒组间神经发育相关基因(dlx2、ngn1、elavl3、shha、mbp、syn2a)的表达差异具有统计学意义(F1=11.220,F2=6.613,F3=38.726,F4=41.189,F5=15.808,F6=43.110,均P<0.01),与对照组比较,dlx2在2.5、5 mg·L-1染毒组表达下调,ngn1在5 mg·L-1染毒组表达下调,elavl3、shha在1.25、2.5和5 mg·L-1染毒组表达下调,mbp在1.25、5 mg·L-1染毒组下调,syn2a在各染毒组均表达下调,差异均具有统计学意义(P<0.05)(图3)。

图3 溴乙酰胺对斑马鱼神经发育基因表达的影响Figure 3 Effect of bromoacetamide on neurodevelopmental gene expressions of zebrafish
2.4 溴乙酰胺对斑马鱼头部ROS的影响
斑马鱼胚胎暴露于溴乙酰胺后,头部的ROS 荧光信号明显增强(图4A-E),对荧光信号进行定量后发现各组间ROS 表达差异具有统计学意义(F=7.246,P<0.01)(图4F),1.25、2.5、5 mg·L-1溴乙酰胺染毒组的ROS表达水平分别较对照组升高了67%、89%和107%,差异具有统计学意义(分别P<0.05,P<0.01,P<0.01)。

图4 溴乙酰胺对斑马鱼头部ROS 的影响Figure 4 Effect of bromoacetamide on ROS in zebrafish head
2.5 溴乙酰胺对斑马鱼氧化应激相关基因表达的影响
如图5所示,斑马鱼胚胎暴露于溴乙酰胺96 hpf后,各组间氧化应激相关基因Cu/Zn sod、gpx、cat、nrf2、ho-1的表达差异具有统计学意义(F1=45.567,F2=26.387,F3=30.845,F4=52.878,F5=58.172,均P<0.01);与对照组相比,Cu/Zn sod在2.5、5 mg·L-1染毒组表达上调,cat、nrf2在1.25、2.5、5 mg·L-1染毒组表达上调,gpx在5 mg·L-1染毒组表达上调,ho-1在各染毒组表达均上调,差异具有统计学意义(P<0.05)。
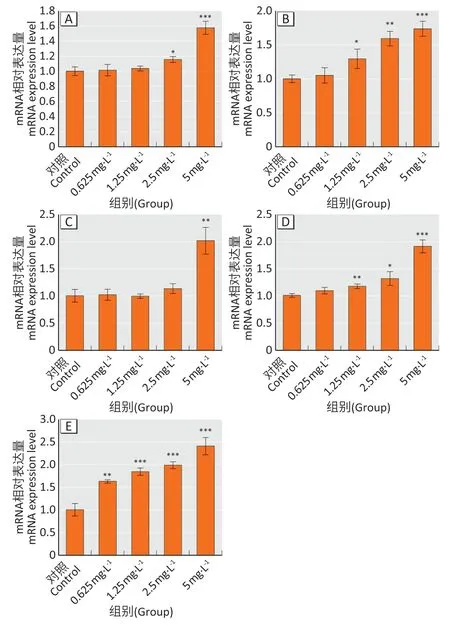
图5 溴乙酰胺对斑马鱼氧化应激相关基因表达的影响Figure 5 Effect of bromoacetamide on the expression of oxidative stress-related genes in zebrafish
3 讨论
饮用水消毒副产物是目前饮用水安全领域关注的重要水质问题之一。鉴于我国部分地区水源水中有机物和溶解性氮含量较高,并且自来水厂普遍采用氯化和氯胺化消毒方式,因此出厂水和管网水中可能存在较高浓度的卤代酰胺[14]。Plewa 等[15]研究发现,卤代酰胺可与细胞蛋白质硫醇反应,从而诱导多种生物反应,其中包括细胞凋亡和坏死。本研究发现斑马鱼在胚胎早期暴露于溴乙酰胺后出现发育毒性,主要表现为胚胎死亡率和畸形率升高,孵化率下降和体长缩短,以及出现神经损伤,运动能力下降。
斑马鱼运动行为学检测应用于探究环境因素对斑马鱼胚胎活动的影响,并且斑马鱼的运动行为特征能够体现斑马鱼的神经发育情况。本研究结果显示,斑马鱼胚胎暴露于溴乙酰胺至96 hpf 时,斑马鱼的运动能力下降,主要表现为运动时间和运动距离的明显下降。这些结果与曹文平等[16]的结果一致,表明斑马鱼胚胎早期暴露于溴乙酰胺后出现神经发育毒性效应。dlx基因家族基因编码的转录因子在脊椎动物中枢神经系统的发育中起关键作用[17],是哺乳动物大脑发育所必需的。就斑马鱼而言,dlx基因也在发育中的大脑中表达[18],研究发现当dlx2基因下调后,斑马鱼神经发育出现异常[19]。elav13基因是果蝇elav基因的直系同源基因,它编码神经特异性RNA结合蛋白HuC,并且在神经元分化和维持中起到重要作用[20]。有研究证实,斑马鱼胚胎暴露于磷酸三苯酯后,elavl3基因水平表达下降,斑马鱼胚胎神经发育出现异常[21]。研究发现ngn1基因的表达先于elavl3,并且参与了发育阶段中能够表达HuC/Elavl3 蛋白的细胞的生成[22],有研究发现斑马鱼胚胎暴露于铜绿微囊藻后,ngn1基因表达下调,斑马鱼神经发育异常[23]。Shha控制着关键的神经发育过程,包括神经管的形成,神经干细胞增殖和神经元、神经胶质细胞的存活。在人类和小鼠中,Shha缺乏可导致脑部发育异常[24]。除了在神经发育中的作用外,Shha的过度表达可促进神经细胞的存活,保护这些细胞免受神经毒素的侵害[25]。因此,当Shha表达缺乏时,可致神经细胞损伤。髓鞘碱性蛋白(myelin basic protein,MBP)则是髓鞘形成的生物标志物,而突触蛋白(synapsin,SYN2)是一种神经磷蛋白质,在突触形成和神经递质释放过程中发挥重要作用[26]。GU等[27]发现斑马鱼胚胎早期暴露于双酚S 后行为异常,mbp和syn2a基因表达下调,进而导致了斑马鱼胚胎的神经发育紊乱。Fu 等[28]也发现斑马鱼暴露于双酚A 后mbp和syn2a的基因和蛋白表达明显下调,胚胎出现神经发育毒性,进而导致运动能力的下降。本研究结果与上述研究结果一致,当斑马鱼胚胎暴露于溴乙酰胺后出现运动能力的下降,基因检测发现神经发育相关基因dlx2、ngn1、elavl3、shha、mbp、syn2a表达量均有不同程度的降低(P<0.05),表明溴乙酰胺在胚胎期暴露对斑马鱼的神经发育具有毒性作用。
在正常的生理情况下,体内ROS 的产生和清除一直处于动态平衡的状态,若机体处于氧化与抗氧化不平衡的状态,则会使得机体产生氧化应激,氧化应激的产生会使机体处于易损状态,同时还能增强致病因素的毒性作用。最近研究表明,氧化应激可导致斑马鱼神经发育异常[29]。在抗氧化防护体系中,体内的抗氧化酶主要包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和过氧化氢酶(catalase,CAT),可协助清除自由基,减轻和消除氧化损伤[30]。在本研究中,Cu/Zn sod基因的表达水平在高浓度染毒组出现明显增加,表明机体出现ROS 的增加。GPx 是机体内广泛存在的非酶抗氧化剂,具有清除脂类氢过氧化物以及H2O2等生物学作用。CAT 是催化H2O2分解的酶,主要存在于细胞的过氧化物体内,是过氧化物酶体的标志性酶。与ZHANG等[31]研究结果一致,为了避免ROS产生所引起的氧化损伤,在溴乙酰胺暴露后抗氧化酶SOD、CAT和GPx的基因水平出现了增加。血红素加氧酶(heme oxygenase,HO)-1 是一种众所周知的细胞保护性限速酶,可将血红素分解为一氧化碳、胆绿素和铁,作为内在有效的抗氧化剂[32];HO-1 的表达由核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)介导[33],nrf2和ho-1是被广泛研究的抗氧化基因,研究表明可通过激活Nrf2/HO-1抗氧化途径减轻辐射引起的斑马鱼神经氧化损伤[34]。本研究结果发现溴乙酰胺暴露后,nrf2、ho-1的基因出现明显上调,说明溴乙酰胺暴露后导致斑马鱼体内ROS 的产生从而激活了斑马鱼的抗氧化系统。
综上所述,本研究通过对斑马鱼行为学、神经发育相关基因、ROS 水平和抗氧化系统相关基因的研究,探讨了溴乙酰胺对斑马鱼神经毒性的作用及其毒性的分子相关机制,表明溴乙酰胺可能通过诱导氧化应激,抑制神经系统发育相关基因的表达,导致斑马鱼神经发育毒性。但本研究尚存在不足,如溴乙酰胺诱导的氧化应激与神经毒性之间是否存在直接的因果关系还需要通过使用抗氧化剂N-乙酰-L-半胱氨酸进一步验证。
