Dicer1、miR-155表达在亚砷酸钠致大鼠肝损伤中的作用
2021-07-15时明阳胡倩毕顶念汪红玲张爱华胡勇
时明阳,胡倩,毕顶念,汪红玲,张爱华,胡勇
贵州医科大学 a.公共卫生学院 b.环境污染与疾病监控重点实验室,贵州 贵阳 550025
地方性砷中毒,简称地砷病,是一种以多系统、多脏器损伤为主要特点的慢性砷中毒;除典型的皮肤损害以外,突出特点是肝损害严重。该病发病机制不清,已成为制约其有效防控的难点[1-2]。目前,砷诱导氧化应激学说得到广泛认可,但机制尚未明确。深入研究其机制可以更好地了解砷引起多系统、多脏器损害的原因,为地砷病的针对性防治提供科学依据[3]。
超氧化物歧化酶1(superoxide dismutase 1,SOD1)是人体内的一种重要抗氧化酶。本课题组前期发现,砷可致人和大鼠SOD1 mRNA 转录水平增高,但其蛋白表达水平却下降,这提示可能存在某种转录后调节机制抑制SOD1 的翻译[4-5]。
微小核糖核酸(miRNA)是一类内源性非蛋白质编码的RNA 分子,一般含有22 个核苷酸,能够参与细胞的基因表达调控。Dicer1 能够对miRNA 前体进行剪切,形成成熟的miRNA[6]。成熟的miRNA 是RNA 沉默复合体(RNA-induced silencing complex,RISC)的重要组成部分,RISC 能通过碱基互补配对的方式与靶mRNA 3’非翻译区(untranslated region,UTR)结合,引起mRNA降解或翻译抑制,导致蛋白表达水平下降。miR-155 是一种常见的miRNA,由B 细胞淋巴瘤的逆转录病毒被启动子插入在整合位点后,激活其转录过程形成,又称B 细胞融合群集。
本课题组前期研究发现,miR-155 在燃煤型砷中毒人群血浆中高表达[7]。应用生物信息学工具Tarbase及网站microRNA.org 分析均发现,miR-155 可与人SOD1-3’UTR 序列结合。为了解miR-155、Dicer1、SOD1在砷致肝损伤中的作用,本研究建立不同浓度亚砷酸钠致大鼠肝损伤模型;通过检测肝砷含量、肝组织病理、氧化应激相关指标及Dicer1、miR-155 和SOD1 的基因及蛋白表达情况,为进一步揭示砷致肝氧化应激损伤的机制提供科学依据。
1 对象与方法
1.1 主要仪器试剂
电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometry,ICP-MS)NexION 2000(美国Thermo),AU400 全自动生化分析仪、光学显微镜(日本OlymPus),MQX200 酶标仪(美国Bio-Tek),亚砷酸钠(美国Sigma),TB Green® Premix Ex Taq II(日本Takara),兔抗Dicer1、SOD1(英国Abcam),辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗小鼠、山羊抗兔二抗、二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色剂(中国Servicebio),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、SOD1、丙二醛(malondialdehyde,MDA)试剂盒(中国南京建成生物研究所)。
1.2 实验动物分组及处理
购买SPF 级80~100 g Wistar 大鼠24 只[辽宁长生生物技术股份有限公司,合格证号为SCXK(辽)2015-0001],雌雄各半,饲养于贵州医科大学实验动物中心清洁级动物房,光照与黑暗各12 h 交替,控制室温为(25±3)℃,湿度为45%~65%。本实验经贵州医科大学实验动物中心伦理委员会批准,审批编号为1900250。经预实验测定大鼠经口亚砷酸钠半数致死量为45 mg·kg-1,根据亚砷酸钠半数致死量的1/4、1/8、1/16 确定大鼠染毒质量浓度(后称浓度)依次为100、50、25 mg·L-1。大鼠适应性喂养1 周后,按体重Z 字形随机分为对照、低/中/高浓度组4 组,每组6 只,雌雄各半,分别自由饮用浓度为0、25、50、100 mg·L-1亚砷酸钠水溶液。24 周后,大鼠禁食24 h,采用0.9%戊巴比妥钠麻醉,心尖取乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝血2 mL后处死,用于转录表达检测;取肝最大叶中间部分置于4%多聚甲醛中固定,用于病理HE染色与免疫组化,其余肝脏-80℃保存,用于酶活性检测。
1.3 一般情况
大鼠饲喂期间记录毛发光泽度、活动度,每周同一时间称量各组动物体重并记录。
1.4 肝砷含量检测
取0.3 g大鼠肝脏加入5 mL硝酸与2 mL过氧化氢,浸泡2 h 后进行微波消解。第一步:1 200 W,120℃,6 min;第二步:1 200 W,180℃,10 min;第三步:1 200 W,190℃,15 min。赶酸至0.5 mL,定容至10 mL后稀释待测。采用ICP-MS 检测肝砷含量,该方法的精密度为1.3%,回收率为95.3%~107.1%。
1.5 肝组织病理改变检测
解剖过程中肉眼观察大鼠肝脏表面质地变化,取肝脏最大叶中间部分置于4%多聚甲醛固定,依次进行脱水、石蜡包埋、HE染色及镜检。
1.6 肝组织氧化损伤指标检测
取肝组织,用冰预冷生理盐水1:9 稀释匀浆后,采用黄嘌呤氧化酶法检测SOD1 活力,二巯双硝基苯甲酸还原法检测GSH-Px 活性,硫代巴比妥酸比色法检测MDA含量。
1.7 大鼠肝组织miR-155、Dicer1 及SOD1转录水平检测
采用实时荧光定量PCR 检测3 项指标的转录情况,Trizol 法提取肝组织总RNA,逆转录为cDNA后,-20℃保存。miR-155 引物:正向5’-CGGCGGTTTAA TGCTAATCGTGAT-3’,反向5’-CCAGTGCAGGGTCCGAGGTAT-3’;内参U6引物:正向5’-CGGCGGTCGTGAAGCGTTCCAT-3’,反向3’-CCAGTGCAGGGTCCGAGGTA T-5’;Dicer1 引物:正向5’-TCTTCTTTCTCCTCATCCTCC-3’,反向5’-TCCCCATA TTGATGGACATGGAAC-3’;SOD1 引物:正向5’-AGCA GAAGGCAAGCGGTGAAC-3’,反向5’-TCCCCATATTGATG GACATGGAAC-3’ ;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物:正向5’-GGCACAGTCAAGGCTGAGA ATG -3’,反向5’-ATGGTGGTGAAGACGCCAGTA-3’。反应条件:95℃ 预变性30 s,95℃变性15s,60℃退火1 min,72℃延伸15 s,共40 个循环。结果以Ct值为统计参数,计算 2-ΔΔCt后进行统计分析。
1.8 肝组织免疫组化
肝组织置于常规4%多聚甲醛固定后脱水、石蜡包埋、切片、脱蜡、抗原修复和阻断内源性过氧化物酶后分别加一抗,体积比分别为1:200(Dicer1)、1:100(SOD1),4 ℃孵育过夜,磷酸盐缓冲溶液(phosphate buffer saline,PBS)冲洗3 次,每次5 min;分别加山羊抗小鼠、山羊抗兔二抗,体积比为1:200,室温孵育30 min 后,PBS 冲洗3 次,每次5 min;DAB显色,自来水冲洗终止染色;苏木素复染细胞核,脱水封片,二甲苯透明,中性树胶封片。采用Image Pro Plus 图像处理系统观察Dicer1、SOD1 表达情况。阳性表达呈棕黄色,200 倍光镜下采集免疫组化图像,每张切片随机采3个不重叠视野,计算平均光密度值。
1.9 统计学分析
数据以均数±标准差表示,使用SPSS 23.0 软件进行统计分析。数据首先进行正态性检验,符合正态分布时多组间比较使用单因素方差分析,进一步两两比较采用LSD-t检验,指标间相关性分析采用Pearson 相关分析。检验水准α=0.05。
2 结果
2.1 一般情况
实验期间,对照组大鼠毛发光泽,活动正常,生长发育良好,能够正常饮水和进食;各染砷组大鼠活动度下降,毛色暗淡,毛发质地粗糙,尤以高浓度组明显,甚至出现个别大鼠躁狂异常。
2.2 体重
染毒6、12、18、24 周后,各组间大鼠体重差异均存在统计学意义(F=3.59、4.04、3.89、4.63,均P<0.05)。与对照组比较,染毒6、12、18、24 周后,中、高浓度组大鼠体重均下降(P<0.05);与低浓度组比较,染毒12、18、24 周后,高浓度组大鼠体重均下降(P<0.05)。结果见图1。
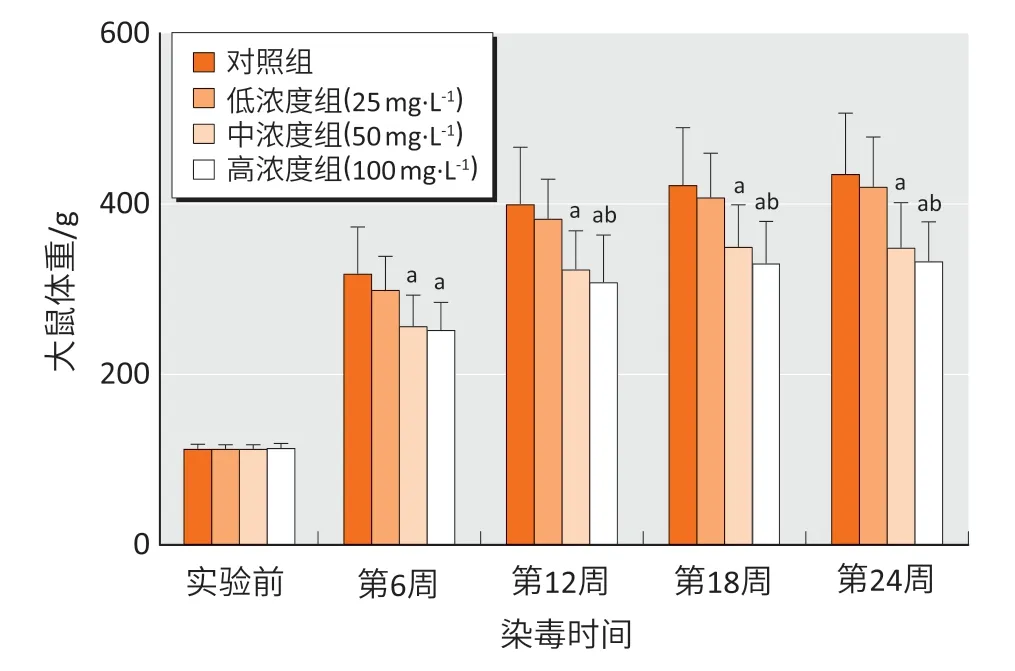
图1 亚砷酸钠染毒后大鼠体重变化(n=6)Figure 1 The changes in body weight of rats following sodium arsenite treatment (n=6)
2.3 肝砷含量
对照及低、中、高浓度染毒组大鼠肝砷含量分别为(0.10±0.02)、(1.35±0.08)、(1.91±0.20)、(2.28±0.09)μg·g-1。各组间大鼠肝砷含量差异具有统计学意义(F=333.38,P<0.05)。与对照组相比,各染砷组肝砷含量均升高(P<0.05);与低浓度组相比,中、高浓度组肝砷含量均升高(P<0.05);与中浓度组相比,高浓度组肝砷含量也升高(P<0.05)。
2.4 HE染色结果
HE 染色结果可见:对照组肝组织小叶结构完整,肝索结构清晰,肝细胞排列规则,胞质丰富,形态正常,未见明显异常;随着染砷浓度增加,肝细胞变性、坏死增多,细胞空泡明显,汇管区淋巴细胞浸润加重,中、高浓度组肝组织可见明显的炎性坏死小灶。结果见图2。
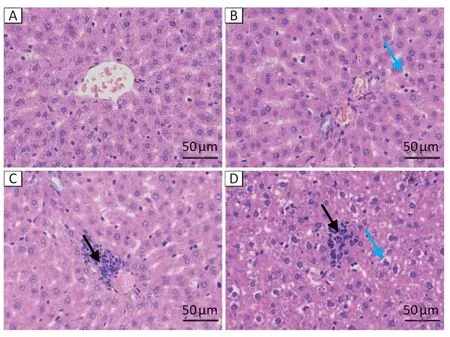
图2 亚砷酸钠染毒24 周后大鼠肝组织病理改变(HE染色)Figure 2 The pathology changes in liver tissues of rats following sodium arsenite treatment (HE staining)
2.5 肝匀浆氧化应激指标
各组间SOD1、GSH-Px 酶活性,MDA 含量差异均具有统计学意义(F=21.43、5.17、8.54,均P<0.05)。与对照组比较,各染砷组SOD1 酶活性均下降,高浓度组GSH-Px 酶活性下降,中、高浓度组MDA 含量均升高(均P<0.05)。与低浓度组比较,高浓度组SOD1、GSH-Px 酶活性均下降,MDA 含量升高(均P<0.05);与中浓度组比较,高浓度组SOD1 酶活性下降,MDA含量升高(均P<0.05)。结果见表1。
表1 亚砷酸钠染毒24周后大鼠肝匀浆SOD、GSH-Px酶活性及MDA含量变化(±s,n=6)Table 1 The changes in SOD and GSH-Px enzyme activities and MDA contents in liver homogenate of rats following sodium arsenite treatment (±s,n=6)
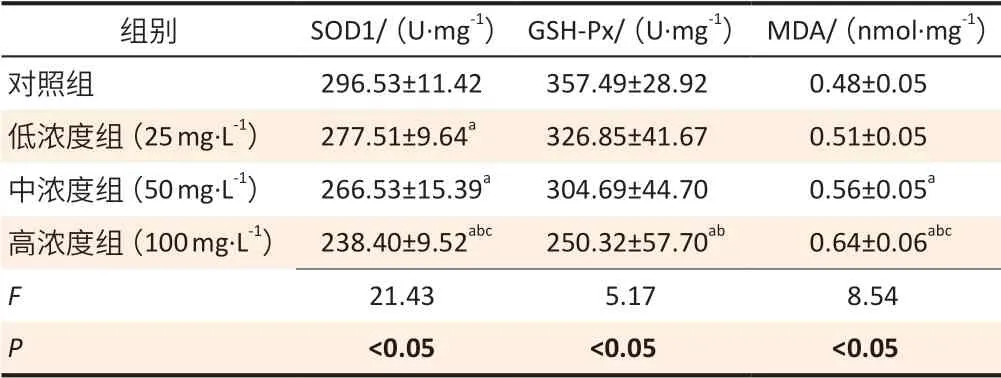
表1 亚砷酸钠染毒24周后大鼠肝匀浆SOD、GSH-Px酶活性及MDA含量变化(±s,n=6)Table 1 The changes in SOD and GSH-Px enzyme activities and MDA contents in liver homogenate of rats following sodium arsenite treatment (±s,n=6)
[注]a:与对照组比较,P<0.05;b:与低浓度组比较,P<0.05;c:与中浓度组比较,P<0.05。
组别 SOD1/(U·mg-1) GSH-Px/(U·mg-1) MDA/(nmol·mg-1)对照组 296.53±11.42 357.49±28.92 0.48±0.05低浓度组(25 mg·L-1) 277.51±9.64a 326.85±41.67 0.51±0.05中浓度组(50 mg·L-1) 266.53±15.39a 304.69±44.70 0.56±0.05a高浓度组(100 mg·L-1) 238.40±9.52abc 250.32±57.70ab 0.64±0.06abc F 21.43 5.17 8.54 P<0.05<0.05<0.05
2.6 肝组织Dicer1、miR-155 及SOD1 mRNA 转录水平
各组间大鼠肝组织Dicer1、miR-155及SOD1 mRNA转录水平差异均有统计学意义(F=5.26、7.75、10.01,均P<0.05)。与对照组相比,高浓度组肝组织Dicer1 mRNA转录水平升高(均P<0.05);中、高浓度组肝组织miR-155、SOD1 mRNA转录水平均升高(均P<0.05)。与低浓度组相比,高浓度组肝组织Dicer1 mRNA转录水平升高(均P<0.05);高浓度组肝组织miR-155转录水平升高(均P<0.05);中、高浓度组肝组织SOD1 mRNA 转录水平升高(均P<0.05)。与中浓度组相比,高浓度组肝组织Dicer1 mRNA 转录水平升高(均P<0.05)。结果见图3。

图3 亚砷酸钠染毒24周后大鼠肝组织miR-155、Dicer1及SOD1 转录表达(n=6)Figure 3 The transcriptional expressions of miR-155,Dicer1,and SOD1 in liver tissues of rats following sodium arsenite treatment (n=6)
2.7 肝组织免疫组化结果
亚砷酸钠染毒后,各组免疫组化结果见图4。各组间大鼠肝组织Dicer1 及SOD1 蛋白表达差异均有统计学意义(F=17.75、F=38.10,均P<0.05)。与对照组相比,各染砷组肝组织Dicer1 蛋白表达均增高,SOD1蛋白表达均下降(均P<0.05);与低浓度组相比,高浓度组Dicer1 蛋白表达升高,中、高浓度组肝组织SOD1蛋白表达均下降(均P<0.05);与中浓度组相比,高浓度组Dicer1、SOD1 蛋白表达下降(均P<0.05)。结果见图5。
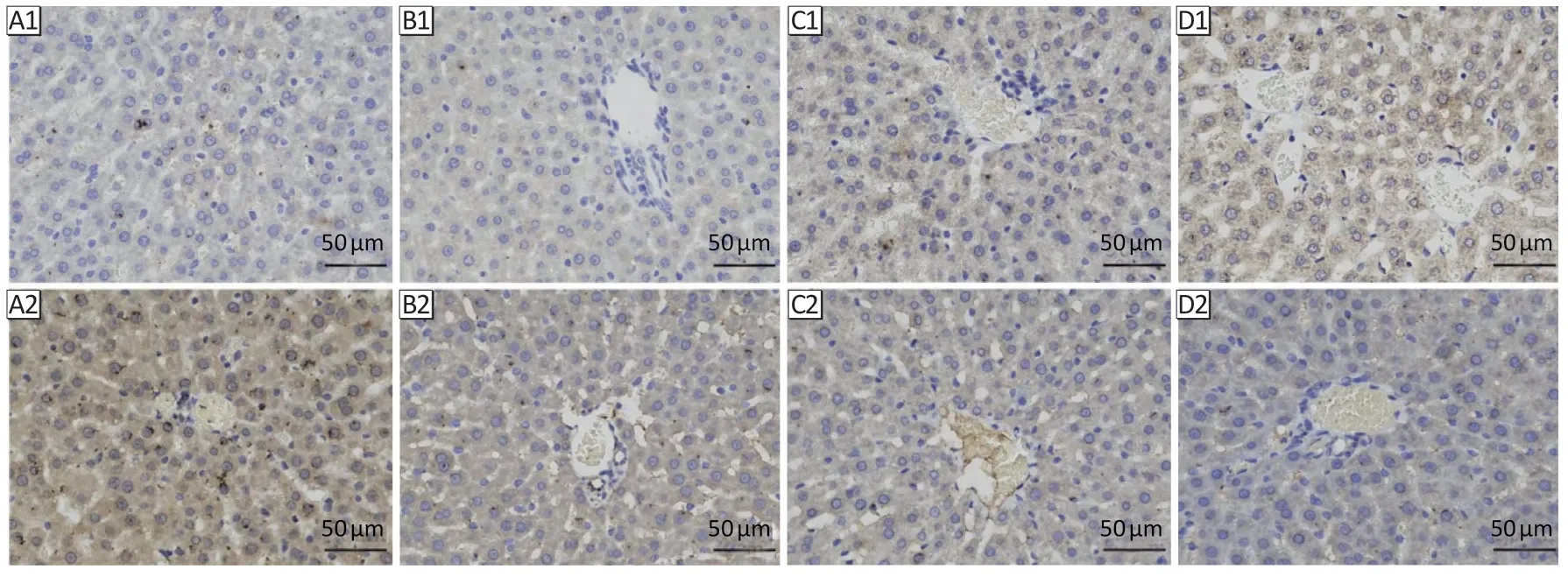
图4 亚砷酸钠染毒24周后大鼠肝组织免疫组化结果Figure 4 The immunohistochemical results of rat liver tissues following sodium arsenite treatment
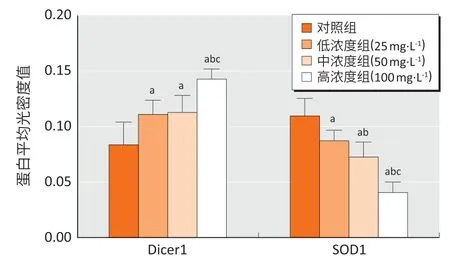
图5 亚砷酸钠染毒24周后各组大鼠肝组织Dicer1、SOD1平均光密度值(n=6)Figure 5 The average optical density of Dicer1 and SOD1 in livertissues of rats following sodium arsenite treatment for 24 weeks (n=6)
2.8 Pearson 相关性分析
亚砷酸钠染毒24 周后,大鼠肝组织miR-155 与Dicer1 蛋白表达水平呈正相关(r=0.670,P<0.05),与SOD1 蛋白表达水平呈负相关(r=-0.604,P<0.05)。
3 讨论
肝脏是砷损害的主要靶器官,砷中毒肝损伤发病率和死亡率较高,病情较严重[8]。砷毒作用复杂,致病机制不清,已成为地砷病防控工作的瓶颈和亟待解决的关键问题[9-10]。本研究发现,亚砷酸钠染毒大鼠,肝组织miR-155、Dicer1、SOD1 的基因表达均升高,肝组织Dicer1蛋白表达升高,SOD1蛋白表达下降。
本研究利用亚砷酸钠建立饮水型砷中毒大鼠肝损伤模型。结果显示,各染砷组大鼠出现活动度下降、毛发暗淡、饮水和摄食量明显减少等中毒症状;随染毒浓度增加,大鼠体重增长缓慢,肝砷含量增加,且存在明显的剂量-效应关系。该结果提示,砷已对大鼠产生毒性作用和肝脏蓄积效应。进一步病理学检查发现,各染砷组大鼠出现不同程度的病理学改变。上述结果表明,饮水型砷中毒大鼠肝损伤模型构建成功。
SOD1、GSH-Px 是两种重要的超氧自由基清除剂,MDA 是脂质过氧化终产物,它们的水平可反映机体氧化应激水平[11]。结果发现,随着染砷浓度增加,大鼠肝匀浆SOD1、GSH-Px 活性均下降,而MDA 含量均上升。该结果提示,砷诱导了氧化应激,机体内产生的过氧化产物不能被及时清除而大量堆积,可能造成肝脏损伤。为进一步探讨砷诱导氧化应激与肝损伤的机制,本研究检测了SOD1 基因表达。结果发现,随着染砷浓度增加,SOD1 mRNA 表达逐渐增加而其蛋白表达逐渐下降;与课题组前期研究结果一致[4-5]。这提示,可能存在某种转录后调控机制,抑制了SOD1蛋白表达。
mRNA 3’UTR 在基因表达调控上起重要作用[12]。成熟的miRNA 是形成RISC 的最重要的组成成分,该RISC 复合体能通过碱基互补配对的方式与靶mRNA 3’UTR 结合[13]。当两者互补配对程度高时,RISC 会发挥作用导致靶mRNA 降解或翻译抑制[14]。在本研究中,随着亚砷酸钠染毒浓度增加,大鼠肝组织miR-155表达量均逐渐上升;提示亚砷酸钠能够促进miR-155表达。相关性分析显示,大鼠肝组织miR-155 水平与SOD1 蛋白表达水平呈负相关,结合生物信息学工具的发现,推测miR-155 可与人SOD1-3’UTR 序列结合。高表达的miR-155 可能通过与SOD1 3’UTR 结合,抑制SOD1 翻译,导致SOD1 蛋白表达减少。
Dicer1能够剪切miRNA前体,形成成熟的miRNA[15]。miR-155 是一种常见的miRNA,提示Dicer1 可能通过剪切miR-155 前体,生成成熟的miR-155。本研究发现,Dicer1 的转录和蛋白表达均随亚砷酸钠染毒浓度的增加而增加;相关性分析也发现,大鼠肝组织miR-155 水平与Dicer1 蛋白表达水平存在明显的正相关关系。该结果提示,砷引起Dicer1 表达增加,高表达的Dicer1 可能增加对miR-155 前体的剪切,导致成熟miR-155增多而调控下游靶基因的表达。
综上,本研究发现:砷诱导Dicer1 基因及蛋白表达增加,可能促进miR-155 高表达后与SOD1 3’UTR 区结合,抑制SOD1 翻译,导致SOD1 蛋白表达和酶活性下降,进而造成肝脏损伤。本研究为进一步揭示砷致肝损伤的机制及寻找新的药物靶点提供了科学依据,但本实验不能确切说明miR-155对SOD1的靶向作用,还需进一步通过miR-155的高低表达实验验证miR-155和SOD1 3’UTR指标间的相互关系。
