组蛋白H3K36me3在砷致大鼠肝氧化损伤中的作用
2021-07-15吕佳鑫马璐张爱华
吕佳鑫,马璐,张爱华
贵州医科大学 a.环境污染与疾病监控教育部重点实验室 b.公共卫生学院毒理学系,贵州 贵阳 550025
砷是危害人体健康的常见环境污染物,砷暴露可引起多系统多脏器的损伤,肝脏是其主要的靶器官之一[1]。研究显示,氧化应激是砷致肝脏损伤的主要机制,砷暴露可以通过促进氧自由基产生,抑制抗氧化酶表达水平及活性,破坏肝脏氧化-抗氧化平衡,诱导肝脏的氧化损伤,从而进一步引起肝脏持续性炎症等损伤的发生[1-2]。目前研究发现除经典的氧化应激调控通路外,表观遗传修饰是调控砷诱导氧化损伤的新途径。如砷可通过干扰DNA 甲基化、miRNA 的正常表达,造成其靶向的抗氧化酶转录抑制等方式,参与砷诱导氧化损伤的进程[3-4]。组蛋白修饰是表观遗传调控的另一种重要机制,课题组前期研究发现H3 第36位赖氨酸三甲基(H3 lysine 36 trimethylation,H3K36me3)是参与砷诱导体外细胞氧化应激调控的关键靶点[5]。近年研究也揭示了H3K36me3 的水平异常可参与肝脏疾病的发生发展[6]。
为了探讨H3K36me3 是否参与砷诱导肝氧化损伤的调控,本研究在课题组成功建立砷暴露致大鼠肝损伤模型基础上,检测大鼠肝组织中砷水平、组蛋白H3K36me3 修饰水平以及尿8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)和肝脏丙二醛(malondialdehyde,MDA)等氧化损伤指标水平,通过分析肝砷、肝组织H3K36me3、氧化损伤指标之间的关系以及H3K36me3 对砷致肝氧化损伤的中介效应,探讨H3K36me3 在砷致肝氧化损伤中的作用,为砷致肝氧化损伤的调控机制研究寻找特异的表观遗传靶点提供依据。
1 对象与方法
1.1 主要仪器与试剂
电感耦合等离子体质谱仪(ICP-MS)、超高效液相色谱-串联四级杆质谱仪(UPLC-MS/MS)、酶标仪(Thermo Fisher,美国),全自动样品快速研磨器(上海净信实业发展有限公司,中国),高速冷冻离心机(Eppendorf,德国)。亚砷酸钠(Sigma,美国),浓硝酸、硫酸、过氧化氢(天津市大茂化学试剂厂,中国),蛋白酶抑制剂Cocktail(Roche,瑞士)、H3K36me3 抗体(Abcam,英国),lgG抗鼠二抗(Proteintech,美国),H3K36me3 重组蛋白标准品(Active Motif,美国),四甲基联苯(TMB)显色剂、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海碧云天生物技术研究所,中国),MDA 检测试剂盒(南京建成生物工程研究所,中国),8-OHdG 的同位素(13C10、15N5)内标、8-OHdG 标准品(Sigma,美国)。
1.2 实验动物分组及处理
本研究依托课题组前期建立的砷中毒大鼠肝损伤模型[7],动物模型建立如下:32 只健康初断乳Wistar 大鼠,购自辽宁长生生物技术有限公司[合格证号为SCXK(辽)2015-0003]。其中体重为80~100 g,雌雄各半。实验期间,大鼠饲养在清洁级动物房内(室温22~24℃,湿度60%~70%,光照/黑暗交替12 h/12 h),分笼饲养,自由摄取饲料,自由饮水。将大鼠按体重采用随机数字表法分为对照组,低、中、高染砷剂量组,每组8 只。大鼠亚砷酸钠半数致死量(LD50)为41 mg·kg-1(以体重计,后同),按照亚慢性毒性试验剂量设计原则,低、中、高染砷组分别给予2.5(1/16 LD50)、5.0(1/8 LD50)、10.0(1/4 LD50)mg·kg-1(以体重计,后同)亚砷酸钠溶液,对照组给予去离子水,灌胃染毒,灌胃量为10 mL·kg-1,每周连续染毒6 d,共处理4个月。实验终期采集大鼠24 h尿样,大鼠处死后取肝脏样本。依据大鼠肝组织病理形态及肝功能指标(总胆汁酸、谷氨酰胺转移酶)改变与亚砷酸钠的剂量-反应关系来判定砷中毒大鼠肝损伤模型的成功构建[7-8]。本研究经贵州医科大学伦理委员会审查批准(批准号:
1403059)。
1.3 肝砷水平检测
肝组织经消化处理(0.3 g肝组织于6.0 mL浓HNO3及2.0 mL H2O2溶液中,微波消解后用2% HNO3定容至25 mL,微孔滤膜过滤)于ICP-MS 上机检测,采用标准曲线法根据样品的峰面积计算肝中砷的质量分数,以每克肝中砷元素的质量表示。
1.4 肝中组蛋白提取及H3K36me3修饰水平的测定
肝组织与预冷裂解缓冲液按1:6 于研磨仪中研磨后离心、弃上清,留沉淀,酸抽提法提取组蛋白,BCA 蛋白浓度测定试剂盒进行定量;采用ELISA 法检测H3K36me3 水平,100 μL·孔-1的H3 抗体稀释液(1:10 000)包被96孔板,4°C过夜;PBST(包含1×PBS、0.05% Tween-20)清洗3 次,含5%脱脂牛奶的PBST 200 μL·孔-1,室温封闭2 h;PBST清洗,每孔加入100 μL H3K36me3 重组蛋白标准品(0、0.313、0.625、1.25、2.5、5、10 μg·mL-1)及样品(20 μg·mL-1),室温摇床孵育1.5 h;PBST 清洗,每孔加入100 μL H3K36me3 抗体(1:3 000)室温摇床孵育1 h;PBST 清洗,每孔加入100 μL IgG 抗鼠二抗(1:5 000),室温摇床孵育1 h;PBST 清洗,每孔加入200 μL TMB 显色液避光室温孵育0.5 h后,加入50 μL 2 mol·L-1硫酸终止显色;在酶标仪波长为450 nm 处检测吸光度(D)值,并根据标准曲线计算H3K36me3 的质量分数,以每克肝中组蛋白H3K36me3的质量表示。
1.5 尿8-OHdG 水平的测定
将处理的尿液混匀液[150 μL尿液+150 μL 10 mmol·L-1醋酸钠(NaAc,pH=7.5)+7.5 μL 400 μg·L-1同位素(13C,15N2)内标8-OHdG]于被甲醇活化亲水亲油平衡的固相萃取小柱(60 mg,3cc,Waters Oasis)中,将待测物在小柱中经过富集、去离子水冲洗、洗脱等过程,放置氮吹仪吹至近干。加入150 μL 甲醇流动相,经离心、取上清液于上样瓶中。用UPLC-MS/MS 分析标品、样品中8-OHdG 及同位素(13C,15N2)内标8-OHdG 的峰面积,根据标准曲线用内标法计算尿中8-OHdG 的质量浓度,以每毫升尿液8-OHdG 的质量表示。
1.6 肝MDA水平的测定
肝组织与裂解液按1:9配置10%肝组织匀浆稀释液,离心、弃沉淀,取上清。采用BCA蛋白浓度测定试剂盒进行蛋白定量。采用硫代巴比妥酸法(TBA 法),根据MDA 检测试剂盒的操作步骤及计算方法完成检测,以试剂盒推荐的单位nmol·mg-1(以蛋白计)表示肝组织中MDA水平。
1.7 统计学分析
采用SPSS 22.0 对实验数据进行分析。计量资料进行正态性检验及方差齐性检验,非正态分布数据以中位数(P25,P75)表示,多组间比较采用Kruskal-WallisH法,采用Kruskal-Wallis 单因素方差分析法进行两两比较,经对数变换后采用线性回归进行趋势分析;正态分布且方差齐数据以±s表示,多组间比较采用单因素方差分析,进一步采用SNK 法进行两两比较,趋势分析采用线性趋势检验;相关性分析采用Pearson 分析方法。将肝砷水平对数转换后进行中介效应检验,肝砷水平为自变量,8-OHdG、MDA 水平为应变量,肝组蛋白H3K36me3 水平为中介变量,建立“肝砷—H3K36me3—8-OHdG”及“肝砷—H3K36me3—MDA”中介检验模型,通过PROCESS 3.2 软件采用Bootstrap 法对H3K36me3 修饰水平在砷暴露与肝氧化应激的中介效用进行检验[9],检验水准α=0.05。
2 结果
2.1 砷染毒大鼠肝脏砷水平、H3K36me3 修饰水平及氧化损伤指标的改变
4 个指标不同染毒组间比较差异有统计学意义(均P<0.05),见表1;与对照组相比,低、中、高砷剂量组肝砷水平、尿8-OHdG 和肝MDA 水平升高(均P<0.05),而肝H3K36me3修饰水平降低(P<0.05);肝砷水平、尿8-OHdG 和肝MDA 水平随染砷剂量的增加逐渐升高(P趋势<0.01),而肝H3K36me3修饰水平逐渐降低(P趋势<0.01),见表1。
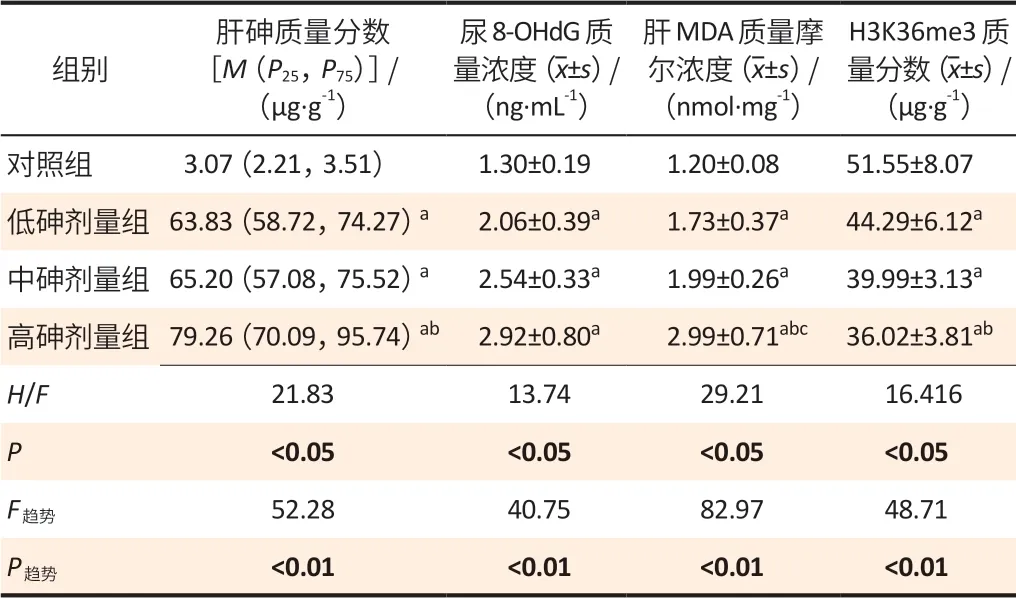
表1 砷染毒大鼠肝砷水平、H3K36me3 修饰及氧化损伤水平(n=8)Table 1 The levels of arsenic,H3K36me3 modification,and oxidative damage in liver of rats exposed to arsenic (n=8)
2.2 大鼠肝砷水平、肝H3K36me3 修饰水平、氧化损伤指标间的关联性
大鼠肝砷水平与肝H3K36me3 修饰水平呈负相关(r=-0.715,P<0.01),与尿8-OHdG、肝MDA 水平呈正相关(r=0.701、0.748,均P<0.01),且肝H3K36me3 修饰水平与尿8-OHdG、肝MDA水平呈负相关(r=-0.660、-0.683,均P<0.01);此外,尿中8-OHdG 水平与肝中MDA水平呈正相关(r=0.778,P<0.01)。
2.3 H3K36me3的中介效应
砷暴露对8-OHdG 和MDA 的总效应、直接效应及以H3K36me3 介导的中介效应均有统计学意义(均P<0.05),且H3K36me3 在砷致8-OHdG 和MDA 水平的中介效应分别占总效应的30.97%、38.91%,见表2。

表2 H3K36me3 介导砷暴露与氧化损伤的中介效应(n=8)Table 2 Mediating effect of H3K36me3 on arsenic exposure and oxidative damage (n=8)
3 讨论
砷暴露致机体多系统多脏器的毒作用机制研究一直以来备受国内外学者关注。肝脏作为砷毒性蓄积和代谢的主要靶器官,其机制研究除氧化应激、遗传损伤、信号通路转导等途径外,表观遗传修饰也是砷暴露与肝细胞损害或肝组织结构和功能异常的重要媒介,其表达的改变可能是肝脏损害或疾病恶变的早期、关键生物学标志[2,8]。因此,进一步探究砷致表观遗传修饰的改变对揭示砷致肝损害机制及针对性的防治具有重要的意义和价值。组蛋白修饰是表观遗传修饰的重要机制之一。本课题组前期发现,组蛋白H3K36me3 可能是砷诱导机体损伤的表观遗传调控新靶点。饮水型及燃煤型砷中毒人群研究显示,随着尿砷水平的升高,人外周血淋巴细胞H3K36me3 的修饰水平发生相应改变[10-11]。体外研究显示H3K36me3 可通过调控DNA修复酶[O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)]、氧化应激相关基因的表达参与砷诱导DNA 损伤、氧化损伤的发生[12,5],但砷暴露诱导肝脏H3K36me3 改变与其介导砷中毒肝脏早期损伤效应的关系尚不清楚。本课题组前期成功构建了砷暴露致大鼠肝损伤模型,发现随着染砷剂量的增加,大鼠肝脏出现不同程度的炎性浸润等病理改变及肝功能指标的紊乱[7-8]。本研究在此基础上,从整体动物探讨砷暴露大鼠肝脏H3K36me3 的表达水平,分析H3K36me3 在砷致大鼠肝氧化损伤中的作用,为进一步探索砷致肝损伤的表观遗传机制提供新依据。
有研究表明,H3K36me3 的修饰改变与多种肝脏疾病密切相关。据文献报道,H3K36me3 表达异常可以通过抑制胆固醇外排基因的表达,阻碍DNA 错配修复机制诱导肝脂肪样变及肝肿瘤的恶化[13-14]。另有研究报道肝氧化损伤是诱导肝脏持续炎症及远期肝肿瘤发生的关键事件[15]。砷暴露诱导肝氧化损伤的多种途径中,氧自由基增多引发的致突变损伤产物8-OHdG、脂质过氧化物MDA 是评价机体氧化应激及氧化损伤程度的敏感生物标志物。本研究发现,随着砷暴露剂量的增加,大鼠尿8-OHdG、肝MDA 的水平升高,尿8-OHdG 与肝MDA 具有相同的变化趋势,提示尿8-OHdG 改变可间接反映肝中氧化损伤的情况,且尿8-OHdG、肝MDA 均与大鼠肝中砷内负荷存在剂量-效应关系,表明砷暴露诱导的氧化损伤是砷致大鼠肝损伤发生发展的直接原因。近年研究发现,组蛋白修饰可以通过调控氧化应激通路中关键因子及抗氧化酶的表达诱导机体氧化损伤的发生[16],推测组蛋白修饰也可能是诱导靶器官氧化损伤的重要环节。本研究发现,大鼠肝H3K36me3 的表达随着砷暴露剂量的增加不断降低,且其与氧化损伤指标(尿8-OHdG、肝MDA)水平呈负相关,提示砷诱导大鼠氧化损伤的进程中,H3K36me3 修饰水平的改变在其中扮演了重要角色。
本研究进一步采用中介效应方法探索H3K36me3修饰异常在砷致肝氧化损伤中的贡献。中介效应是指变量间的影响关系(X→Y)不是直接的因果链关系而是通过一个或一个以上变量(M)的间接影响产生的,此时称M为中介变量,而X通过M对Y产生的间接影响称为中介效用,是揭示自变量(X)对应变量(Y)影响的内在机制检验方法,已广泛应用于心理、预防等领域的医学研究[9]。鉴于本研究肝中砷负荷、H3K36me3 与大鼠肝氧化损伤三者的关系满足中介效应分析中中介因素需与暴露因素和结局指标均相关的条件,通过中介效应检验发现砷致大鼠肝氧化损伤指标改变的总影响中,38.91%是通过H3K36me3的中介效应发挥作用,提示H3K36me3 有望作为研究砷致肝氧化损伤机制的新靶点。另外,本课题组前期发现抗氧化活性天然药植物刺梨、银杏能促进机体排砷解毒,且对砷暴露致肝损伤具有保护作用[17-18]。鉴于表观遗传修饰具有可遗传和可逆性的特点,且有研究报道植物类提取剂4β-羟基含烷醇E 可以通过恢复H3K36me3 水平,抑制肝细胞凋亡基因剪切异常,减缓肝癌的进展[19]。基于本研究发现H3K36me3可能是调控砷致肝氧化损伤的潜在靶点,提示以H3K36me3为切入点靶向干预H3K36me3,有可能抑制砷中毒肝损伤的发生发展,为后续干预研究提供了新思路。
综上所述,砷暴露可致大鼠肝H3K36me3 修饰水平降低,且其变化与肝氧化损伤密切相关。本研究初步探索了H3K36me3 在砷致肝氧化损伤中的作用,为后续深入探讨H3K36me3 参与调控砷致肝损伤的机制提供了依据。
(志谢:感谢王大朋老师、朱凯和董令同学在动物模型建立等方面的贡献)
