氟咯草酮对肝细胞BRL-3A的毒性作用
2021-07-15薛黎明徐佳乐冯超邱歆磊林元杰徐骞周志俊卢大胜汪国权
薛黎明,徐佳乐,冯超,邱歆磊,林元杰,徐骞,周志俊,卢大胜,汪国权
1.上海市疾病预防控制中心 a.化学品毒性检定所 b.国家环境保护新型污染物环境监控影响评价重点实验室,上海 200336
2.复旦大学公共卫生学院,上海 200032
氟咯草酮(fluorochloridone,FLC)是一种芽前施用选择性除草剂[1],进入我国市场后被广泛使用[2],但对其毒性研究有限。根据2010年欧洲食品安全局(European food safety authority,EFSA)的报告,FLC 具有雄性生殖毒性以及心血管系统毒性,不具有遗传毒性、致癌性或神经毒性[3]。FLC 的雄性生殖毒性机制为通过促进睾丸支持-生精细胞的氧化应激水平和细胞凋亡水平,进而产生生殖毒性损害[4-5]。研究也发现FLC对雌性仓鼠卵巢细胞及蝌蚪具有遗传毒性[6-8]。目前缺乏系统研究FLC毒性作用的报道,其危害并未引起重视。对FLC亚慢性毒性试验发现其可导致大鼠肝脏系数、血液脂质及血糖水平等变化,FLC 对肝脏损伤及肝功能代谢有一定影响,呈现一定肝毒性[9]。通过建立模拟肝细胞代谢的小鼠3T3 细胞肝微粒孵育体系,考察FLC 肝微粒体孵育后对于3T3 细胞毒性,发现FLC 的细胞毒性增加,表明FLC 经肝代谢后,毒性增强[10]。前期代谢组学结果发现500 mg·kg-1剂量FLC灌胃暴露大鼠尿液中葡萄糖、甘露醇、乳酸、丙酮酸等能量代谢相关代谢物紊乱,导致机体能量代谢异常,表明FLC 的毒性可能与肝脏能量代谢功能异常相关[9,11],而呈现肝毒性,但FLC 体外对肝细胞的毒理作用研究尚未见报道。因此,本研究采用大鼠正常肝细胞BRL-3A作为研究模型,从细胞毒性、氧化损伤和细胞凋亡等角度考察FLC对肝细胞的毒性作用和机制。
1 材料与方法
1.1 材料
BRL-3A肝细胞系购自中国科学院细胞库。主要试剂:杜尔贝科改良伊格尔培养基(Dulbecco’s modified Eagle medium,DMEM)完全培养基、磷酸盐缓冲液(phosphate buffered solution,PBS)、胰酶、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(美国Gibco),FLC(德国Dr.Ehrenstorfer GmbH),噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT;美国Sigma),二甲基亚砜(dimethylsulfoxide,DMSO;中国国药集团化学试剂有限公司),活性氧(reactive oxygen species,ROS)检测试剂盒(中国碧云天生物技术有限公司),二喹啉甲酸(bicin choninic acid,BCA)蛋白定量试剂盒、放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)细胞裂解液(美国Thermo Fisher),eBioscience膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡试剂盒(美国Invitrogen),B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体、Bax抗体(英国Abcam),环氧合酶-3(cyclooxygenase-3,Cox-3)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、核酸提取试剂盒、反转录试剂盒和扩增试剂盒(美国Thermo Fisher),锰超氧化物歧化酶(manganese superoxide dismutase,SOD2)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和GAPDH 引物由生工生物工程有限公司合成;96 孔板、6 孔板、15 mL 离心管、25 cm2培养瓶、75 cm2培养瓶(美国Corning),刻度吸管、计数板(美国Bio-rad),1.5 mL离心管(美国Axygen),水相针式滤器(0.45 μm,中国安谱实验科技股份有限公司)。
1.2 仪器
主要仪器:CO2培养箱(美国Thermo Scientific)、DMI3000 倒置显微镜(德国Leica)、细胞计数仪(美国Bio-rad)、流式细胞仪(美国BD Biosciences)、酶标仪(瑞士Tecan)、水浴超声仪(美国BRANSON)。
1.3 BRL-3A细胞培养
将BRL-3A细胞用胰酶消化至70%脱落,加入培养基终止消化。吹打混匀后以5×105个·瓶-1接种于含1%双抗、10% FBS 的DMEM 培养基中,37℃、5% CO2孵育培养,48 h后传代。
1.4 MTT细胞活性检测
取对数生长期细胞接种,以1×104个·孔-1密度接种于96孔板,置于37℃、5% CO2培养24 h。弃培养基,分别加入0.1 mL 含0.1、1、10、100 μmol·L-1的FLC 培养基,继续培养24 h,每个浓度设立10 个复孔。染毒完成后,每孔加入20 μL MTT溶液(5 mg·mL-1),37℃孵育4 h。弃培养基,加入150 μL DMSO。完成后每轻轻振摇至晶体溶解,用多功能酶标仪测量490 nm处光密度。
1.5 细胞凋亡检测
取对数生长期细胞,以1×105个·孔-1密度接种于6 孔板,置于37℃、5% CO2培养24 h,加入含1、10、100 μmol·L-1的FLC 染毒24 h,按照 Annexin V-FITC 细胞凋亡试剂盒测定细胞凋亡率。用胰酶消化细胞,用标记荧光素FITC 的Annexin V 和碘化丙啶(propidium iodide,PI)染色,采用流式细胞仪测定细胞凋亡水平。
1.6 ROS水平检测
按照方法“1.5”染毒方法对细胞染毒,阳性对照孔中加入4-丁基过氧化氢(Rosup)作为阳性对照,染毒24 h后,采用试剂盒测定细胞内ROS 水平。
1.7 SOD2、GSH-Px 的mRNA表达检测
按照方法“1.5”染毒方法对细胞染毒24 h后,依据试剂盒说明书进行提取总RNA和反转录后,分别对GAPDH、SOD2和GSH-Px进行逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增,引物序列见表1。PCR反应条件:采用预变性95℃ 10 min,变性95℃ 45 s,退火60℃ 45 s,延伸72℃50 s,循环40次,总反应体系10 μL。

表1 引物序列列表Table 1 Primer sequences
1.8 Bcl-2、Bax和Cox3蛋白表达检测
取对数生长期细胞,以2×106个·瓶-1密度接种于75 cm2培养瓶,置于37℃、5% CO2培养24 h,加入含1、10、100 μmol·L-1的FLC 染毒24 h,用预冷的PBS 洗涤3 遍,加入RIPA 细胞裂解液,4℃下裂解30 min 后,12 000×g离心10 min,取上清液,用BCA 蛋白定量试剂盒进行蛋白定量。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacryamide gel electropHoresis,SDS-PAGE)分离后,转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,经5%脱脂牛奶封闭1 h,加入一抗Bcl-2、Bax 和Cox3 抗体,在4℃下孵育过夜,含0.05% Tween20 的三羟甲基氨基甲烷缓冲液(tris buffered saline with Tween 20,TBST)洗3次;室温孵育二抗1 h,TBST 洗3 次,电化学发光法拍照,检测相关蛋白的位置和含量。
1.9 统计学分析
每组试验重复3 次,结果采用平均值±标准差表示,统计分析均采用SPSS 18.0 软件进行处理,多组间均数比较采用单因素方差分析(One-Way ANOVA),组间均数两两比较采用LSD-t检验。差异有统计学意义,检验水准α=0.05。
2 结果
2.1 细胞活性
如图1所示,在染毒剂量为0.1 μmol·L-1时,染毒组与对照组之间BRL-3A 细胞活性差异并无统计学意义(P>0.05)。1、10、100 μmol·L-1组细胞活性较对照组明显下降(P<0.05),且呈现随浓度的升高而降低的趋势。

图1 MTT法测定FLC对BRL-3A细胞存活率的影响(n=3)Figure 1 Effect of FLC on the survival rate of BRL-3A cells by MTT assay (n=3)
2.2 ROS,GSH-Px、SOD2 的mRNA水平
细胞内ROS 结果如图2A 所示。阳性对照组ROS提高至(270.4±30.4)%,说明试剂盒有效。染毒浓度1 μmol·L-1时ROS 含量为对照组的(110.3±15.4)%,100 μmol·L-1时为(98.4±16.8)%,差异都不具有统计学意义(P>0.05),染毒浓度为10 μmol·L-1时ROS 含量升高至对照组的(126.2±12.4)%(P<0.05)。与对照组相比,各染毒组中GSH-Px和SOD2的mRNA 表达量均有下调,差异具有统计学意义(P<0.05)(见图2B)。

图2 FLC染毒BLR-3A细胞中ROS 水平(A)和 GSH-Px(B)和SOD2(B)的mRNA相对表达含量(n=3)Figure 2 The levels of ROS (A) and GSH-Px (B) and SOD2 (B)mRNA in BLR-3A cells exposed to FLC (n=3)
2.3 细胞凋亡
细胞凋亡检测结果如图3A~3D 所示。随染毒剂量上升,细胞死亡率呈现逐渐升高的趋势:与对照组比较,1、10、100 μmol·L-1的FLC 染毒组细胞死亡率分别升高至(1.6±0.2)、(2.7±0.1)和(4.7±0.3)倍;细胞凋亡率(早期凋亡及晚期凋亡之和)也上升(图3E):与对照组比较,染毒组分别升高至(2.3±0.2)、(2.2±0.1)和(12.5±0.8)倍,与细胞活性MTT结果趋势一致。
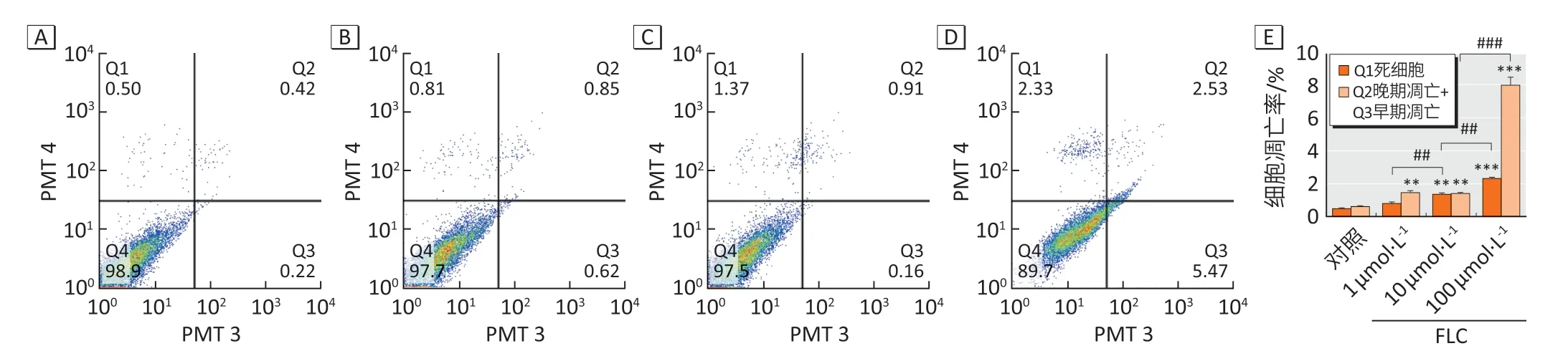
图3 FLC染毒对BRL-3A细胞凋亡水平流式细胞图像Figure 3 Effect of FLC on apoptosis of BRL-3A cells by flow cytometry
2.4 Bcl-2、Bax 和Cox3蛋白表达水平
蛋白含量检测结果如图4所示。与对照组相比,10、100 μmol·L-1暴露组促凋亡蛋白Bax的蛋白表达增高至(1.2±0.1)和(1.4±0.1)倍(P<0.001),Bcl-2 的蛋白表达降低至(41.6±4.0)%和(41.9±3.2)%(P<0.001),Bcl-2/Bax 值降低至(35.2±4.0)%和(30.9±3.1)%(P<0.001)。Cox3 表达在10、100 μmol·L-1染毒浓度时下调至(84.1±8.0)%和(54.2±4.2)%。

图4 FLC染毒BLR-3A细胞中Cox3、Bcl-2和Bax相对蛋白表达Figure 4 Relative expression of Cox3,Bcl-2,and Bax proteins in BRL-3A cells exposed to FLC
3 讨论
肝脏是人体代谢毒性化合物的重要器官,肝细胞凋亡和氧化应激上升是肝细胞损伤的重要表现。线粒体功能调节细胞凋亡,机制是当线粒体不能产生足够的ATP 而导致细胞功能衰退和死亡,而ROS引发的氧化应激是引起肝损伤的生理基础。体外研究也发现FLC 可使睾丸支持-生精细胞共培养体系中的过氧化氢酶、超氧化物歧化酶、总谷胱甘肽过氧化物酶活性降低和凋亡线粒体通路中Bax、Cyt-c、Caspase-9和Caspase-3的mRNA 表达升高[4-5],本研究对大鼠肝细胞进行FLC 染毒,考察了氧化应激和细胞凋亡通路相关指标的影响。结果表明,FLC 可抑制细胞活性,促进细胞凋亡,且呈现剂量依赖性。其中高剂量100 μmol·L-1FLC 暴露可以促进肝细胞凋亡,降低Bcl-2/Bax 的表达比例,降低SOD2和GSH-Px的mRNA 表达。
在通常情况下,少量的ROS 能在机体中发挥生理功能,但在毒性化合物暴露时,大量产生的ROS 会促使细胞凋亡。Bcl-2 蛋白可以抑制由毒物暴露引起的细胞凋亡,甚至死亡,增强细胞对DNA 损伤因子的抵抗性,Bcl-2基因的表达越高证明细胞对毒物的抵抗性越强。而Bax基因是最主要的凋亡基因,能拮抗Bcl-2基因的保护效果,促使细胞凋亡。Bcl-2与Bax两基因之间的比例关系决定了细胞凋亡的状态,Bcl-2/Bax 值越高,抑制细胞凋亡作用越强。本研究结果发现,FLC 染毒后,BLR-3A 细胞Bax 表达增加而Bcl-2 表达被抑制,说明FLC确实能够导致肝细胞凋亡。
ROS 异常增高使体内氧化与抗氧化作用失衡,导致中性粒细胞炎性浸润,产生大量氧化中间产物,从而导致组织损伤。SOD 催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用。SOD2 主要存在于线粒体基质中,其表达以及活性的降低将导致对线粒体内产生的超氧离子的清除作用降低,从而导致线粒体DNA的过氧化损伤。GSH-Px 是一种重要的过氧化物分解酶,催化GSH变为氧化型谷胱甘肽,使有毒的过氧化物还原成无毒的羟基化合物,保护细胞膜的结构及功能不受过氧化物的干扰及损害。本试验结果发现FLC 染毒后,BLR-3A细胞中ROS 含量升高,SOD2、GSH-PxmRNA 表达降低,表明FLC 能够促进肝细胞的氧化应激状态,引起肝损伤。Cox-3 是一种新型Cox 亚型结构,具有环氧合酶和过氧化物酶两种活性,具有抗炎作用,可降低ROS 引起的炎症浸润,同时参与细胞凋亡[12-13]。本试验发现FLC 染毒后BLR-3A 细胞中Cox-3 水平降低,进一步证实了FLC可引起细胞炎症损伤。
综上,本研究发现在100 μmol·L-1的FLC 剂量暴露时,大鼠肝细胞的细胞活性降低,细胞死亡率和凋亡率升高,氧化应激水平升高,表明FLC 对肝细胞具有确切的毒性作用,而毒性机制可能是通过引起肝细胞的氧化损伤,进一步促进细胞凋亡和死亡。
