广州孕妇孕期邻苯二甲酸酯暴露水平及其与妊娠结局的关系
2021-07-15陈甘讷黄伟雯李洪庆黄婉平
陈甘讷,黄伟雯,李洪庆,黄婉平
广州市花都区妇幼保健院保健部,广东 广州 510800
邻苯二甲酸酯(phthalates,PAEs)是普遍存在的化学增塑剂,可以从各种塑料制品中逸出,迁移至环境和食物中,并通过膳食、饮水、皮肤和呼吸等途径进入人体。PAEs 被我国环境监测总站和美国国家环保署列为环境优先控制污染物。PAEs 是已知的环境内分泌干扰素,具有神经发育毒性、细胞毒性、生殖毒性等[1],可引起卵泡和类固醇生成缺陷。最近的研究已经确定卵巢是PAEs 毒性的靶标[2]。PAEs 暴露在我国孕妇中很普遍[3],其与妊娠结局的关系尤其令人关注,因为胎儿发育过程中激素的紊乱[4]可能影响胎儿的生长[5],导致不良的妊娠结局[6],并对健康有潜在的长期影响[7-8]。本研究基于队列研究数据,通过对孕妇分娩时母血和脐血血清中5 种PAEs 代谢物(phthalate metabolites,MPAEs)—邻苯二甲酸(2-乙基己基)[mono(2-ethylhexyl) phthalate,MEHP]、邻苯二甲酸单苄基酯(monobenzyl phthalate,MBzP)、邻苯二甲酸单丁酯(mono-n-butyl phthalate,MnBP)、邻苯二甲酸单甲酯(monomethyl phthalate,MMP)、邻苯二甲酸单乙酯(monoethyl phthalate,MEP)含量的检测,探讨母血和脐血中MPAEs 与新生儿出生体重、小于胎龄儿(small for gestational age,SGA)和自发早产之间的关系。
1 对象与方法
1.1 研究对象
2017年10月—2019年6月期间进入广州市花都区早产儿出生队列的孕妇。纳入妊娠结局为胎龄≥24周、单胎活产的孕妇。排除多胎、死胎、出生缺陷和信息不完整的孕妇。共采集了860 对母子的血液标本,其中4 对标本因不合格未进行检测,1 对只有脐血检测结果故排除,7 例出生缺陷被排除,共有848 对母子被纳入本次研究当中。本研究获得了广州市花都区妇幼保健院伦理委员会的批准(批号:201707010239),所有进入队列的孕妇都签署了知情同意书。
1.2 研究方法
1.2.1 调查方法采用自行设计的量表,在分娩后,由调查员对住院分娩孕妇进行面对面访谈并填写。问卷内容包括:孕妇的基本信息、生活行为方式、妊娠情况及新生儿基本情况等。血液样本在孕妇分娩后立即进行采集,用干燥管采集母亲静脉血和脐带血各5 mL,并在样本采集后2 h 内,以3 000×g的速度离心30 min以分离血清,每天在低温条件下外送至广州市达安临床检验中心,置于在-80℃冰箱中保存待用。
1.2.2 PAEs 的测定采用酶解代谢物、液液萃取、高效液相色谱-串联质谱法的方法检测5 种MPAEs(MEHP、MBzP、MnBP、MMP、MEP)。邻苯二甲酸单酯标准品购于美国AccuStandard 公司,使用13C 标记的5 种MPAEs 标准物质作为内标物,内标物质均购于美国剑桥同位素实验室。预先配制标准溶液,血清样品处理方法和液液萃取方法参考文献[9],200 μL 血清样本加入同位素内标,用乙腈萃取后干燥,用磷酸二氢钠缓冲液(pH=4.66)复溶,加入β-葡萄糖苷酸酶溶液37℃ 90 min,以避免检测过程中的外源性干扰,经乙酸乙酯萃取后上样检测;采用高效液相色谱-串联质谱法测定母血和脐血5 种PAEs 代谢物含量,测定方法参考Kato 等[10]改进的方法,使用日本岛津公司超高效液相色谱仪Nexera UHPLC LC-30A、美国SCIEX公司 Triple QuadTM 6500+MS/MS系统进行定量分析。MEHP、MBzP、MnBP、MMP、MEP 的检出限(limit of detection,LOD)为0.1 μg·L-1,如果质量浓度(后简称“浓度”)在其对应的检出限以下,则浓度计为为减少污染,所用器材经重铬酸浸泡,高纯水洗涤,甲醇润洗,高温烘烤备用,并进行空白检测。
1.2.3 标准及分组以2015年我国新生儿平均出生体重为标准[11],根据性别和胎龄调整出生体重,以Z评分表示,出生体重Z评分组排除胎龄小于37 周者。低于同胎龄同性别参照值第10 百分位数为SGA,高于第90百分位数为大于胎龄儿。SGA 组排除大于胎龄儿和胎龄大于42 周者。自发性早产是指20 至37 周的早产,没有医学或产科并发症[12]。早产组排除医源性早产。规范产检是指孕妇建卡时间≤孕12+6周,且整个孕期产检次数≥5 次。孕前体重指未怀孕时体重,根据公式计算孕前体重指数(body mass index,BMI)。孕期增重=分娩前体重-孕前体重。孕妇身高/体重、新生儿出生体重/身长、妊娠并发症、胎龄等由病历获得。
1.3 质量控制
问卷设计经过多次专家论证会讨论及预调查,根据预调查对问卷进行修改、确定。调查员均进行统一培训。问卷经过与住院病历核对、补填、逻辑纠错后回收。5 种MPAEs 通过与标准的保留时间(2%以内)和选择离子的峰面积比例(20%以内)比较进行定性确认,并采用最高丰度或背景干扰最少的选择离子进行定量分析。添加1 个基质空白、1 个质控样、1 个1/2 质控样以及1 个质控样加标回收作为质量控制,进行4 次质控检测,空白无目标化合物检出。5 种MPAEs 的质控样平均回收率分别是93.3%~104.3%,相对标准偏差(relative standard deviation,RSD)范围4.3%~12.2%,质控样加标平均回收率92.4%~118.0%,RSD 范围1.2%~12.0%。
1.4 统计学分析
利用EpiData 3.1 建立数据库,数据库进行双录入核查、逻辑检查,发现错误查找原始调查表进行纠正。用SPSS 21.0 软件进行统计分析。对研究对象的基本情况、MPAEs 的检测情况进行描述性分析,因其浓度分布为非正态,因此计算其几何均值G和95%CI。在分析前进行自然对数转换,以出生体重Z评分作为应变量进行简单和多元线性回归分析;以SGA 和早产作为应变量进行非条件logistic 回归分析。单因素结果纳入多因素回归的入选标准为P<0.05,通过多因素回归模型调整混杂因素,进一步探讨MPAEs 对妊娠结局的影响。检验水准α=0.05。
2 结果
2.1 基本情况
848 名孕妇年龄为(28.34±4.95)岁,孕前BMI 为(20.51±3.01)kg·m-2,孕期增重(13.36±4.31)kg,316名(37.26%)孕妇为初产妇,胎龄(271.40±11.45)d(197~289 d)。被动吸烟时间由孕前(2.17±6.62)h·周-1逐渐减少到孕晚期第28周及以后的(1.64±5.85)h·周-1。新生儿出生体重为(3 114.03±439.90)g,747 例足月儿出生体重Z评分为-0.22±0.77,自发早产的发生率为11.32%(96/848),SGA的发生率为7.55%(64/848)。
血清中的PAEs 代谢物除了MBzP 外(MBzP 检出率较低,不进入后续的分析),检出率都较高,母血中为98.94%~100.00%,脐血中为99.29%~100.00%。其中MnBP 的浓度最高,MEP 的浓度最低;除MEHP 和MBzP 外,其他3 种代谢物在脐血中的浓度中位数高于母血。见表1。
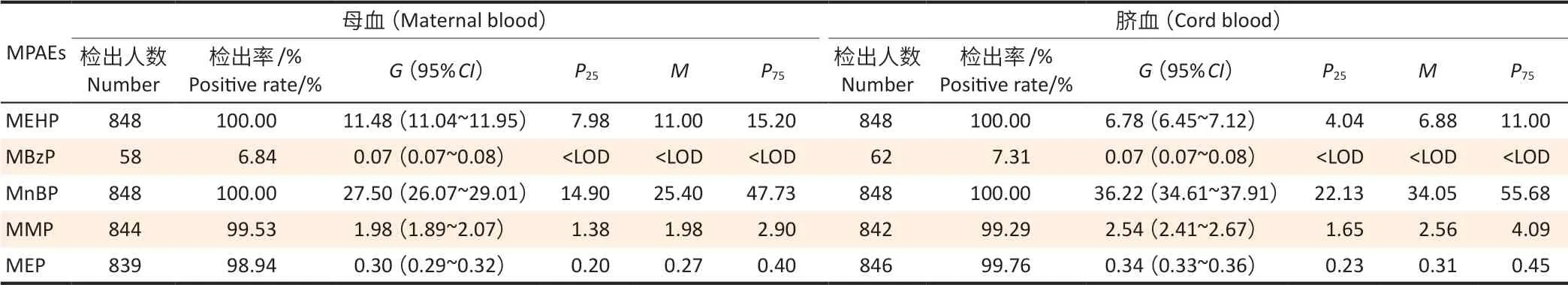
表1 848名孕妇MPAEs 检出情况Table 1 MPAEs detection results among 848 pregnant women单位(Unit):μg·L-1
2.2 母血与脐血中MPAEs 浓度的关系
对母血和脐血中的MPAEs 浓度进行相关分析,结果显示脐血中4 种MPAEs 浓度都与母血中的浓度相关,相关系数最大是MMP,为0.585;最小是MEHP,为0.286(均P<0.001)。以脐血中的MPAEs 的浓度为应变量,母血中的MPAEs浓度为自变量进行简单线性回归分析,结果显示脐血中4 种MPAEs 的浓度都随着母血中MPAEs的浓度增加而增加,最高的为MMP,母血中浓度增加一个单位,脐血中浓度增加0.658 个单位;最低的为MnBP,母血中浓度增加一个单位,脐血中浓度增加0.290 个单位(均P<0.001)。见表2。
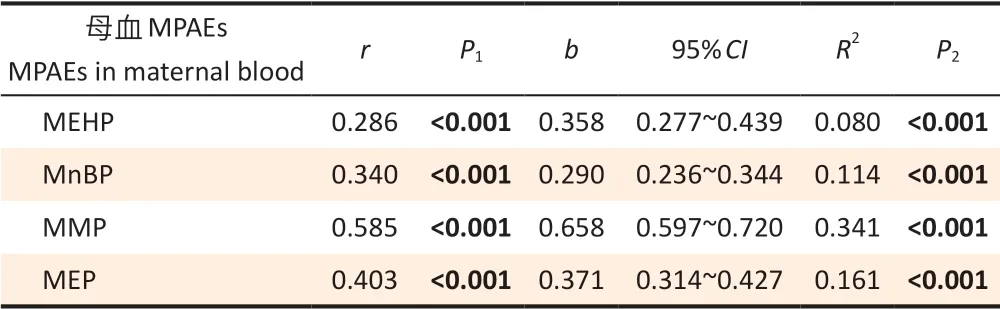
表2 848名孕妇母血和脐血MPAEs 浓度的相关性和简单线性回归分析结果Table 2 Correlation analysis and simple linear regression analysis of MPAEs concentrations in maternal blood and cord blood among 848 pregnant women
2.3 血清MPAEs浓度与妊娠结局的关系
以出生体重Z评分为应变量,母血和脐血中的MPAEs 的浓度为自变量进行线性回归分析。单因素分析显示,母血中MEHP 浓度与出生体重Z评分呈负相关,MEHP 浓度增加一个单位,出生体重Z评分降低0.124 个单位。根据单因素分析结果,调整母亲年龄等混杂因素后,分析显示MEHP 浓度增加一个单位,出生体重Z评分降低0.129 个单位。
分别以自发早产和SGA 为应变量进行非条件logistic 回归分析,单因素分析显示脐血中MnBP 和MEP是自发早产的保护因素,MEP是SGA的危险因素。调整母亲年龄等混杂因素后,发现MEP是自发早产的保护因素(OR=0.655,95%CI:0.436~0.985),但又是SGA的危险因素(OR=1.574,95%CI:1.063~2.331)。见表3。

表3 孕妇血清MPAEs 与妊娠结局的多元回归分析结果Table 3 Multiple regression analysis between serum MPAEs and pregnancy outcomes
3 讨论
本研究中,母血中除MBzP 检出率较低外,其余4 种MPAEs 在血清中的检出率为98.94%~100.00%。除MEP 的中位浓度与吴皖珂等[13]报道安徽马鞍山地区1 492 名单胎孕妇的检测结果基本一致外(0.27 μg·L-1vs 0.26 μg·L-1),其余几种代谢物高于国内其他报道:MnBP浓度约为安徽马鞍山地区的5倍(25.40 μg·L-1vs 5.94 μg·L-1),为广西壮族人群出生队列中950名孕妇的10倍(25.40 μg·L-1vs 2.19 μg·L-1)[9];高于韩国一项婴儿先天性甲状腺功能研究中20名健康孕妇的检测结果(25.40 μg·L-1vs 19.87 μg·L-1)[14]。MEHP浓度约为安徽和广西的2 倍(11.00 μg·L-1vs 5.95 μg·L-1和4.09 μg·L-1);与日本北海道318名孕妇的检测结果基本一致(11.00 μg·L-1vs 11.70 μg·L-1)[15]。MMP的浓度为广西(<0.1 μg·L-1)的近20 倍。脐血中除MBzP 外,MPAEs 的检出率高达99.29%~100.00%。MMP的中位浓度与苗宏健等[16]对北京161名新生儿脐血的检测结果基本一致(2.56 μg·L-1vs 2.45 μg·L-1);MnBP、MEP、MEHP 的浓度中位数都远远高于该报道,其中MnBP 的浓度最高,约为北京的16 倍(34.05 μg·L-1vs 2.68 μg·L-1),也高于我国台湾地区30名新生儿脐血的检测(34.05 μg·L-1vs 23.9 μg·L-1)水平[17]。这说明广州地区孕妇和新生儿普遍暴露于PAEs,与广东是制造大省,经济发达,PAEs 在环境中暴露较广,珠江三角洲地区环境PAEs 污染较为严重,含量较高有关[18-20]。
在脐血中检测到MPAEs,说明MPAEs 可通过胎盘。上海的一项研究发现包括MEHP 在内的非持久性有机污染物通过胎盘运输程度高,胎盘作为屏障保护胎儿免受这些污染物影响的作用有限[21]。母亲—胎盘转移取决于胎盘的功能、子宫和脐带的血流,以及位于膜上的转运蛋白、跨膜的化学梯度、化合物的理化性质等。其中理化性质包括分子质量、亲脂性、电离程度、蛋白结合等。一般来说,摩尔质量在1 000 g·mol-1以下的中性化合物都可以自由地通过胎盘扩散。本研究中MEHP 为长链MPAEs,MnBP、MMP、MEP 为短链MPAEs;MEHP 的摩尔质量低于300 g·mol-1;MnBP、MMP、MEP 的摩尔质量都低于250 g·mol-1。Mose 等[22]在胎盘体外灌注实验中发现,胎盘转移依赖于灌注介质。MMP 等短链MPAEs 与白蛋白结合后可缓慢通过胎盘,而MEHP等长链MPAEs未观察到胎盘转移,因为胎盘内葡萄糖醛酸化可减少游离MEHP的数量和胎盘转移。孕妇在孕期反复暴露,可导致PAEs 在胎儿中的蓄积[23]。与本研究发现的短链MPAEs相关系数大于长链MPAEs,脐血中MPAEs随母血中浓度的增加而增加,含量高于母血相符。
PAEs 可作为干扰内分泌的化合物来调节胎盘功能,继而影响妊娠结局。胎盘的发育取决于妊娠前三个月滋养层的侵袭性,人类胎盘的侵袭性滋养细胞与成功妊娠的结果密切相关[24]。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARγ)是生殖和发育途径的主要调节剂,其在胎盘中,特别是在滋养层细胞中的表达,对胎盘的发育和功能至关重要,其参与滋养细胞的分化和侵袭,并进一步调节滋养细胞中脂质运输和代谢[25],进而发挥重要的抗炎作用,抑制胎儿组织的炎症反应,降低早产的风险。MPAEs 可以激活PPARγ,调节滋养细胞的分化,可能会干扰与分娩时机有关的信号传导[26]。在纽约市多种族队列中,对尿中MPAEs的检测发现低分子质量的MPAEs暴露与胎龄呈正相关[27],与本研究脐血中MEP是自发早产的保护因素相符。但Huang等[28]研究中国妇女分娩时脐带血中15 种邻苯二甲酸盐水平发现PAEs 与孕周缩短和早产有关。研究结果的不一致可由研究方法和检测方法不同造成。如采血孕周的不同,可导致MPAEs 的含量有差异[15]。孕期食用鱼油已被证实可延长妊娠时间[29],因为鱼油中的n-3 长链多不饱和脂肪酸是PPARγ 的配体,可能有助于抑制妊娠后期的炎症反应[30]。所以摄入的MPAEs 和脂肪酸可能存在竞争性相互作用,但本研究不能证实这一点。因此,PAEs 与早产的关系还需要进一步研究。
本研究显示在足月儿中,母血中MEHP 与出生体重Z评分呈负相关,与波士顿一项纵向出生队列研究一致[31]。该研究中DEHP 总浓度每增加1 个四分位间距,胎儿体重就降低0.13 个标准差。对尿液中MPAEs的研究发现产前暴露于邻苯二甲酸盐与宫内发育迟缓的风险增加有关[32-33],与本研究中MEP 是SGA的危险因素的结果相一致。MPAEs 暴露导致出生体重下降可能与活性氧有关。活性氧是参与细胞增殖、分化和凋亡的信号转导途径的核心元素之一,而抗氧化剂可以抵抗活性氧引起的对脂质、蛋白质和DNA 的损害。活性氧的产生和抗氧化剂系统之间的不平衡会导致氧化应激,氧化应激可促进与妊娠有关的疾病,如胎儿生长受限、早产和低出生体重等[34]。MEHP 可以刺激胎盘细胞的氧化应激反应[35],并通过氧化应激改变细胞信号传导和/或损害了细胞大分子,导致不良妊娠结局的发生[36]。
本研究存在不足:数据虽然来源于队列研究,但是对PAEs的检测是现况调查,只是对孕晚期孕妇PAEs的暴露情况进行了检测,未探讨孕早和孕中期情况。
综上,本研究显示广州市孕妇普遍暴露于PAEs,新生儿宫内暴露较严重。宫内暴露影响妊娠结局,在增加胎龄的同时减少了出生体重。
