低压贮藏对杨梅果实抗氧化及其细胞膜透性的影响
2021-07-15郑俊峰谢建华庞杰
郑俊峰,谢建华*,庞杰
(1.漳州职业技术学院食品与生物工程系,福建 漳州 363000;2.农产品深加工及安全福建省高校应用技术工程中心,福建 漳州 363000;3.福建农林大学食品科学学院,福建 福州 350002)
低压(low-pressure,LP)贮藏属不冻结真空保鲜技术[1],因其低能耗、无污染等特点[2-3],广泛应用于番木瓜[4]、鸭梨[5]、桃[6]、芒果[7]、蓝莓[8]等采后贮藏,具有良好的保鲜效果。 成熟水果采后其抗氧化酶活性易下降,非酶类抗氧化物质易流失,机体内产生的活性氧自由基不断增多。 低压贮藏可为鲜果提供持续不间断的“低压、低温、高湿、换气”的贮藏环境,诱导其内源非酶类抗氧化物质[如抗坏血酸(ascorbic acid,AsA)等]和酶类抗氧化物质[如过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)等]产生抗氧化,延缓膜脂过氧化,保护细胞膜结构,降低生理障碍或病害风险,延长贮藏寿命[1,9]。
杨梅(Myrica rubra Sieb.et Zucc)原产于我国,福建、浙江、广东、江西等长江以南地区为主产区,其果实色泽鲜艳、酸甜可口、风味独特、营养丰富,深受消费者喜欢[10]。 但杨梅成熟期、采收期集中在高温梅雨季节,果肉鲜嫩且无外果皮包裹,采后极不耐贮藏保鲜,易发生组织衰老、腐烂劣变等问题,货架期短、损耗率大,已严重制约鲜杨梅产业的发展。研究表明,杨梅果实采后组织衰老、腐烂劣变与活性氧代谢有关,其代谢失调可诱导膜脂过氧化作用加强,细胞膜透性增加,加速组织衰老腐烂进程[11-12]。 目前,对杨梅果实采后贮藏保鲜技术的研究主要集中在贮前减压预处理[4]、1-甲基环丙烯(1-methylcyclopropene,1-MCP)和热处理[13]、NO 处理[14]和低温贮藏[15]、茉莉酸甲酯(methyl jasmonate,MeJA)[16]单独或复合使用等方法,而研究低压贮藏对杨梅果实细胞膜透性与抗氧化关系,探讨其影响衰老腐烂机制尚较少见报道。 本试验以“安海变”杨梅果实为试验材料,2 ℃~4 ℃温度条件下,设置常压贮藏为对照(control check,CK),研究低压(LP,0.05 MPa)贮藏对杨梅果实的细胞膜透性及其抗氧化性的影响,并监测贮藏期间细胞膜透性(cell membrane permeability,CMP)、丙二醛(malondialdehyde,MDA)和内源抗氧化物质AsA、脯氨酸(proline,Pro),以及SOD、CAT、POD、多酚氧化酶(polyphenol oxidase,PPO)等抗氧化酶有关生理生化指标变化,旨在进一步阐明低压贮藏对杨梅果实抗氧化机制及其对细胞膜透性的影响,以期为调控杨梅果实采后衰老生理、延长保鲜期提供理论和实践参考。
1 材料与方法
1.1 材料及处理
以漳州浮宫镇果园“安海变”杨梅品种为试材,挑选成熟度一致、大小均一、无碰伤、无病虫害的果实,用厚为0.05 mm 的塑料袋分装,每袋为500 g 左右,胶带封口,分两组进行处理:CK 为常压贮藏于2 ℃~4 ℃条件下;LP 为0.05 MPa 压力贮藏于2 ℃~4 ℃的温度条件下。 贮藏期为16 d,每隔4 d 取样1 次,测定各项理化指标,每项指标重复3 次。
1.2 设备与试剂
1.2.1 主要设备
721 型分光光度计:上海第三分析仪器厂;80-2 型离心机: 上海浦东物理光学仪器厂;PHS-25 型电位计:上海精科雷磁公司。
1.2.2 主要试剂
2,6-二氯靛酚钠:生工生物工程(上海)股份有限公司;茚三酮:沈阳先创化工有限公司;过氧化氢、乙二胺四乙酸二钠、曲拉通(TritonX-100)、三氯乙酸:西陇化工股份有限公司;氮蓝四唑(nitroblue tetrazolium,NBT)、甲硫氨酸、核黄素、硫代巴比妥酸(thiobarbituric acid,TBA):北京索莱宝科技有限公司。 以上试剂均为分析纯。
1.3 测定指标及方法
1.3.1 AsA 含量测定
参考GB 5009.86—2016《食品安全国家标准食品中抗坏血酸的测定》[17]方法,从10 个果实中取果肉5 g,研磨均浆离心,提取上清液定容至10 mL,采用2,6-二氯靛酚滴定法测定杨梅果实中AsA 含量, 结果以mg/100 g 表示。
1.3.2 Pro 含量测定
参考丁改秀等[18]的方法,随机取10 个杨梅果实,取果肉5 g,研磨匀浆离心,提取上清液定容至10 mL,采用酸性茚三酮法测定杨梅果实中Pro 含量, 结果以mg/100 g 表示。
1.3.3 SOD 活性测定
参考曹建康等[19]的方法,从10 个杨梅果实取果肉5 g,研磨匀浆离心,提取上清液定容至20 mL 得到酶液, 采用NBT 光还原法测定SOD 活性, 结果以U/g FW 表示。
1.3.4 CAT 活性测定
参考SI 等[20]的方法,酶液提取同SOD,采用紫外吸收法测定CAT 活性,结果以U/g FW 表示。
1.3.5 POD 活性测定参考曹建康等[21]的方法,酶液提取同SOD,采用愈创木酚比色法测定POD 活性,结果以U/g FW 表示。
1.3.6 PPO 活性测定参考田世平等[22]的方法,酶液提取同SOD,采用邻苯二酚比色法测定PPO 活性,结果以U/g FW 表示。
1.3.7 MDA 含量测定
参考李合生[23]的方法加以改进,从10 个杨梅果实中取果肉2 g,研磨匀浆离心,提取上清液定容至20 mL,采用硫代巴比妥酸法测定MDA 含量,结果以mmol/g表示。
1.3.8 CMP 测定
参考高俊凤[24]的方法,取5 个杨梅果实放入烧杯,加入400 mL 蒸馏水,采用电导率方法测定CMP,结果以%表示。
1.4 数据处理与分析
采用Microsoft Excel 2017 软件进行数据统计和制图,采用SPSS22.0 统计软件对数据进行差异性分析。
2 结果与分析
2.1 杨梅果实低压贮藏过程中AsA 含量的变化
AsA 是果蔬内源抗氧化物质, 可清除活性氧(reactive oxygen species,ROS),抑制膜脂过氧化[25]。 杨梅果实低压贮藏过程中ASA 含量的变化见图1。
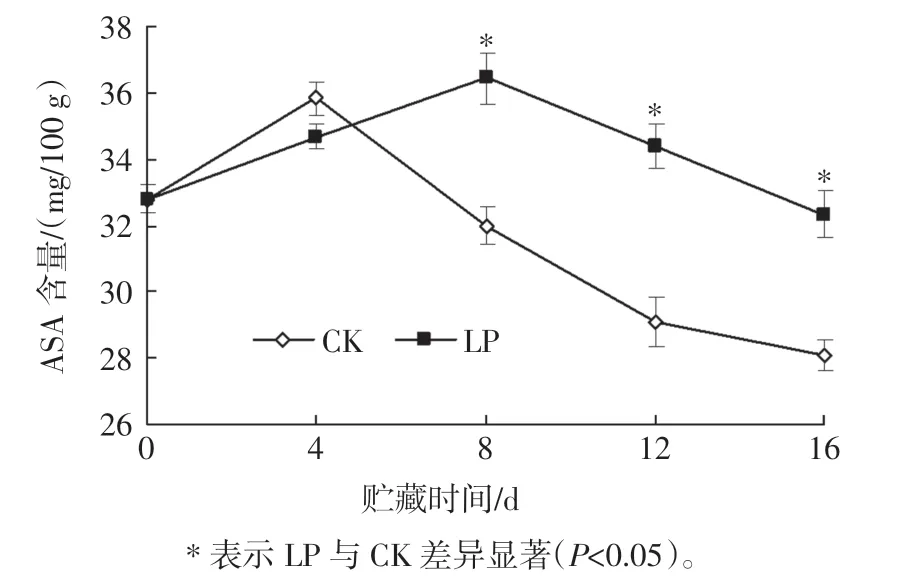
图1 杨梅果实低压贮藏过程中ASA 含量的变化Fig.1 Changes of AsA content in bayberry fruit during low pressure storage
如图1 所示,杨梅果实AsA 含量变化呈先升后降趋势,这可能是由于其贮藏前期进一步成熟使AsA 含量出现上升,而在后期衰老消耗导致其逐渐下降。 CK在0~4 d 出现上升,第4 天之后快速下降,LP 在0~8 d出现上升,第8 天之后较缓下降,且在8 d~16 d 其AsA含量显著高于CK(P<0.05),说明低压贮藏延缓了杨梅果实AsA 含量峰值的出现,且明显抑制贮藏后期AsA含量的下降,可有效保持抗氧化能力,抑制杨梅果实组织膜脂过氧化。
2.2 杨梅果实低压贮藏过程中Pro 含量的变化
Pro 既是果蔬组织细胞质内渗透调节物质, 也是内源抗氧化剂,可参与清除超氧阴离子自由基(O2-·)和羟基自由基(·OH)[26]。杨梅果实低压贮藏过程中Pro含量的变化见图2。
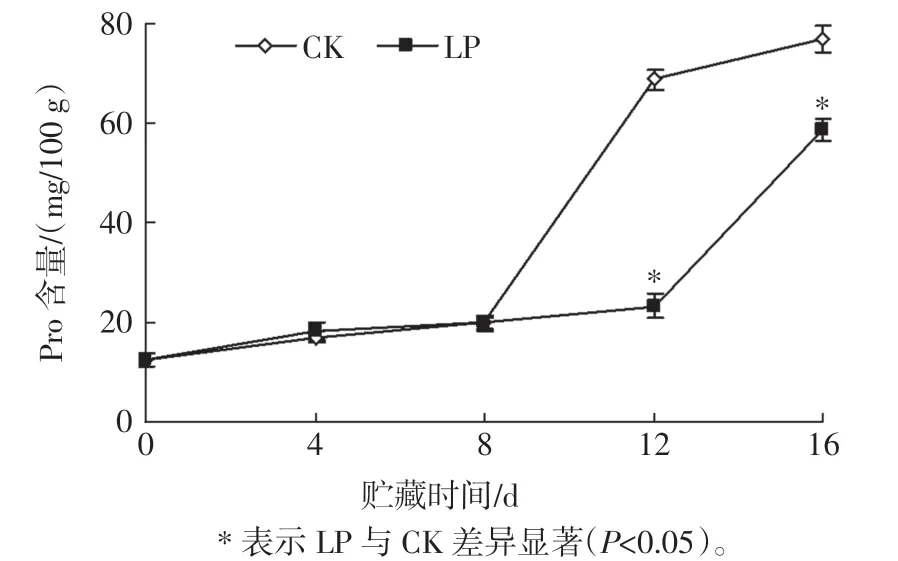
图2 杨梅果实低压贮藏过程中Pro 含量的变化Fig.2 Changes of Pro content in bayberry fruit during low pressure storage
如图2 所示, 杨梅果实Pro 含量在贮藏期间呈上升趋势,0~8 d,LP 与CK 的杨梅果实Pro 含量变化均不明显,CK 的Pro 含量第8 天快速上升,而LP 在8 d~12 d 保持稳定,在第12 天后较快上升,且在12 d~16 d显著低于CK(P<0.05),说明低压贮藏可明显延缓杨梅果实贮藏后期Pro 含量上升,提高其贮藏后期抗氧化能力,减轻氧化伤害。
2.3 杨梅果实低压贮藏过程中SOD 活性的变化
SOD 可将采后果蔬组织中积累的O2-·歧化为过氧化氢(H2O2)和O2。杨梅果实低压贮藏过程中SOD 活性的变化见图3。

图3 杨梅果实低压贮藏过程中SOD 活性的变化Fig.3 Changes of SOD activity in bayberry fruit during low pressure storage
如图3 所示,CK 的SOD 活性在0~12 d 逐渐上升且高于LP,第12 天达到峰值后再迅速下降;LP 的SOD活性在0~4 d 出现下降,之后缓慢上升,第16 天高于CK,说明低压可较稳定保持杨梅果实贮藏前中期较低水平SOD 活性, 并使其在贮藏后期保持较高SOD 活性,进而减少细胞内O2-·累积,这与王晓丹等[4]、王友升等[27]研究结果类似。SOD 活性受到O2-·产生速率诱导,研究发现,LP 的SOD 活性在4 d~12 d 显著低于CK(P<0.05),这可能是由于低压贮藏环境抑制O2-·产生速率,减少O2-·积累,使其SOD 活性保持较低水平[28]。
2.4 杨梅果实低压贮藏过程中CAT 活性的变化
CAT 以H2O2为底物,可将其分解为H2O 和O2。 杨梅果实低压贮藏过程中CAT 活性的变化见图4。

图4 杨梅果实低压贮藏过程中CAT 活性的变化Fig.4 Changes of CAT activity in bayberry fruit during low pressure storage
如图4 所示,杨梅果实CAT 活性变化呈前降中升后降趋势。 冷藏0~12 d 期间,CK 的CAT 活性均高于LP,其中,8 d~12 d,LP 显著低于CK(P<0.05),这可能是由于低压贮藏抑制杨梅果实H2O2生成速率, 减少H2O2积累,使其CAT 活性保持较低水平,这与黄海英等[29]研究结果一致。CK 和LP 分别于第8、12 天达到峰值,12 d~16 d,CK 快速下降, 而LP 缓慢下降, 第16天,LP 的CAT 活性高于CK。 说明低压可较稳定维持杨梅果实贮藏前中期较低水平CAT 活性,延迟贮藏中期CAT 活性峰值出现, 抑制贮藏后期CAT 活性快速下降,对保持CAT 活性具有一定作用。
2.5 杨梅果实低压贮藏过程中POD 活性的变化
POD 是清除自由基的保护酶[30]。 杨梅果实低压贮藏过程中POD 活性的变化见图5。
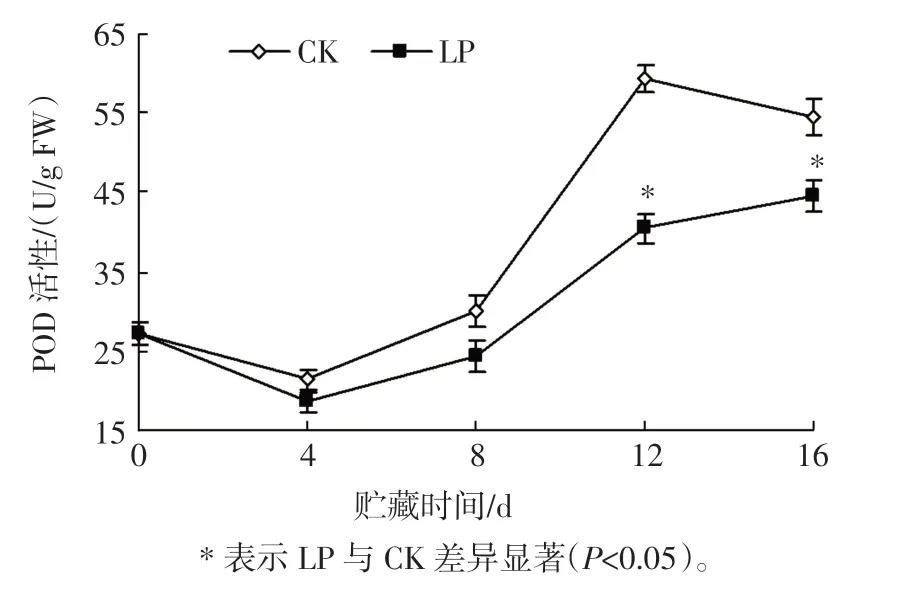
图5 杨梅果实低压贮藏过程中POD 活性的变化Fig.5 Changes of POD activity in bayberry fruit during low pressure storage
如图5 所示,CK 和LP 在0~4 d 均缓慢下降,CK在4 d~12 d 较快上升,随后降低;而LP 在4 d~16 d 缓慢上升,整个贮藏过程,LP 的POD 活性均低于CK,且12 d~16 d 差异显著(P<0.05),这可能与LP 导致杨梅果实组织内自由基积累较少有关。 说明低压贮藏能较明显抑制杨梅果实POD 活性,减轻杨梅果实膜脂过氧化程度。
2.6 杨梅果实低压贮藏过程中多酚氧化酶(PPO)活性的变化
PPO 是参与酶促褐变的关键酶。 杨梅果实低压贮藏过程中PPO 活性的变化见图6。
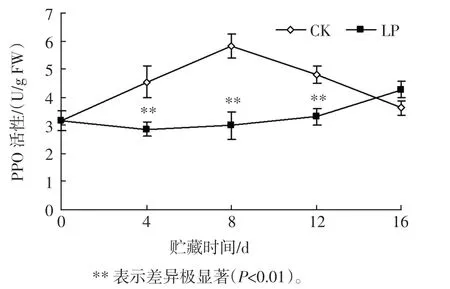
图6 杨梅果实低压贮藏过程中PPO 活性的变化Fig.6 Changes of PPO activity in bayberry fruit during low pressure storage
如图6 所示,CK 的PPO 活性先升后降,第8 天达到峰值;而整个贮藏过程中,LP 在0~12 d 保持较稳定水平,随后逐渐上升,第16 天高于CK,且在4 d~12 d的PPO 活性极显著低于CK(P<0.01),这可能是由于低压贮藏环境有效保持杨梅果实组织细胞膜系统的稳定,减少其与底物酚类物质接触,且与低压导致O2的分压较低有关。 这说明低压贮藏可明显抑制杨梅果实的PPO 活性,延缓采后褐变,减慢生理老化过程。
2.7 杨梅果实低压贮藏过程中MDA 含量的变化
MDA 是膜脂过氧化作用的产物,也是评价膜脂过氧化程度的重要指标[31]。 杨梅果实低压贮藏过程中MDA 含量的变化见图7。

图7 杨梅果实低压贮藏过程中MDA 含量的变化Fig.7 Changes of MDA content in bayberry fruits during low pressure storage
如图7 所示,MDA 含量呈上升趋势,LP 的MDA含量始终低于CK。CK 在0~4 d 上升较慢,之后加快上升,而LP 在0~12 d,上升较慢,第12 天后迅速上升,且在8 d~16 d 显著低于CK(P<0.05)。 说明低压贮藏明显延缓MDA 含量上升,减轻杨梅果实膜脂过氧化。
2.8 杨梅果实低压贮藏过程中CMP 的变化
果蔬采后贮藏过程中, 随后熟衰老进程不断推进,其细胞结构会受到破坏,从而使CMP 增加。杨梅果实低压贮藏过程中CMP 的变化见图8。
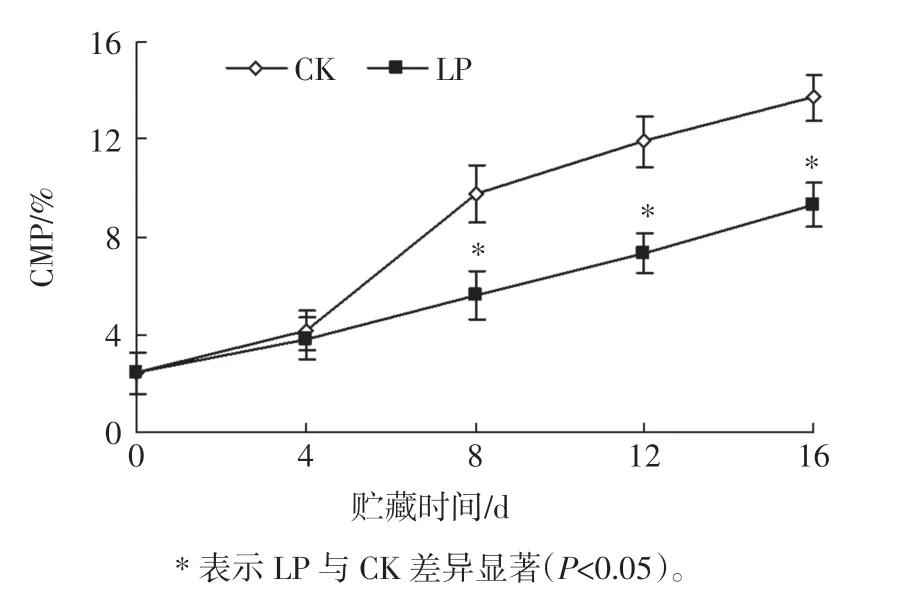
图8 杨梅果实低压贮藏过程中CMP 的变化Fig.8 Changes of CMP during low pressure storage of bayberry fruit
如图8 所示,杨梅果实的CMP 呈上升趋势,但LP的CMP 在整个贮藏过程中低于CK, 且在8 d~16 d 显著低于CK(P<0.05),说明低压贮藏可明显延缓杨梅果实CMP 上升,较好维持杨梅果实细胞膜结构。
2.9 杨梅果实低压贮藏过程中细胞膜透性(CMP)和抗氧化各指标之间的相关性分析
杨梅果实低压贮藏过程中CMP 和抗氧化各指标之间的相关性分析结果见表1。
如表1 所示,在低压贮藏过程中,杨梅果实CMP与不同抗氧化指标的相关性不太一致,各抗氧化指标之间的相关性也不太一致。 CMP 与MDA 之间呈显著正相关(R=0.902,P<0.05),与POD 之间呈极显著正相关(R=1.000,P<0.01);而MDA 与Pro、PPO 呈极显著正相关(P<0.01),R 值分别为0.990、0.962,与POD呈显著正相关(R=0.902,P<0.05),PPO 与SOD、Pro 之间呈显著正相关(P<0.05),R 值分别为0.950、0.944,其他指标与上述指标之间相关性不显著。 以上结果表明, 杨梅果实CMP 越高, 其MDA、Pro 含量和POD、PPO、SOD 活性就越高。 综上所述,低压贮藏诱导杨梅果实组织降低MDA 积累,延缓细胞膜透性上升,主要是抗氧化物质Pro 和抗氧化相关酶POD、PPO、SOD 等关键指标发挥主导作用,而AsA、CAT 作用较不明显。
3 结论
低压贮藏可有效抑制引起生鲜园艺产品成熟衰老有关酶的活性,降低生鲜园艺产品的生理障碍或病害的风险,延长保鲜期[9]。 本研究结果表明,采用低压(LP,0.05 MPa) 贮藏可诱导杨梅果实启动抗氧化保护机制,延缓了其内源抗氧化物质AsA 高峰出现、限制AsA 含量下降和Pro 含量上升; 延迟Pro 含量急剧上升,有效维持SOD、CAT 活性在贮藏中期逐步上升;在贮藏后期保持较高活性; 可明显抑制POD 和PPO 活性,提高杨梅果实低温逆境抗氧化能力;减轻MDA 积累和膜脂过氧化程度;明显延缓CMP 上升,使其在贮藏第16 天时CMP 仍保持在10%以下。 这说明LP 贮藏可较好地保护杨梅果实组织细胞膜结构,有效维持杨梅果实冷藏期间的正常生理代谢,进一步延缓其衰老劣变进程。 进一步分析杨梅果实低压贮藏过程中CMP 与抗氧化各指标之间的相关性发现,LP 贮藏杨梅果实CMP 与MDA 之间呈显著正相关(R=0.902,P<0.05),与POD 之间呈极显著正相关(R=1.000,P<0.01);而MDA 与Pro、PPO 极显著正相关(P<0.01),R 值分别为0.990、0.962,与POD 呈显著正相关(R=0.902,P<0.05),PPO 与SOD、Pro 之间呈显著正相关(P<0.05),R 值为0.950、0.944,其他指标与上述指标之间相关性不显著。这说明低压贮藏杨梅果实抗氧化机理主要是通过调节内源抗氧化物质Pro 和抗氧化相关酶POD、PPO、SOD 等关键指标,从而降低果实MDA 积累,延缓CMP上升, 而AsA、CAT 在杨梅果实低压贮藏过程中的作用较不明显。 其研究结果可为后续开发杨梅果实低压贮藏保鲜技术提供理论参考和实践指导。
低压贮藏保鲜技术是一项复杂的系统工程,涉及持续低分压O2、CO2、NH3、C2H4等气体环境和低温、高湿、换气等技术因素,其诱导活性氧代谢的应激反应、能量代谢的响应以及延缓后熟衰老进程等更深层次机制有待深入探讨研究,同时还要解决好减压、冷藏、加湿换气等设施的技术工艺及参数匹配问题,在研究和实践中不断完善,以期获得更加广阔的市场应用。
