实时荧光PCR在虹鳟源性成分鉴别中的应用
2021-07-15刘金玉季超靳佳瑞张芹郝韫解玉鑫冯宇赜李娟伍志强汪星宇郑文杰
刘金玉,季超,靳佳瑞,张芹,郝韫,解玉鑫,冯宇赜,李娟,伍志强,汪星宇,郑文杰*
(1.天津师范大学生命科学学院,天津 300387;2.云南农业大学云南生物资源保护与利用国家重点实验室,云南 昆明 650201)
虹鳟肌肉中蛋白含量、脂肪含量以及必需氨基酸含量均高于青鱼、草鱼、鲢鱼等几种常见的淡水鱼[1-2],其骨中蛋白质和脂肪含量分别为20.69%和22.8%,不饱和脂肪酸含量为83.54%,均高于一般鱼类[3],所以虹鳟的需求量及产量都与日俱增;根据联合国粮农组织渔业统计数据, 从2008 年到2018 年全球虹鳟产量已从67.732 万吨增长到84.919 6 万吨; 就我国而言,2017 年我国冷水鱼产量在5 万吨左右, 其中虹鳟约占3.860 6 万吨[4]。作为美味又富有营养的食品而言,虹鳟食用方法很多,主要的商品有生鱼片、罐头、鱼糜、烟熏制品等,虹鳟鱼皮还可以用作胶原蛋白的提取[5]。由于部分商品在加工过程中形态学特征受到不同程度的破坏,通过商品形态无法对其是否源自虹鳟进行判别[6],所以常用核酸与蛋白质等方法对其真实性加以鉴别。 因蛋白质具有组织特异性且在食品加工过程中的高温、 高压以及高盐处理可能会使其发生变性,检测的准确性会受到影响[7]。 因此,基于核酸的聚合酶链式反应(polymerase chain reaction,PCR)检测方法成为目前用于水产品鉴别的主要方法。
实时荧光聚合酶链式反应(real-time fluorescence PCR,RT-PCR)检测在食品及鱼类产品中应用已较为广泛。 李秋阳等[8]对荧光定量PCR 检测在食品中的应用做了相应的介绍,方军等[9]利用实时荧光PCR 建立了对鱼翅这种加工要求较高的产品的检测方法,方法较为稳定可行;郭凤柳等[10]也开发了针对掺假肉类的PCR 检测方法;ZHAO 等[11]进行了以PCR-测流免疫分析法鉴定驴肉源性的研究;史莹莹等[12]建立了实时荧光定量PCR 鉴定肉制品中牛源性成分及其含量方法;罗建兴等[13]利用实时荧光定量PCR 法检测对食品中鹌鹑源性成分进行检测;汪艺等[14]对水产品中的鳕鱼建立了实时荧光定量聚合酶链式反应能快速鉴定3 种鳕鱼。 李进波等[15]用实时荧光PCR 法鉴定食品中鲑亚科鱼成分,并可用于市场上鲑科鱼及产品的检测。
本研究以虹鳟为研究对象,利用线粒体基因具有编码效率高、在不同区域进化速度存在差异和母性遗传等特点[16-17],针对虹鳟较其它鱼类在线粒体基因组上保守度相对较高的ATP6 设计特异性引物和探针[18-19],建立针对虹鳟源性成分的实时荧光PCR 检测技术,可用于检测市售的三文鱼产品是否含有虹鳟源性成分。
1 材料与方法
1.1 材料与试剂
待检测样品: 市售的三文鱼片4 份和网购的虹鳟鱼籽、烟熏、烤制及虹鳟生鱼片等18 份,详见表1。
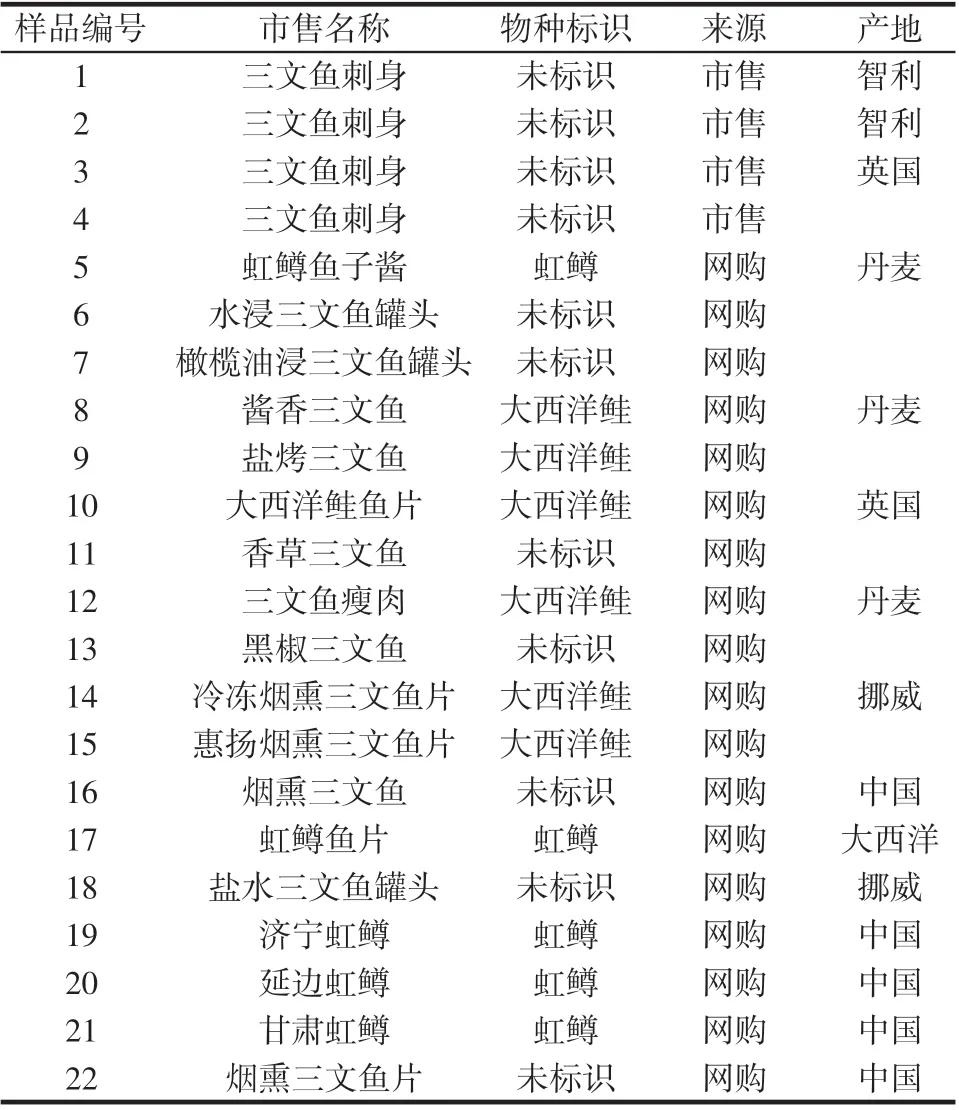
表1 待检测样品列表Table 1 List of samples to be tested
10 份虹鳟鱼样品: 青海民泽龙羊峡公司提供;带鱼、大黄鱼、中国芦花、尼罗罗非鱼、草鱼、鲅鱼、大眼鳜、鲫鱼、石斑、蓝鳍金枪鱼、黄鳍金枪鱼、大目金枪鱼、长鳍金枪鱼、锦鲤、大西洋鲑、多宝鱼、鲳鱼17 种非靶标鱼样品:市售。
动物组织基因组提取试剂盒:天根生化科技有限公司;引物和探针:由生工生物工程(上海)有限公司合成。
1.2 仪器与设备
LightCyclerR480 II 实时荧光定量PCR: 美国Roche 公司;3K15 台式高速冷冻离心机: 曦玛离心机(扬州)有限公司;HH-S3 数显恒温水浴锅:金坛市金南仪器制造有限公司。
1.3 方法
1.3.1 样品的制备
取0.1 g 样品,加入600 μL 去离子水,在5 000 r/min条件下匀浆40 s。
1.3.2 DNA 的提取
将分别匀浆后的样品,在6 000 r/min 条件下离心1 min,弃上清液留沉淀,使用动物组织基因组提取试剂盒进行样品DNA 的提取,作为PCR 扩增的模板。
特异性试验样品准备:用青海民泽龙羊峡公司提供的10 份虹鳟鱼样品和本研究中收集的其它17 个非靶标鱼类组织提取的DNA 来研究该方法的特异性。选取不同虹鳟鱼的DNA 样品10 份,经DNA 条形码技术验证后的带鱼、大黄鱼、中国芦花、秋刀鱼、尼罗罗非鱼、草鱼、鲅鱼、大眼鳜、石斑、蓝鳍金枪鱼、黄鳍金枪鱼、大目金枪鱼、长鳍金枪鱼、比目鱼、鲤鱼、大西洋鲑鱼、鲫鱼DNA 样品各1 份备用。
DNA 灵敏度试验样品准备:选取青海民泽龙羊峡公司提供的虹鳟鱼样品的DNA,原始浓度为50 ng/μL,用去离子水分别稀释为10、1、0.1、0.01、0.001ng/μL 备用,其中50、10、1、0.1 ng/μL 每个浓度做4 次重复试验;0.01、0.001 ng/μL 做8 次重复试验验证。
1.3.3 引物设计和选择
从NCBI 数据库中下载虹鳟、 大西洋鲑、 大马哈鱼、帝鲑、石斑、带鱼等25 种线粒体基因组全序列,利用Geneious Prime 2019 版对序列进行比对分析, 比对结果表明ATP6 基因在虹鳟中具有一定的保守性,利用软件Primer Premier 5.0 设计引物。 引物和探针序列如表2 所示。
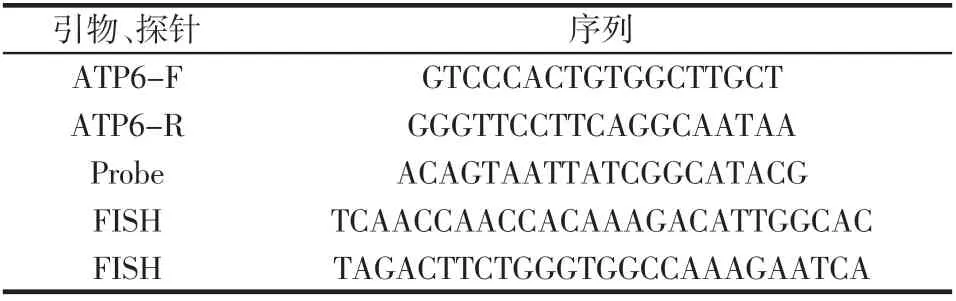
表2 虹鳟引物及探针Table 2 Primers and probes for Oncorhynchus mykis
利用DNA 条形码技术对样品进行验证[20-22],对收到样品进行针对线粒体COX I 基因的部分特异区段的通用(>99%)引物FISH F/R[23]测序,测序结果在NCBI(https://www.ncbi.nlm.nih.gov)进行序列比对,选取相似度最高的结果进行系统进化树的构建。
1.3.4 PCR 扩增
实时荧光PCR 反应体系为20 μL ∶0.2 μL 的TaKaRa Ex Taq HS(5 U/μL),4 μL 的10×Ex Taq Buffer,3 μL的dNTP 混合液(2.5 mmol/L),0.4 μL 的ATP6-F(10 μmol/L),0.4 μL 的ATP6-R (10 μmol/L),0.6 μL 的Probe(10 μmol/L),9.4 μL 的无菌水,2 μL 的DNA。
参照LightCycler480 II 实时荧光PCR 仪使用说明书及TAKARA 公司TaKaRa Ex TaqRHot Start Version推荐的反应程序,设置反应程序:95 ℃预变性30 s,1 个循环;95 ℃变性10 s,60 ℃退火延伸30 s,40 个循环;40 ℃冷却30 s,1 个循环。
2 结果分析
2.1 样品真实性鉴定
利用DNA 条形码技术验证收集样品真实性和准确性的结果如图1 和表3 所示。 本研究所收集样品和NCBI 数据库序列比对相似度达99.9%。

表3 18 种鱼类样品名称及测序结果Table 3 Names and sequencing results of 18 fish samples
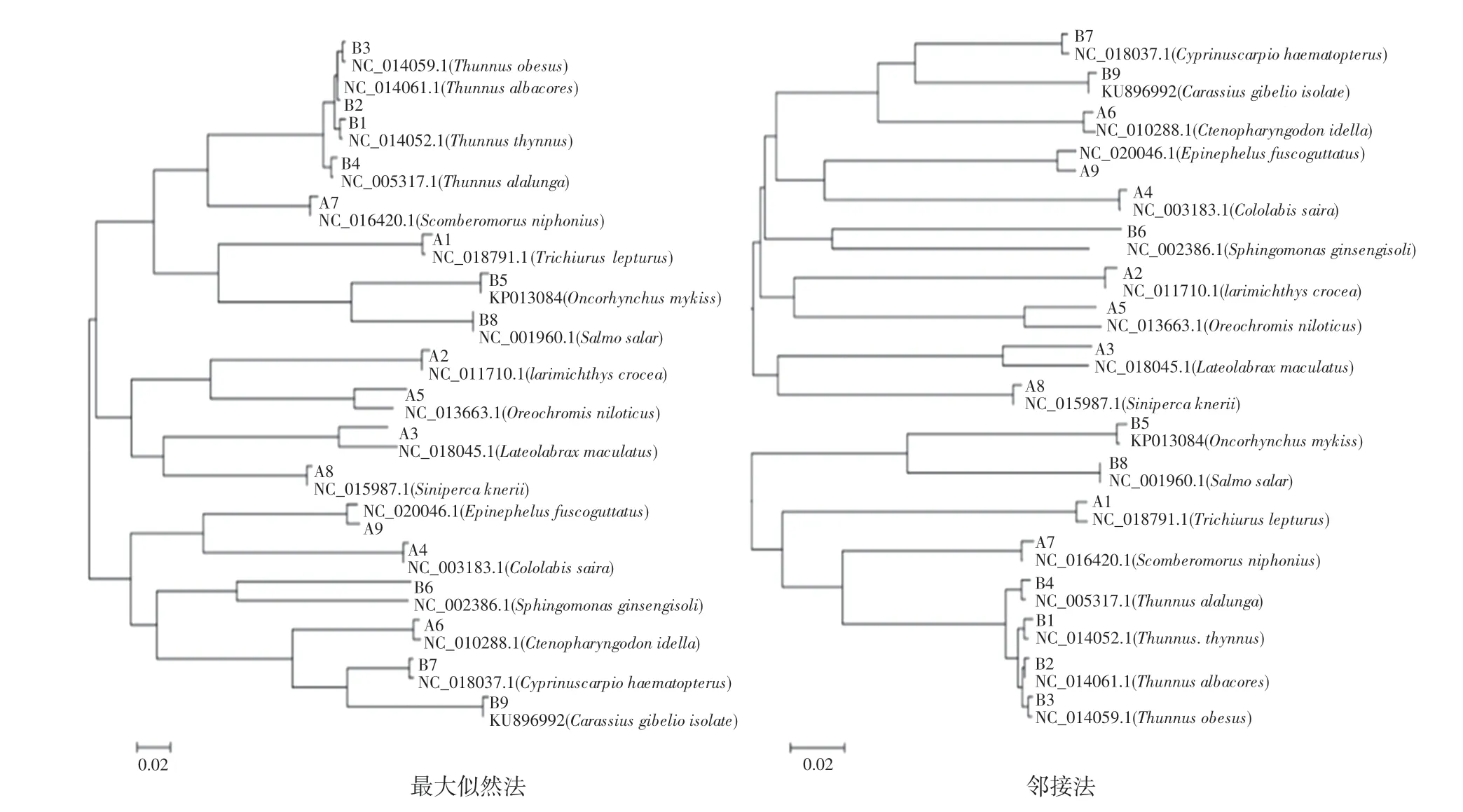
图1 18 份样品的线粒体上COX I 的最大似然法和邻接法分子进化树Fig.1 The maximum likelihood and neighbor joining molecular evolutionary trees of COX I on the mitochondria of 18 samples
2.2 特异性试验
选取青海不同虹鳟养殖场的虹鳟10 份,市售不同种类的鱼17 份,用引物ATP6-F/R 进行PCR 扩增,结果如图2 所示。
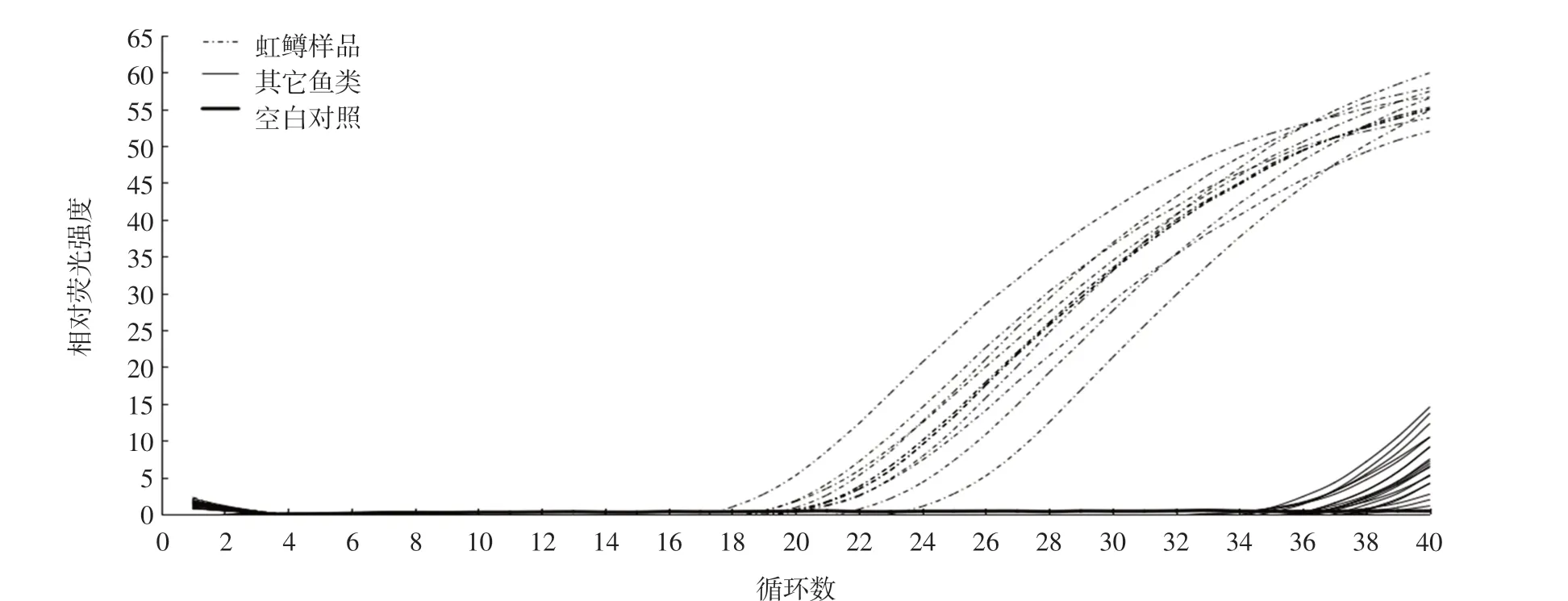
图2 虹鳟源性成分检测的特异性试验Fig.2 Specific detection of rainbow trout-origin components
在32 个循环之前只对虹鳟进行了扩增, 对其它(大西洋鲑鱼、带鱼、大黄鱼、中国芦花、秋刀鱼、尼罗罗非鱼、草鱼、鲅鱼、大眼鳜、石斑、蓝鳍金枪鱼、黄鳍金枪鱼、大目金枪鱼、长鳍金枪鱼、比目鱼、锦鲤、鲫鱼)17种鱼、空白对照未见扩增曲线,说明该方法特异性良好,可用于虹鳟源性的样品的检测判定值为32 个循环,在32 个循环之前出现明显扩增曲线的,判定为阳性;在32 个循环之前未出现明显扩增曲线的,判定为阴性。
2.3 DNA 灵敏度试验
验证TaqMan 探针方法的DNA 灵敏度结果如图3 所示。
由图3 可知,在这6 个浓度梯中50、10、1、0.1 ng/μL在32 个循环前有扩增,0.01、0.001 ng/μL 在32 个循环之前无扩增,表明本方法的灵敏度为0.1 ng/μL。

图3 DNA 浓度灵敏度试验Fig.3 Sensitivity of different DNA concentration
2.4 市售样品的检测结果
对表1 中1 号~22 号样品的检测结果如图4 所示。
由图4 可知,2 份市售三文鱼生鱼片和8 份网购的三文鱼及制品在32 个循环之前出现明显扩增曲线,判定为阳性即检出虹鳟源性成分, 另外2 份市售三文鱼生鱼片和10 份网购的三文鱼及制品在循环之前未出现明显扩增曲线的,判定为阴性即未检出虹鳟源性成分;对扩增结果进行测序分析,测序结果与测试结果一致。

图4 市售样品检测的DNA 扩增谱图Fig.4 DNA amplification profile of commercially available samples
3 结论
本研究首先对收集的样品用线粒体COX I 基因的部分特异区段设计的引物FISH F/R 进行扩增测序,验证了收集样品的真实性;进而通过设计虹鳟特异性的引物探针, 建立了针对虹鳟源性成分的实时荧光PCR 检测方法,利用17 种市场常见鱼类进行检测,结果表明本方法特异性良好,并根据试验数据设定32 个循环以后出峰的是未检出样品,为阴性;经DNA 梯度稀释验证本方法的灵敏度为0.1 ng/μL, 对市售22 份标有鲑科鱼源性成分的样品进行测试,表明本方法可用于对市售产品中虹鳟源性成分的鉴别,同时也表明虹鳟是市售三文鱼的主要鱼种之一。
