麻杏石甘汤对邪热壅肺证小鼠肠道菌群的影响研究*
2021-07-15梁泳淋巫园园陈飞龙蒙艳丽王伟明汤庆发
梁泳淋,巫园园,陈飞龙,蒙艳丽,王伟明,,汤庆发**
(1.南方医科大学中医药学院/广东省中药制剂重点实验室/广东省中药制剂技术工程实验室 广州 510515;2.黑龙江中医药科学院中药所 哈尔滨 150036)
邪热壅肺证是指邪热内壅于肺所表现的证候[1],多因温热之邪由口鼻而入,或风寒、风热之邪入里化热,内壅于肺所致。肺失宣降、痰浊化生、肺络损伤为本病病机。中医所述邪热包括了现代医学中细菌、病毒、支原体等致病因素,所致临床肺部症状以咳嗽、咯痰、发热、气粗而喘、胸痛为主。临床上中医多以麻杏石甘汤及其加减方剂[2]、白虎解毒汤[3]、桑杏清肺汤[4]以及定喘汤[5]等方剂治疗邪热壅肺证。
麻杏石甘汤出自《伤寒论》,临床上主治邪热壅肺证[6]。本方由麻黄、杏仁、石膏、炙甘草4味药材组成,四药合用,共成辛凉疏表,清肺平喘之功,可上宣肺热,下通肠热。多项临床观察表明,麻杏石甘汤加减对邪热壅肺型的社区获得性肺炎有明确的疗效[7]。有研究显示,麻杏石甘汤加减结合常规疗法可治疗邪热壅肺证支气管哮喘急性发作[8]。临床实验显示,麻杏石甘汤合千金苇茎汤加减联合西药治疗慢阻肺急性加重期痰热壅肺证患者疗效显著[9]。麻杏石甘汤治疗新冠肺炎邪热壅肺证起重要作用[10]。可见麻杏石甘汤对邪热壅肺证具有明确作用。虽然对麻杏石甘汤研究较多,但麻杏石甘汤在治疗邪热壅肺证的作用机理至目前仍未明确。
中医基础理论认为 “肺主宣发肃降” “大肠主传化糟粕” ,肺的宣降与大肠的传导变化联系紧密。正因肺与大肠的密切关系,两者会在病理方面互相影响。近年研究形成的 “肺肠轴” 理论:大肠中的肠道菌群对机体的免疫有调节作用,菌群的状态对肺系疾病的转归有重要影响。现代 “肺肠轴” 被认为是中医基础理论 “肺与大肠相表里”[11-12]理论延伸。基于 “肺与大肠相表里” 结合 “肺肠轴” 理论,本实验以麻杏石甘汤为研究对象,采用肺炎链球菌建立邪热壅肺证小鼠模型,利用高通量测序技术评价麻杏石甘汤对邪热壅肺证小鼠的效果及其肠道菌群丰富度及多样性变化,鉴定丰度显著差异的菌属,为阐明麻杏石甘汤治疗邪热壅肺证的作用机理提供了科学依据。
1 实验材料
1.1 动物
选取SPF级BALC/B小鼠24只,体质量20-22 g,雌雄各半,购自哈尔滨医科大学实验动物学部,许可证号SCXK(黑)2019-001,饲养于黑龙江省中医药科学院实验动物中心SPF级动物房,温度(22±2)℃,相对湿度60%±10%,12 h/12 h明暗周期,自由摄食饮水。
1.2 药物及制备
麻杏石甘汤(麻黄45 g,批号:1150101;苦杏仁45 g,批号:1150731;生石膏90 g,批号:8114489;炙甘草30 g,批号:8112328,均购于广州致信中药饮片有限公司)。将麻黄和生石膏加至2100 mL水中先煎30 min,加入苦杏仁、甘草熬至水沸后,小火煎煮15 min;滤出药液后加1680 mL水进行第2次煎煮(大火煮沸后,小火煎煮10 min),最后将2次药液混合浓缩,制成10.02 g浸膏。样品经煎煮、过滤、浓缩后,置于4℃冰箱保存,备用。
2 实验方法
2.1 分组
小鼠按随机数字表法随机分成正常组(简称CON组,n=8,雌雄各半)、模型组(简称MOD组,n=8,雌雄各半)和麻杏石甘组(简称MXSG组,n=8,雌雄各半)。
2.2 动物造模
邪热壅肺证模型,需先犯手太阴经,又肺主气属卫,故始病于卫,继入气分而归于肺,取 “亲” 上,邪入途径为呼吸道,所以选用肺炎链球菌为造模因素,采用麻醉下鼻内接种。接种后动物继现高热、胃寒、喘促、气急、鼻翼煽动、躁动不安、拒食、舌红等,极似温病学教材邪热雍肺证的证候,出现上述症状即为造模成功。
模型的制备参考文献中的[13]造模方法:将小鼠适应性饲养2-3天,除正常对照组外,其余各组小鼠均在乙醚轻度麻醉下鼻内接种(1×105CFU/mL)肺炎链球菌溶液,每只50µL,接种后呈45°保持30 s以利于溶液充分吸入,连续接种3天,建立小鼠邪热壅肺证模型;正常组给予等量无菌生理盐水滴鼻。
2.3 给药
给予小鼠麻杏石甘汤剂量为15.12 g·kg-1,持续给药14天。
2.4 样本采集
各组小鼠,于给药后的第14天采集粪便,采集后立刻放置-80℃保存。
2.5 DNA提取
主要试剂有TIANGEN粪便基因组DNA提取试剂盒(天根生化科技有限公司,批号Q5306);6×DNA loading buffer(天根生化科技有限公司,批号U8113);Tris盐酸缓冲液(北京酷来搏科技有限公司;批号SL30193303);KAPA HiFi HotStart DNA Polymerase(美国KAPA Biosystems,批号0000112224);Midori Green Advance DNA Strain(德国Midori Green,批号310718);AMPure XP(美国Beckman Coulter,批号17620100)。
所有样本由深圳华大基因股份有限公司进行大鼠粪便总DNA提取建库及质检,用KAPA HiFi扩增16SV4区进行16SrRNA基因测序检测,抽取DNA后使用1%琼脂糖凝胶电泳检测基因组DNA。按照实验操作说明对纯化的DNA组进行聚合酶链式反应(PCR)扩增。对样品进行PCR产物检测、纯化和定量,所有条带均完整清晰、大小正确,满足建库需要,然后进行文库制备、文库质检、定量,使用设定的TAG序列进行样本区分。
2.6 Illumina高通量测序
Illumina HiSeq2000高通量检测基因序列,获独立细菌物种(OTU),分析肠菌多样性,评价对小鼠肠菌结构影响;PERMANOVA聚类富集核心OTU,分析与MXSG功效相关菌属。
2.7 统计学方法
对小鼠肠道菌群Alpha多样性、相对丰度结果均以均值±标准差()表示,采用SPSS20统计软件进行分析。采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 3组小鼠模型评价
MOD组与MXSG组小鼠于造模当天出现躁动不安、盘旋等症状,造模第2天小鼠出现高热、喘促、食欲减退症状,造模第3天出现鼻翼煽动、呼吸困难的症状。两组小鼠邪热壅肺证模型建立成功。给药后,MXSG组小鼠食欲较MOD组增加,鼻翼煽动情况减轻,体温恢复正常。CON组小鼠未出现高热、喘促、食欲减退等症状。
3.2 药物对小鼠菌群丰富度和多样性的影响
3.2.1α多样性分析
通过Alpha多样性分析,反映三组小鼠肠道菌群的丰富度和多样性。本研究反映菌落丰富度使用了Ace指数、Chao指数和sobs指数。与CON组对比,MOD组各样本在Ace指数、Chao指数和sobs指数升高,表明造模后,小鼠菌落丰富度增加。与MOD组相比,MXSG组各样本指数升高,菌落丰富度优于MOD组。菌落丰富度有显著性差异(图1)。

图1 Alpha多样性分析MXSG对肠道菌群结构
3.2.2β多样性分析
采用PCoA分析,对各组菌群结构差异进行对比,确立小鼠肠道菌群是否发生整体结构性变化。解释PCoA图,各样本解释度值PC1、PC2分别为26.56%、25.76%,CON组与MOD组样本距离明显,MXSG组样本与MOD组距离明显,说明与正常小鼠对比,邪热壅肺证小鼠肠道菌群结构产生变化且结构差异明显,麻杏石甘汤提高邪热壅肺证小鼠肠道菌群结构多样性(图2)。
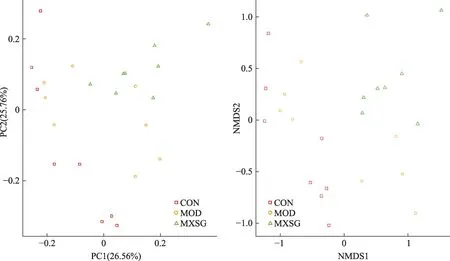
图2 PCoA分析MXSG对肠道菌群结构的影响
3.3 药物对邪热壅肺证小鼠肠道菌群相似度的影响
通过韦恩图可以比较分析各组之间独有和共有的OTU数目,进而比较多个样本群落间组成的相似度与重叠关系。3组共有的OTU数量为587,CON组、MOD组和MXSG组独有的OTU数目分别为7、19和34,MOD组区别于CON组有58个OUTs,MOD组区别于MXSG组有40个OTUS。结果提示MXSG的使用可降低MOD组菌落相似度(图3)。

图3 韦恩图分析MXSG对肠道菌群结构的影响
3.4 药物对小鼠肠道菌群结构组成的影响
从属分类水平对MOD组与MXSG组肠道菌群结构组成的变化进行分析。根据群落组成分析图,可直观呈现两方面信息:一是上各样本在某一分类学水平含有何种微生物;二是样本中各微生物相对丰度(所占比重)。
在属分类水平上,普雷菌属(Prevotella)和拟杆菌属(Bacteroides)是各个时间段各组菌群中占比最高的菌属,其次为颤螺旋菌属(Oscillospira)和乳酸菌属(Lactobacillus)。MOD组与CON组对比,梭菌属、萨特氏菌属、Odoribacter、副拟杆菌属、乳酸菌属含量有明显的差异,一些有益菌落相对丰度降低(如拟杆菌属、乳酸菌属等)。给药后,MXSG组与MOD组相比较,小鼠菌群中的副拟杆菌(Parabacteroides)、阿克曼氏菌(Akkermansia)、瘤胃球菌(Ruminococcus)丰度增加,乳酸菌属和梭菌属丰度降低,有显著差异。结果表明邪热壅肺证小鼠菌落结构在给药前后有显著差异。麻杏石甘汤对邪热壅肺证小鼠的部分有益菌如副拟杆菌、阿克曼氏菌、瘤胃球菌以及乳酸菌有显著的调节作用(图4、表1)。

表1 MXSG对小鼠肠道主要细菌属水平含量的影响(xˉ±s)

图4 各组对小鼠肠道主要细菌属水平结构的影响
3.5 LEfSe多级物种差异判别分析CON组、MOD组以及MXSG组小鼠肠道菌群的差异
LEfSe表示显著性差异,可以检测到丰度有显著差异菌群。使用LEfSe对不同条件下菌群分类,通过对菌群数量、结构变化,分析各样品对邪热壅肺证小鼠肠道菌群的作用。MXSG组在属分类学水平上前10种细菌表现出显著性差异为Verrucomicrobia,Verrucomicrobiales,Verrucomicrobiae,疣微菌(Verrucomicrobiaceae)、Allobaculum、变形菌门、阿克曼氏菌、弯曲菌属(Campylobacterales)、Epsilonproteobacteia、脱铁杆菌门(Deferribacteres)。MOD组在属分类学水平前 10种细菌为 Defluviitalea、变形 菌(Betaproteobacteria)、枯草杆菌(Bacillales)、嗜胆菌属(Bilophila)、产碱菌科(Alcaligenaceae)、粪芽孢菌属(Coprobacillus)、瘤胃球菌、梭菌属(Clostridium)、Butyricimonas、Blautia。CON组在属分类学水平上有5种细菌表现出显著性差异,莫拉菌属(Moraxellaceae)、帕拉普氏菌属(Paraprevotella)、文肯菌属(Rikenella)、不动杆菌属(Acinetobacter)、变形菌(Gammaproteobacteria)等在CON组中富集(图5)。

图5 各组差异菌属分级图
4 讨论与结论
本实验以麻杏石甘汤为研究对象,采用肺炎链球菌建立邪热壅肺证小鼠模型,利用高通量测序技术评价麻杏石甘汤对邪热壅肺证小鼠的治疗效果及其肠道菌群丰富度及多样性变化,鉴定丰度显著差异的菌属。本研究证实,邪热壅肺证小鼠增加了正常小鼠肠道菌群α多样性;给予麻杏石甘汤后,麻杏石甘汤又进一步显著提高邪热壅肺证小鼠肠道菌群α多样性。β多样性分析表明,正常组小鼠与邪热壅肺证组小鼠的肠道菌群多样性差异相对较大,麻杏石甘汤组与正常组小鼠肠道菌群多样性差异相对较小。
LEfSe物种差异辨别分析表明,与正常组小鼠相比,模型组小鼠肠道菌群中瘤胃球菌、Sutterella、阿克曼氏菌、变形菌、枯草杆菌等菌属相对丰度增加,而梭菌属、乳酸菌属丰度降低。给予麻杏石甘汤后,小鼠肠道菌群中副拟杆菌、阿克曼氏菌、瘤胃球菌相对丰度提高;疣微菌、副拟杆菌、瘤胃球菌等下调至正常水平。其中阿克曼氏菌主要代谢产物为丙酸,在肠道中可以调节机体的免疫应答,维持体内代谢平衡[14-15];乳酸菌可以通过影响短链脂肪酸的合成以辅助调节宿主代谢系统和免疫系统的发育和成熟,达到增强免疫力的作用[16]。瘤胃球菌、梭菌属、Allobaculum[17]等均是产生短链脂肪酸(SCFAs)的相关菌落,SCFAs作为抗原递呈细胞的信号分子,诱导T细胞的分化,于肺部参与调节肺部炎症及过敏反应,免疫细胞通过识别SCFAs参与肠道的能量供应来对宿主起重要的炎症反应的调节作用[18-19],改善肺部感染。由此可见,麻杏石甘汤给药后,可能通过相关菌属产生短链脂肪酸参与免疫调控抑制肺部炎症,对邪热壅肺证起治疗作用。
本研究以麻杏石甘汤为研究对象,通过用高通量测序方式研究邪热壅肺证小鼠肠道菌群丰富度及多样性变化以及麻杏石甘汤对其肠道菌群的干预作用,鉴定25种丰度显著差异的菌属。我们的研究表明,邪热壅肺证引起产生短链脂肪酸相关的肠道菌群结构及其组成发生变化,麻杏石甘汤可能通过促进邪热壅肺证小鼠产生短链脂肪酸相关的菌属丰度,参与免疫调控抑制肺部炎症,从而发挥治疗邪热壅肺证作用。
