青蒿鳖甲汤对肝癌模型小鼠代谢的影响*
2021-07-15韩鑫龙谭晓梅汤庆发陈飞龙杨加顺
成 欣,韩鑫龙,谭晓梅,汤庆发,陈飞龙,杨加顺,唐 玲**
(1.南方医科大学中医药学院 广州 510515;2.广东省中药制剂重点实验室/广东省中药制剂技术工程实验室广州 510515;3.大连大学生命科学与技术学院 大连 116622;4.南方医科大学第三附属医院 广州 510630)
肝癌的死亡率为为8.2%,是全球范围内死亡率较高的癌症之一,也是男性中死亡率仅次于胃癌的癌症,2018年新增约84万病例[1]。我国是肝病大国,有67万的肝癌患者,占2015年的新增癌症病人数的10.86%。就死亡率而言,肝癌在我国仅次于肺癌和胃癌[2],目前已成为发病率与死亡率居我国前列的疾病。因此攻克肝癌是我国亟待解决的公共健康课题。原发性肝癌包括肝细胞癌、肝内胆管癌以及其它罕见肿瘤,主要为肝母细胞瘤和纤维层状癌[3]。目前常用的临床治疗方式有肝移植、手术切除、化疗、放疗及靶向治疗,肝癌早期治疗以肝移植和手术切除为主,术后5年生存率仅为50%左右,而复发率却高达70%[4]。肝细胞癌是肝癌中常见的恶性肿瘤,其起病隐匿,且预后比较差。索拉非尼对于不适合手术切除或肝介入治疗的肝癌患者进行靶向治疗的效果不理想[5]。
据文献报道,中国约80%肝癌患者在不同程度上接受过中医药的治疗[6-7]。并且中医药在预防和降低肝癌复发及转移率、改善症状、提高免疫能力、提高患者生存质量,甚至延长患者生存时间方面具有独特的优势[6-7]。有随机对照、多中心临床试验证明,服用相应的现代中药制剂可使肝癌术后复发的风险显著降低[8]。如果可以从分子、细胞水平阐明中医药抑制肝癌进展的机制,将更有助于中医药在肝癌治疗中发挥作用,促进临床疗效的改善与提升。
癌性发热的原因之一是由于肿瘤迅速生长从而造成的局部缺氧缺血引发坏死进而激发炎症反应,导致发热,这与肿瘤的代谢方式息息相关。肿瘤表现出可促进癌症进展的重新编程的代谢活动,肿瘤细胞由于特殊的能量与物质需求,会采用和正常细胞完全不同的代谢方式。因此研究抑制肿瘤代谢方式的手段可使肿瘤患者受益。而目前关于血浆中的物质作为肿瘤标志物及其动态变化在疾病在诊断中起到至关重要的作用,血液样本可以整体的反映机体生理或病理状态下的重要信息。而肝脏作为重要的代谢器官,是人类的代谢中心。很多营养物质、药物、血液及肝细胞内物质被小肠吸收后至少会通过一次肝脏,它能够调节机体众多代谢物的表达水平,因此肝脏的病变必然引起代谢的变化。这使得代谢组学分析方法特别适用于肝癌的研究。
青蒿鳖甲汤作为清虚热的代表性方剂,出自温病学家吴鞠通的《温病条辨》。目前该方在临床应用于内科、外科、妇科、儿科、血液、皮肤、肿瘤等各个方面,在治疗原因不明的发热上有良好效果[9]。吴鞠通在《温病条辨·下焦篇》中说: “夜热早凉,热退无汗,热自阴来者,青蒿鳖甲汤主之。” 吴氏自释该方的药物配伍时说: “此方有先入后出之妙,青蒿不能直入阴分,有鳖甲领之入也;鳖甲不能独出阳分,有青蒿领之出也” 。随着肿瘤不断生长,机体能量不断消耗,抵抗能力愈来愈差,久而久之则出现阴虚热结之证,出现手足心热、口燥咽干、潮热盗汗等癌热现象。青蒿鳖甲汤作为清虚热代表方剂,临床对多种肿瘤产生的癌热有效,因此首次选用青蒿鳖甲汤作为改善肝癌癌热的中药复方,在提高对实体瘤的缓解率的同时减轻癌热。
本实验利用液相色谱质谱(UHPLC-Q-Exactive)联用技术及多元统计分析,从生物学角度出发研究青蒿鳖甲汤干预后肝癌小鼠血浆中代谢物的变化并进行相关代谢通路分析,探讨青蒿鳖甲汤改善肝癌后期发热可能参与的代谢途径,初步阐释青蒿鳖甲汤改善肝癌及发热的作用机制,为肝癌的辅助治疗提供新思路。通过分析肝癌模型组与青蒿鳖甲汤治疗后的代谢轮廓,利用标志性的代谢物对代谢途径进行探索,分析这些代谢物所涉及的代谢通路,能更整体地阐述肝癌的代谢水平及它们的前后对比关系,对中药复方改善肝癌的临床症状很有参考价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
从南方医科大学实验动物中心购买C57小鼠21只,体质量16-22 g,6-8周龄,雄性,保证全部动物在SPF级实验室进行饲养与操作,实验动物合格证号:SCXK(粤)2016-0041。
1.1.2 实验瘤株
鼠源肝癌细胞株H22,由南方医科大学中医药学院分子生物学重点实验室赠送。
1.1.3 药物与试剂
药材:青蒿饮片、鳖甲饮片、生地饮片、知母饮片、丹皮饮片均购自康美药业。
试剂:乙醇;LCMS Methanol、LCMS Acetonitrile、
LCMSFormic Acid、LCMSWATER、2-Propanol(Fisher Chemical)。
1.1.4 主要仪器设备
电子分析天平CPA225D SARTORIUS(德国赛多利斯十万分之一电子天平);旋转蒸发仪EYELA(上海爱朗仪器有限公司);冻干机(北京赛欧华创科技有限公司);超声波清洗器JP-080ST(深圳市洁盟清洗设备有限公司);台式快速离心浓缩干燥器LNG-T88(太仓市华美生化仪器厂);手动单道移液器(Eppendorf);电凝止血器(广州宝汇生物科技有限公司);BD胰岛素注射器(北京润泽康生物科技有限公司);冷冻离心机(Eppendorf);试管垂直旋转摇床QB-210(海门市其林贝尔仪器制造有限公司);恒温混匀仪TMR(TMR);氮气吹扫仪JXDC-20(上海净信实业发展有限公司);Vanquish Horizon UHPLC液相色谱系统、Q-Exactive system质谱仪(Thermo Scientific)。
1.2 药物制备
取青蒿鳖甲汤原方三倍量(青蒿30 g、鳖甲45 g、生地36 g、知母18 g、丹皮27 g)药材置于6倍量的75%乙醇中浸泡12h过夜,次日超声提取2次,每次1 h。减压浓缩得到浸膏,后冻干保存。
1.3 动物造模
1.4 分组给药
模型验证成功后开始给药,正常组与模型组分别按10 mL·kg-1给予生理盐水,青蒿鳖甲汤组按照19.728 g·kg-1进行灌胃给药,所有小鼠按1天1次灌胃给药,连续给药14天。
1.5 检测指标与取材
造模完成后,每隔1天称量各组小鼠体质量,每隔1天测量瘤体积的变化。小鼠末次给药后禁食不禁水,24 h内称小鼠体质量,眼眶静脉采血,断颈处死,收集血液,剥离肿瘤分析天平称重,计算抑瘤率。
瘤体积=(1/2*L*W2,L:长,W:宽)
抑瘤率=[1-(给药组平均瘤重/模型组平均瘤重)]×100%
1.6 血浆非靶向代谢组学
1.6.1 血浆样品采集与制备
将眼眶静脉采血收集到的血液样本置于抗凝管后于室温静置30 min,于4℃、≤1300×g离心10 min,待血细胞完全沉降后,取上层血浆置于另一离心管中,-80℃冷冻保存;上机前取100μL样品于1.5 mL离心管中,再加入400μL提取液(乙腈∶甲醇=1∶1);30 s涡旋混匀后,用低温超声提取30 min(5℃,40 KHz);样品静置于-20℃30 min后离心15 min(13000 g,4℃),再吸取上清液,用氮气吹干;样品用100μL溶液(乙腈∶水=1∶1)复溶,低温超声萃取5 min(5℃,40 KHz);离心5 min(13000 g,4℃),取上清液上机分析;分别于每个样本移取20 uL上清液,混匀后作为质控样本(QC)。
1.6.2 LC-MS条件
本实验所使用的仪器平台为Thermo Fisher Scientific超高效液相色谱串联傅里叶变换质谱UPLC-Q-Exactive系统。色谱柱为BEH C18柱(100 mm×2.1 mm i.d.,1.7μm;Waters,Milford,USA);流动相A为乙腈/异丙醇(1/1)(含0.1%甲酸),流动相B为水(含0.1%甲酸);分离梯度:0-3 min,5%-20%A;3-9 min,20%-95%A;9-13 min,95%A;13.0-13.1 min,95%-5%A;13.1-16 min,5%A。进样量2μL,流速为0.40 mL·min-1,柱温为40℃。采集样品质谱信号为正负离子全扫描模式,质量扫描范围(m/z):50-1000。离子化电压:正离子电压3500 V,负离子电压-2800 V,辅助加热气10 psi,鞘气40 psi,离子源加热温度500℃,循环碰撞能20-60 V。
1.6.3 数据预处理
综上所述,我们发现,安培力实际上是导体中自由电荷在运动时,受到洛伦兹力分力的总和,并不是洛伦兹力的合力。因此,可说安培力的微观是洛伦兹力,但是不能说洛伦兹力的宏观是安培力。洛伦兹力不做功,而安培力是要做功的,也可以说洛伦兹力分力的在宏观上是要做功的,且安培力在做负功时会等于其产生的焦耳热,而前提则是导体回路中有动生电动势产生。通过对两力之间的深层次的讨论,可以让高中生对二者力理解得更加透彻,在处理问题的过程中,也会更加容易掌握解题的思路。
将所得的原始数据导入代谢组学处理软件Progenesis QI(Waters Corporation,Milford,USA),进行基线过滤、峰识别、峰对齐、保留时间校正、积分后,可获得一个含保留时间、质荷比与峰强度的原始数据矩阵。使用Progenesis QI代谢组学处理软件进行搜库鉴定,将MS所得的质谱信息与代谢数据库(http://www.hmdb.ca/;https://metlin.scripps.edu/)进行匹配。然后再进行数据预处理:首先去除所有样本中缺失值大于80%的变量;用原始矩阵中位数进行补缺;再总峰归一化处理,同时删除质控样本相对标准偏差(RSD)≥30%的变量;最后经过log10转换,获得最终用于进行后续分析的数据矩阵。
1.6.4 统计分析方法
药效指标等实验数据均用SPSS 20.0统计软件做统计学处理,结果以±s表示,两组间定量资料的比较用两独立样本t检验,P<0.05为有显著性差异。应用美吉生物云平台(https://cloud.majorbio.com/index)进行代谢组学数据分析,组间模式识别采用主成分分析(PCA)和正交-偏最小二乘判别分析(OPLS-DA),根据分析结果构建相应的得分图。差异代谢物的筛选采用正交-偏最小二乘判别分析方法,根据OPLS-DA模型的VIP(第一主成分变量重要性)值,结合两样本t检验所得的P值,以VIP值>1且P<0.05为标准找寻差异代谢物。根据不同组间代谢物对应化学位移处的峰面积平均值比值,即差异倍数(foldchange,FC)来判断给药前后血浆代谢物含量的变化,FC>1表示此位移处的代谢物含量升高,相反,则表示此位移处代谢物含量下降。然后通过KEGG检索各种差异代谢物信息,再进行代谢通路的分析,选择重要性得分排名前三的代谢通路进行深入分析探讨。
2 结果
2.1 对H22荷瘤模型中肿瘤生长的影响
与模型组比较,青蒿鳖甲汤给药组的瘤质量呈降低趋势,有显著性差异(P<0.05),抑瘤率为15.01%,瘤体积显著减小,而体质量无明显变化(图1)。
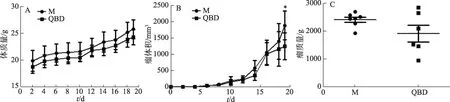
图1 青蒿鳖甲汤对H22荷瘤小鼠模型中肿瘤生长的影响图
2.2 LC-MS结果
3组小鼠LC-MS样本的离子流图TIC如图2所示。将TIC导入代谢数据库后选择出匹配度较好的内源性代谢物进行后续的多元统计分析。
图2 不同组小鼠血浆代谢的TIC图
2.3 模式识别
经匹配后提取出的数据进行预处理后,先对样品进行模式识别,通过PCA分析后,得到相应的得分图,见图3。样本经降维分析后,在主成分p1,p2上出现相对应得坐标点,各个坐标点的距离表示了样本间聚集和离散程度,距离越近说明样本间相似度越高,距离越远说明样本间差异度越大。PCA得分图显示3组之间的样本有交叉点,但是仍能从分布上看出是分开的,说明分离程度较好。使用OPLS-DA模型进行分析,去除与样品分类无关的信息后对血浆全谱进行分析,发现在正负离子模式下,正常对照组与模型组,模型组与青蒿鳖甲汤给药组样本均能得到明显分离,表明各组血浆中内源性物质的代谢模式存在差异,该模型能够解释样本间代谢差异,见图4。另外,质控样品出现聚簇,表明分析系统稳定,QC重复性良好,在分析过程中仪器稳定性良好。
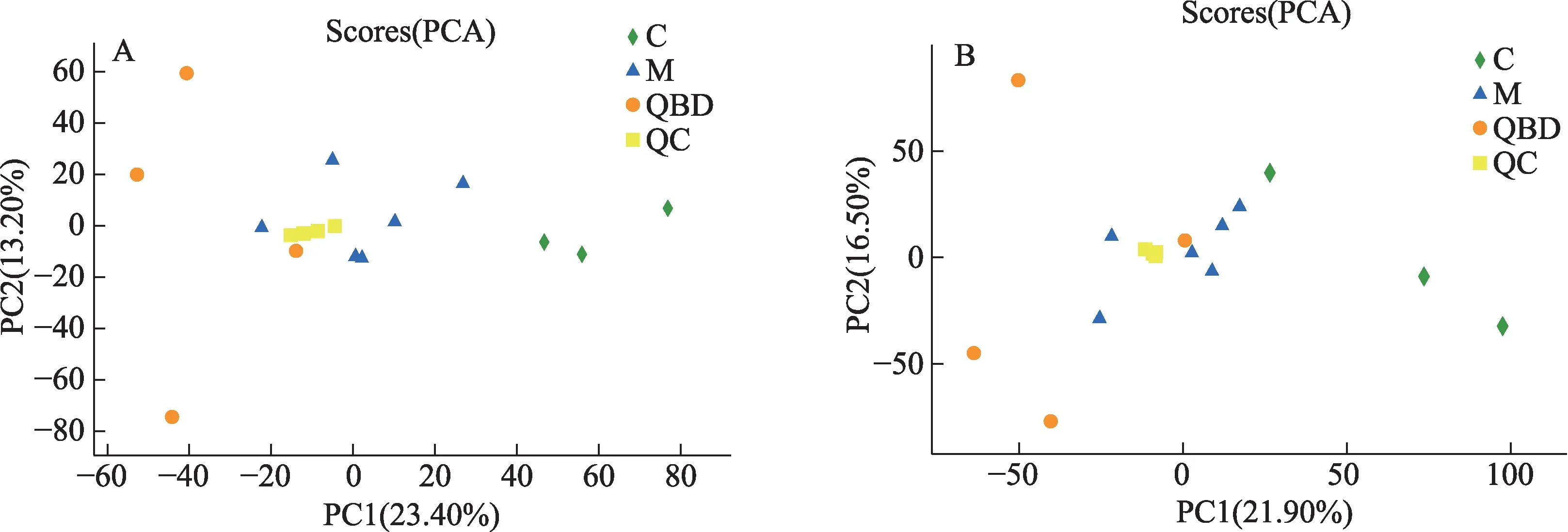
图3 各组血浆样本的PCA得分图
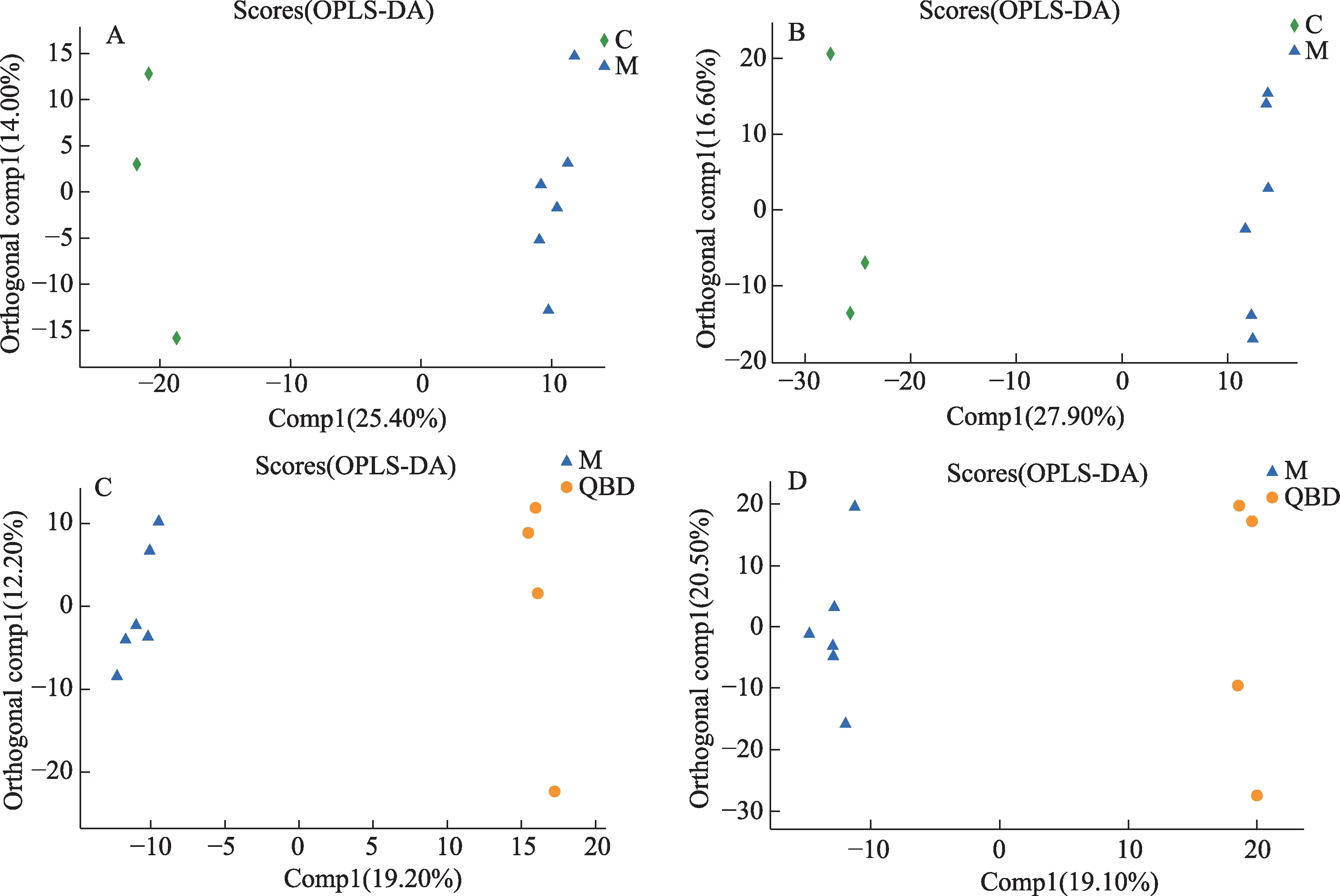
图4 各组血浆样本的OPLS-DA得分图
2.4 差异代谢物筛选
为了获得青蒿鳖甲汤给药后肝癌模型小鼠的代谢相关物质基础,将青蒿鳖甲汤组与模型组进行比较,根据OPLS-DA分析结果,筛选符合VIP>1.0且P<0.05条件的差异变量,最终通过定性分析获得86个差异代谢物。根据所寻找的差异代谢物在KEGG数据库进行对比归属,最终初步确定了以胆酸、溶血磷脂酰胆碱(LPC)、磷酸鞘氨醇、9,10,13-三羟基十八碳烯酸为主的15种具有显著差异的代谢物(表1)。
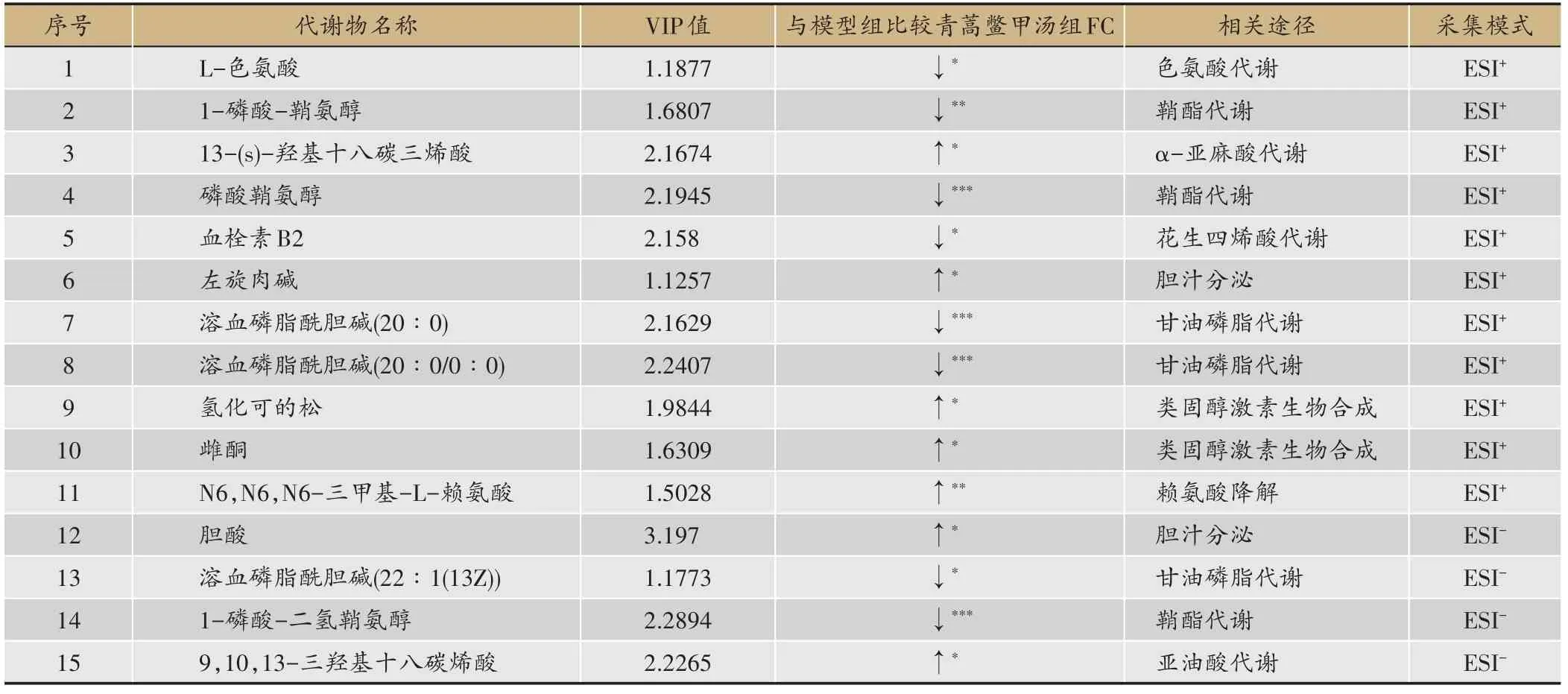
表1 青蒿鳖甲汤给药组与模型组小鼠血浆标志差异代谢物
2.5 通路分析
将上述15个通过条件筛选出来的具有显著差异的代谢物进行KEGG通路富集分析,以此作为青蒿鳖甲汤对肝癌模型小鼠血浆代谢组学中的相关代谢途径。通路富集结果以富集因子、代谢物个数、FDR作为参考标准,结果显示这些差异代谢物的关键代谢途径主要富集于胆汁分泌、鞘脂代谢、类固醇激素生物合成代谢(图5)。
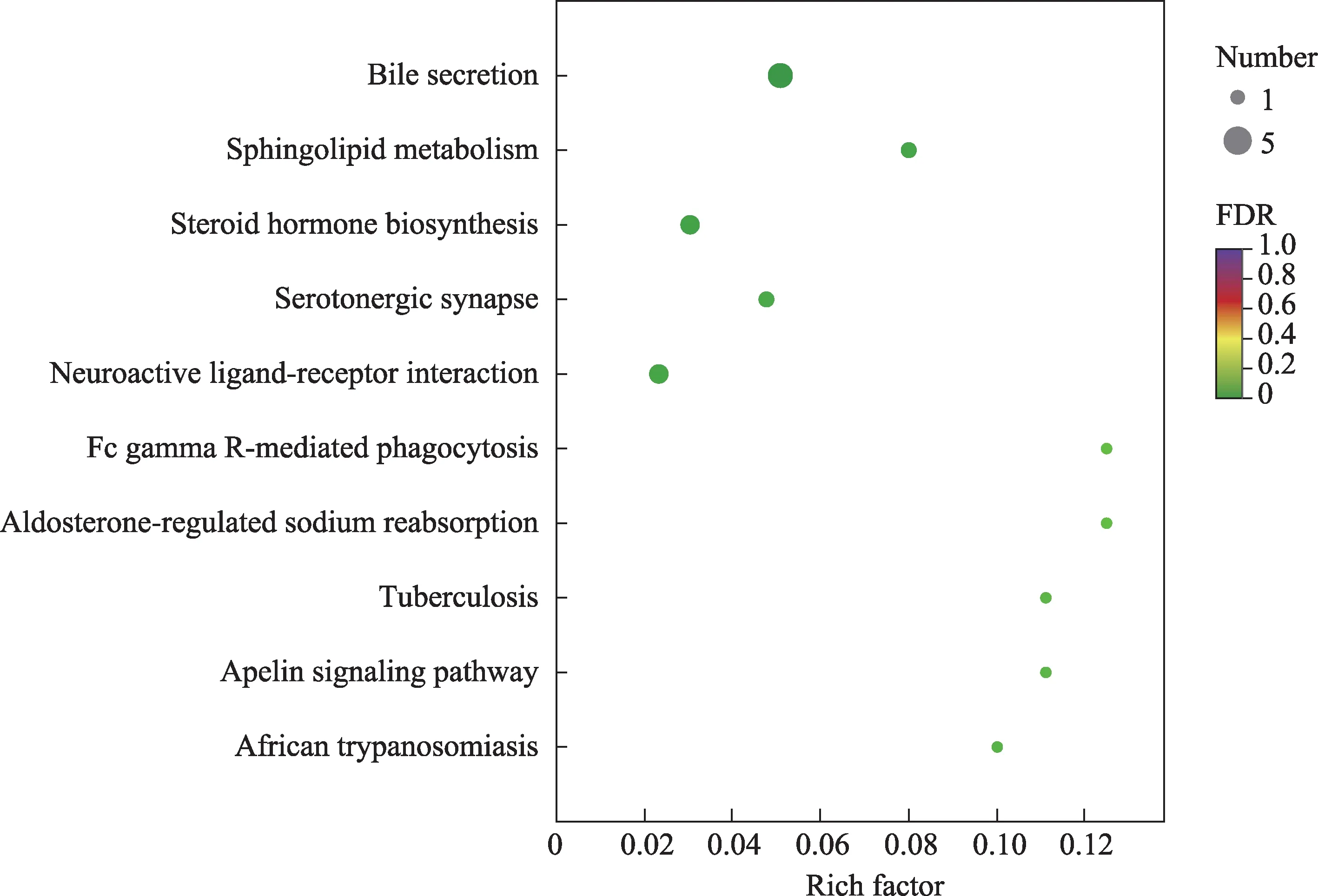
图5 KEGG通路富集分析图(QBD-MX)
3 讨论
青蒿鳖甲汤经典的原方组成为:青蒿、鳖甲、细生地、知母、牡丹皮。主治温病后期、阴液已伤、而余邪深伏阴分,症见热退无汗、夜热早凉、脉细数、舌红苔少[10]。青蒿清热透络,引邪外出,有抗疟、抗寄生虫、解热抗炎、抗肿瘤及调节免疫等功能[11];鳖甲滋阴退热,入络搜邪,有一定抗疲劳和促进免疫功能的作用,还可抗肝纤维化和抑制肿瘤[12];知母滋阴降火,有一定降血糖、抗炎解热及抗肿瘤作用[13];生地滋阴凉血,具有止血、抗肿瘤等作用[14];丹皮泻血中伏火,能抗菌消炎及抗肿瘤,对免疫系统有一定影响[15]。本次研究从代谢组学角度阐述青蒿鳖甲汤对肝癌模型小鼠的内源性代谢物的调控作用,改善肝癌及后期发热可能参与的代谢途径。
由于癌症具有多阶段性、多基因改变,发病过程极其复杂等特点,所以探究癌症需要从更加整体和宏观的角度作为出发点,而代谢组学作为一种较好的研究方法能同时进行定量测定和定性分析机体或机体某一组织包含的所有低分子量代谢产物,监测代谢物的波动情况,研究其在外界干预或病理生理条件下的动态变化规律。组学技术能全面地研究机体在病理状态下体内代谢紊乱情况,其研究方法与中医学的整体观相吻合。疾病会导致机体病理过程的变化,最终引起代谢产物出现相应的改变,代谢物是机体生化反应过程的最终产物,其浓度对遗传和环境变化极为敏感[16],所以该技术在疾病的预测诊断,机制研究等方面具有重要作用。
3.1 胆汁分泌
胆汁由肝脏生成和分泌。肝细胞生成的胆汁能促进脂质的消化和吸收,调节胆固醇代谢,清除机体产生的代谢废物等[17]。本实验研究发现青蒿鳖甲汤可以促进胆汁分泌通路中胆酸的含量增加,胆酸是由肝脏中的胆固醇合成的,并在胆汁分泌之前与牛磺酸或甘氨酸结合成为胆汁酸。而胆酸作为一种有效的信号分子,可作为弱的FXR激动剂,导致胆汁酸合成减少和胆固醇平行增加。细胞核受体FXR对胆汁酸的亲和力较高,其相互协调作用以维持胆汁酸水平相对稳定,形成一个有效的防御机制,能够抑制胆汁酸的致癌性。有研究发现胆酸可改善脂溶性维生素的吸收并改善胆汁酸合成缺陷的许多临床特征,包括改善血清转氨酶水平,降低胆红素和黄疸以及改善总体健康和生长[18],从而缓解肝癌小鼠肝功能异常的情况。本研究也发现青蒿鳖甲汤有上调左旋肉碱的作用,左旋肉碱具有促进脂肪酸氧化,调节机体脂质代谢,抗炎抗氧化的功能,可以通过提高抗炎能力从而减轻脂多糖诱导的小鼠肝损伤[19]。
3.2 鞘脂代谢
鞘脂在细胞膜结构、信号传导和能量提供方面发挥着重要作用,鞘脂代谢主要通过以鞘氨醇为基础化合物的复杂反应,调控细胞生长、分化及凋亡过程,若代谢失常则会导致肿瘤、炎症、免疫性疾病、心血管等疾病的发生。许多抗肿瘤药物、细胞因子能通过影响鞘磷脂的降解而增加内源性神经酰胺的含量,并抑制S1P的生成,从而引起肿瘤细胞的凋亡,发挥抗肿瘤作用。近年来有研究发现鞘脂代谢参与了肝细胞癌(HCC)的发生与发展过程,1-磷酸鞘氨醇(S1P)可促进肿瘤增殖、迁移、转化、血管生成[20]。Jung-Chien Cheng等[21]研究结果显示,S1P可以作为Hippo途径的上游阻遏物,从而诱发HCC细胞中YAP的活化,导致了HCC的发生。各种病因引起的鞘脂代谢网络紊乱,包括神经酰胺的生成减少或降解增多,S1P生成增多,代谢失衡导致的肝细胞增殖失控,都会促进HCC的发生、生长、转移和侵袭[20]。本实验发现给予青蒿鳖甲汤后肝癌小鼠的1-磷酸鞘氨醇(S1P)和1-磷酸-二氢神经鞘氨醇等有下调趋势,从而对HCC细胞产生生长抑制,减缓肝癌的发展进程,表明青蒿鳖甲汤可能通过调节鞘脂代谢途径发挥肝癌抑制的作用。
3.3 类固醇激素生物合成
类固醇激素又称为甾体激素,在维持生命、机体生长发育、能量代谢、免疫调节等方面有重要的影响。氢化可的松能增加血管的紧张性,降低毛细血管的通透性,因此减轻渗出、水肿症状;通过抑制炎症细胞在炎症部位的聚集,并抑制吞噬细胞的功能,稳定溶酶体膜,阻止补体参与炎症反应及炎症化学中介物的合成与释放,缓解红、肿、痛等症状,也能提高机体对有害刺激的应激能力。薛成俊等[22]研究表明氢化可的松可促进IL-15活化的NK细胞的增殖,在适合浓度下能增强对胰腺癌SW1990细胞杀伤活性;Jung Kyo Lee等[23]研究发现氢化可的松能抑制肿瘤的生长且与肝素合用效果更佳。本实验中氢化可的松上调说明青蒿鳖甲汤给药后可通过影响皮质激素代谢来改善炎症反应,从而缓解肿瘤的生长速度,同时减轻癌热症状。
本研究结果显示,青蒿鳖甲汤可能通过调节体内鞘酯代谢、胆汁分泌、类固醇激素生物合成、色氨酸代谢、α-亚麻酸代谢、花生四烯酸代谢、甘油磷脂代谢、赖氨酸降解、亚油酸代谢等代谢通路中的相关代谢产物的表达,抑制肝癌模型小鼠的肿瘤生长的同时减轻癌热,缓解肝功能异常情况,改善总体健康。
