新型壳聚糖磁性材料的制备及其染料吸附机理探究
2021-07-15张凌琳
田 甜, 张凌琳
(1.口腔疾病研究国家重点实验室, 成都610041; 2.国家口腔疾病临床医学研究中心, 成都610041;3.四川大学华西口腔医院牙体牙髓病科, 成都610041)
1 引 言
染料是一种毒性强, 不易生物降解的化学物质. 染料废水是工业废水中常见的污染物之一. 目前, 染料废水所造成的污染已成为制约经济快速发展、影响人民健康、严重破坏环境的严重问题[1-2]. 染料具有的表面活性很容易在水体表面形成泡沫, 阻碍阳光和氧气进入水体, 从而干扰水生生物的光合作用和呼吸[3]. 此外, 大多数染料对于人体都是有害的, 有可能导致肾衰竭、大脑功能障碍和中枢神经系统紊乱等[4].
壳聚糖(CTS)是自然界中第二丰富的生物聚合物, 因其成本低, 且具有优良的生物相容性和抗菌活性而被广泛关注[5]. 磁性壳聚糖材料已在生物医学、环境和分析领域应用. 由于聚合物涂层的保护, 壳聚糖包覆的磁性颗粒难被氧化[6]; 与其他单一吸附剂相比, 具有经济、环境友好和可重复使用等优点[7]. 壳聚糖具有许多活性吸附位点, 其中包括氨基(-NH2)和羟基(-OH)官能团, 可直接用于去除染料或金属离子, 或作为潜在结合位点进行进一步修饰改性[8-10]. 金属螯合的生物聚合物可以高效去除水中污染物[11-12]. Zhang等人[13]制备了Ti(IV)-CTS复合材料, 用于吸附水溶液中的Cr(VI). Sowmya等人[14]将Zr(IV)负载到CTS上, 并将其应用于硝酸盐和磷酸盐的去除. 此外, Fe和Cu螯合的壳聚糖复合物也已经被成功制备[15-16].
本文通过铜离子与壳聚糖的配位螯合以及磁性粒子的引入, 制备了一种新型吸附剂Cu@CTS@Fe3O4用于吸附活性艳红(RBR)染料废水; 对Cu@CTS@Fe3O4的结构和形貌进行了详细表征, 同时探究了吸附时间、吸附温度、pH值以及离子强度对吸附剂吸附量的影响;此外, 还建立了不同的动力学模型和等温吸附模型以进一步探究吸附机理.
2 实 验
2.1 仪器与试剂
FeCl2·4H2O、FeCl3·6H2O、NH3·H2O (25%~28%)、CuSO4、NaCl (分析纯, 上海阿拉丁生化科技股份公司). 冰乙酸、壳聚糖 (CTS, 脱乙酰度≥90%)、戊二醛 (GA, 50%水溶液)、HCl (36%~38%)、NaOH、活性艳红 (RBR)(分析纯, 国药集团化学试剂公司).
傅里叶红外光谱(FTIR; Spectrum Two, 美国Perkin-Elmer公司); 热重(TGA; DTG-60; 日本岛津公司)分析; 扫描电镜(SEM; SU8010, 日立日立公司); 紫外可见光分光光度计(UV-Vis; UV-2602, 上海尤尼柯公司).
2.2 Fe3O4粒子的制备
采用改进的化学共沉淀法制备了磁性Fe3O4粒子[17]. 首先将FeCl2·4H2O (2.16 g)和FeCl3·6H2O (1.26 g)在氮气的保护下溶解于40 mL去离子水中, 并在60 °C下搅拌30 min以充分混合. 随后, 向混合溶液中滴加NH3·H2O (10 mL). 滴加完毕后进一步搅拌30 min以充分反应. 反应结束后, 冷却至室温. 最终的Fe3O4粒子由磁铁收集得到, 反复用去离子水洗涤以除去残留的铁盐, 在真空干燥箱中80 °C干燥24 h, 得到纯净的Fe3O4磁性粒子.
2.3 复合材料CTS@Fe3O4和Cu@CTS@Fe3O4的制备
通过CTS与铜离子的配位及磁性粒子Fe3O4的引入制备了Cu@CTS@Fe3O4复合材料.首先将1 g CTS加入50 mL 2%的乙酸水溶液中, 磁力搅拌24 h以保证CTS粉末完全溶解, 制备壳聚糖乙酸溶液. 在制备的溶液中加入Fe3O4粒子, 超声波处理得到均匀分散的体系. 随后在机械搅拌下滴加100 mL 1 mol/L CuSO4水溶液, 滴加完毕后在室温下继续搅拌2 h, 再加入2 mL 25%交联剂GA, 在40 °C下进一步搅拌1 h. 最终制得的Cu@CTS@Fe3O4复合材料通过磁铁收集, 并用去离子水和乙醇反复洗涤, 于60 °C干燥.
使用同样的方法制备了另一种复合吸附材料CTS@Fe3O4, 其中省去了加入CuSO4水溶液的过程.
2.4 吸附动力学研究
首先配置含有1 000 mg/L RBR的母液, 并用去离子水稀释成不同浓度进行吸附实验. 称取一定量的吸附剂CTS@Fe3O4或Cu@CTS@Fe3O4于锥形瓶中, 用量筒量取25 mL一定浓度的RBR水溶液, 配置多组平行样. 配置好的溶液置于恒温振荡箱中吸附, 振幅为120 rpm, 吸附温度为20 ℃. 每隔一段时间测定上清液中RBR的吸光度值, 通过RBR标准曲线求得其浓度, 并依据公式(1)计算相应的吸附量.
(1)
依据上述方法研究了CTS@Fe3O4和Cu@CTS@Fe3O4对RBR的吸附动力学过程. 其中,Qt(mg/g)为t时刻吸附剂对RBR的吸附量;V(mL)为RBR溶液的体积;C0(mg/L)和Ct(mg/L)则分别对应于溶液中RBR的初始浓度和吸附t时刻后溶液中RBR的浓度;m(g)为吸附剂质量.
2.5 等温吸附研究
等温吸附实验过程类似于动力学实验, 称取一定量的复合吸附材料于锥形瓶中, 加入40 mL不同浓度的RBR水溶液, 于恒温振荡箱中振荡吸附, 设定振幅为120 rpm. 最终测定吸附后上清液中RBR的吸光度值, 通过RBR标准曲线求得其浓度, 并依据公式(2)计算相应的吸附量, 绘制得到等温吸附线.
(2)
依据上述方法研究了CTS@Fe3O4和Cu@CTS@Fe3O4对RBR的等温吸附过程. 其中,Qe(mg/g)为吸附平衡时吸附剂对RBR的吸附量;V(mL)为RBR溶液的体积;C0(mg/L)和Ce(mg/L)则分别对应于溶液中RBR的初始浓度和平衡时溶液中RBR的浓度;m(g)为吸附剂质量.
为了探究pH对于吸附的影响, 用一定浓度的NaOH溶液和HCl溶液进行调节, 考察不同pH下复合材料对于染料的吸附性能, 并考察不同pH下吸附容量变化的原因, 同时探究相应吸附机理; 而为了探究离子强度对于吸附的影响, 通过在染料中添加不同量的NaCl进行调节, 同时探究相应的吸附机理.
3 结果与讨论
3.1 FTIR分析
图1为Fe3O4, CTS, CTS@Fe3O4和Cu@CTS@Fe3O4的红外谱图. 图1(a)中580 cm-1附近的峰是Fe3O4的Fe-O振动峰, 证明了Fe3O4粒子的成功制备[18]. 对于图1(b)中的CTS, 在3 400 cm-1附近的特征峰吸收带是由O-H和N-H的伸缩振动形成的, 表明分子结构中存在氢键作用力; 在2 920 cm-1和2 870 cm-1处观察到两个特征吸收峰, 它们是由-CH2的反对称和对称伸缩振动引起的. 此外, 典型的CTS特征吸收峰还包括:1 660 cm-1(N-H的伸缩振动)、1 370 cm-1(N-H的弯曲振动)和1 090 cm-1(C-O的伸缩振动). 图1(c)和(d)为两种复合材料的红外谱图. 对于CTS@Fe3O4, 壳聚糖和Fe3O4的所有原始特征吸收峰仍然存在, 证实了该材料成功制备; 而对于Cu@CTS@Fe3O4, 在615 cm-1处出现了一个新的吸收峰, 这是由于O-Cu的振动产生的[19]. 此外, 与CTS@Fe3O4相比, 在3 400 cm-1附近的吸收波段的相对强度增强, 且N-H的伸缩振动从1 660 cm-1处位移到较低波数的1 630 cm-1处, 这进一步表明CTS的氨基和羟基参与了与铜离子的配位螯合.

图1 红外谱图:(a) Fe3O4, (b) CTS, (c) CTS@Fe3O4, (d) Cu@CTS@Fe3O4

图2 SEM图: (a) CTS@Fe3O4, (b) Cu@CTS@Fe3O4Fig.2 SEM images of (a) CTS@Fe3O4 and (b) Cu@CTS@Fe3O4
3.2 SEM分析
图2为CTS@Fe3O4和Cu@CTS@Fe3O4的SEM图. 由图2可以看出, 两种复合材料均呈不规则形状, 且表面相对粗糙, 这一特征增大了吸附剂与染料分子的接触概率, 有利于吸附. 对比两种材料的形貌可以发现, 未与Cu离子配位螯合的CTS@Fe3O4具有明显的孔状结构, 而配位之后, Cu@CTS@Fe3O4的表面相对平滑.这说明Cu离子与CTS形成配位键之后会占据这些孔道结构. 尽管这种特点可能会造成材料比表面积的减小, 但由于与吸附材料与染料的结合主要是通过化学作用来实现的, 因此这种由物理因素造成的吸附量的降低是可以接受的.
3.3 TGA分析
图3为CTS@Fe3O4和Cu@CTS@Fe3O4的TGA曲线. 两种复合材料的热失重曲线基本类似, 大致可以分为三个失重阶段. 200 ℃以下是第一个质量损失阶段, 这部分重量降低是由于材料表面吸附水和结合水的挥发所致; 第二个失重阶段在200~600 ℃, 该阶段质量损失较大:其中在低温区(200~400 ℃)的质量损失主要归因于壳聚糖分子链上未脱去乙酰基的分解; 而高温区(400~600 ℃)的质量损失则是由于壳聚糖主链的分解所造成的; 600 ℃以上为第三个失重阶段, 该过程的质量损失是由于Fe3O4向α-Fe2O3的转变引起的[20].

图3 CTS@Fe3O4和Cu@CTS@Fe3O4的TGA曲线
3.4 复合材料的吸附动力学
为研究CTS@Fe3O4和Cu@CTS@Fe3O4对RBR的吸附机理, 寻求描述吸附的动力学规律, 我们研究了两种复合材料对RBR的吸附量随吸附时间的变化趋势,其结果以及准一级动力学和准二级动力学拟合模型如图4所示.
由图4可知, 与CTS@Fe3O4相比, Cu@CTS@Fe3O4表现出更高的染料吸附速率, 这说明铜离子与RBR分子具有更好的结合能力. 其中CTS@Fe3O4在吸附2 h左右吸附容量趋于平衡, 此时吸附量达到454.21 mg/g; 而Cu@CTS@Fe3O4在吸附1 h左右趋于吸附平衡, 此时的吸附量为708.25 mg/g. 对于Cu@CTS@Fe3O4而言, 在前10 min内快速吸附是由于大量吸附位点的存在以及溶液中包含的大量RBR分子. 而随着吸附时间的延长, 吸附剂的大部分吸附位点被占据, 且溶液中RBR浓度降低, 因而吸附速率也随之降低.
根据准一级动力学方程(式3)和准二级动力学方程(式4)对不同吸附时间内RBR的吸附量进行动力学拟合[21], 其结果如表1所示.
ln(Qe-Qt)=lnQe-k1t
(3)
(4)
其中,k1和k2分别是准一级和准二级动力学方程的吸附速率常数,Qt和Qe吸附剂对染料在t时刻和吸附平衡时的吸附量.

表1 CTS@Fe3O4和Cu@CTS@Fe3O4对RBR的吸附动力学参数
由表1可知, 两种复合材料对RBR的吸附动力学过程更符合准二级动力学模型, 拟合得到较高的线性相关系数R2, 且拟合得到的平衡吸附量值Qe, cal与实验值更为接近, 这说明吸附过程主要受化学吸附控制.
3.5 复合材料的等温吸附
为进一步明确吸附机理, 更好地揭示Cu@CTS@Fe3O4对RBR的吸附等温过程, 分别采用Langmuir(式5)和Freundlich(式6)模型拟合平衡吸附浓度和平衡吸附量吸附数据[22], 其结果如图5所示.
Langmuir等温吸附方程:
(5)
Freundlich 等温吸附方程:
(6)
其中,Ce为平衡浓度,Qe为平衡吸附量,Qm为最大吸附量. Langmuir吸附等温方程中,bL为Langmuir常数, 与吸附剂对染料吸附的吸附平衡常数K有关,M和ρ分别是染料的摩尔质量和密度; Freundlich吸附等温方程中,KF和1/n为相关吸附常数, 其中1/n表示吸附作用的强度,KF与吸附相互作用和吸附量有关.

图5 不同温度下Cu@CTS@Fe3O4对RBR的吸附等温线Fig.5 Adsorption isotherms of Cu@CTS@Fe3O4 for RBR at different temperatures
如图5所示, 在相同温度下, 随着染料初始浓度的增加, Cu@CTS@Fe3O4对RBR的吸附量均增加. 这是由于RBR分子在高浓度下更容易与吸附剂表面接触, 因此在高浓度下表现出更大的吸附量. 然而, 随着染料初始浓度的增加, 平衡吸附量趋于平缓, 说明所制备的吸附剂具有有限的吸附容量. 随着温度的升高, 吸附剂的平衡吸附量提高, 表明吸附是一个吸热的过程. 随着温度的升高, RBR分子的运动加速, 其与吸附剂接触的几率也相应增大, 从而表现为吸附量的提高. 表2给出了Langmuir和Freundlich等温吸附模型的拟合参数.
由表2可知, Langmuir和Freundlich模型拟合的相关系数均高于0.90, 说明这两种等温吸附模型均可以用来描述Cu@CTS@Fe3O4对RBR的吸附. 相比于Langmuir模型, Freundlich模型拟合得到的相关系数值更高, 表明Freundlich模型更有利于描述吸附过程.KF值随温度的升高而增大, 进一步证明了整个吸附过程是吸热的. 此外, 1/n值在三种不同的温度条件下均小于1, 表明吸附过程是相对容易进行的.
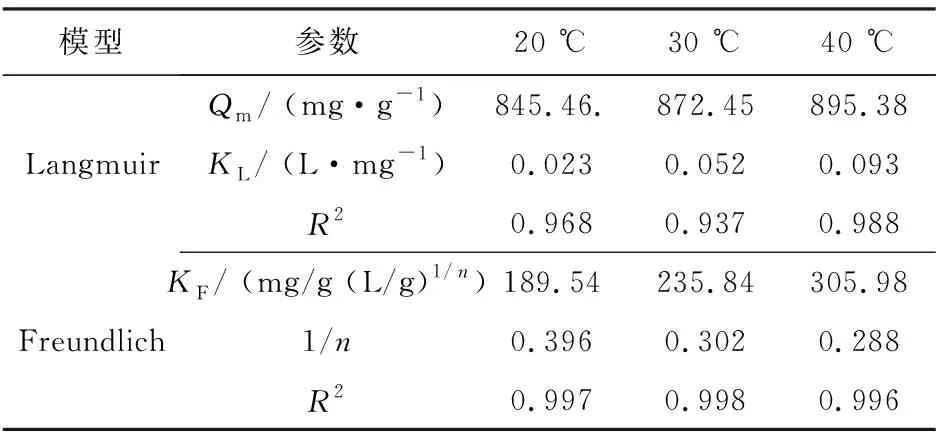
表2 Cu@CTS@Fe3O4的Langmuir和Freundlich等温吸附模型拟合参数
3.6 pH值和离子强度对于吸附的影响
图6为不同pH值和离子强度下Cu@CTS@Fe3O4对RBR的平衡吸附量变化. 由图6可知, 随着pH值的减小, 平衡吸附量逐渐增大, 当pH=2时, Cu@CTS@Fe3O4吸附量达到最大值831.22 mg/g. 在酸性条件下, 铜离子与RBR阴离子之间的电子吸引力在吸附中占据主导作用. 随着体系中pH值的增大, 溶液中OH-浓度也相应增大, 这些OH-会与RBR阴离子竞争吸附剂中的吸附位点, 从而导致吸附量的降低. 此外, Cu@CTS@Fe3O4中包含着一些未与铜离子配位的氨基基团, 这些氨基在酸性条件发生质子化作用生成NH4+, 因此进一步提高了Cu@CTS@Fe3O4在酸性条件对于RBR的吸附量. 另外可以看出, 随着溶液中NaCl浓度的增加, Cu@CTS@Fe3O4对RBR的吸附量逐渐降低, 这是由于Cl-与RBR阴离子对吸附位点的竞争吸附导致的.
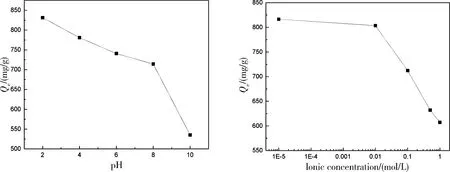
图6 不同pH值和离子强度对Cu@CTS@Fe3O4吸附RBR的影响
4 结 论
新型壳聚糖复合材料Cu@CTS@Fe3O4通过壳聚糖与铜离子的配位螯合以及磁性粒子的引入成功制备, 并用于吸附染料废水中的RBR. 本文通过FTIR、SEM和TGA表征了该材料的结构、形貌及热稳定性. 吸附实验表明, Cu@CTS@Fe3O4在pH=2时达到最大吸附量831.22 mg/g, 与未配位铜离子的CTS@Fe3O4相比, 吸附量显著提高, 说明吸附主要通过铜离子与RBR阴离子的电子作用实现的. 吸附动力学结果表明, 吸附过程更符合准二级动力学模型, 而吸附等温线的拟合结果更倾向于Freundlich模型, 整个吸附过程是一个吸热反应.
