TiO2/改性膨润土对RhB的吸附-光催化降解协同去除
2021-07-14陈志力张彦朋
陈志力,张彦朋
(1.嘉兴市水利水电工程质量管理服务中心,浙江 嘉兴 314001; 2.中交上海航道勘察设计研究院有限公司,上海 200120)
随着印染产业的发展,进入水环境中的染料数量、种类不断增加,造成水污染问题日趋严重。染料种类繁多,排放量大,难以生物降解[1]。其中,罗丹明B(RhB)广泛应用于造纸、纺织、制漆等行业,具有潜在的致癌、致畸性[2-3],物化法和生化法难以将其有效去除[4],因此必须研发新型工艺使其在排入水体前进行有效处理。
光催化技术因独特的优点在废水处理领域备受关注,可利用清洁能源太阳能,具有广阔的应用前景[5-6]。常见的半导体催化剂中,TiO2具有稳定性高,亲水性强、成本低等优点[7-11],广泛应用于水处理领域,但TiO2表面惰性、吸附性能差、光量子效率较低、光谱响应范围窄、固化困难、不易回收等缺点[12-15]限制了其进一步发展。针对以上问题,常采用半导体复合、金属离子掺杂、贵金属沉积等策略对TiO2进行改性[16-18]。然而通过此类方式改性的TiO2复合材料比表面积仍不能有效提高。研究表明,在光催化过程中,目标污染物需首先富集在催化剂表面,然后通过产生的自由基进行光催化降解反应,单纯TiO2比表面积小,吸附富集性能差,因此制备具有较大比表面积的TiO2复合光催化剂对提高材料的光催化活性尤为重要。
膨润土(Bt)是一类天然硅酸盐物质,比表面积大、吸附性能良好、具有较好的离子交换性能,对RhB的吸附效果明显优于TiO2。近年来,用Bt负载TiO2受到研究者的青睐[19-21],TiO2与Bt复合一方面可以实现TiO2的固载,另一方面利用Bt良好的吸附性能增加催化剂与有机污染物的有效接触以提高光催化降解活性。但天然Bt表面的亲水性不利于其在有机相中分散以及对有机物吸附,因而当Bt用于有机体系时往往需要对其进行有机改性,使其表面疏水化。常用的有机改性剂主要有烷基铵盐、氨基酸和偶联剂等。有机合成的方法通常分为湿法、干法和预凝胶法[22]。改性后的有机Bt具有较大的层间距和表剖面疏水性,大大提高了对有机污染物的吸附[23-24]。与此同时,目前对吸附与光催化间的耦合及协调机制认识不足[25]。
本文在湿法制备有机改性Bt(C-Bt)的基础上,采用溶胶-凝胶法制备纳米TiO2/Bt复合催化剂。通过XRD、TEM、DRS、FT-IR、TG-DTA、BET、XPS等手段对催化剂组成、结构进行表征分析。并以RhB为目标污染物,探究催化剂的吸附和光催化降解性能,分析吸附、光催化动力学和机理,为制备高性能的催化材料提供理论依据和参考。
1 实验部分
1.1 实验材料
无水乙醇、硝酸、罗丹明B、硝酸银、十六烷基三甲基溴化铵、甲醛等均为分析纯,上海久亿化学试剂有限公司;氢氧化钠、氧化镁、氯化铵和焦磷酸钠均为分析纯,南京化学试剂有限公司;钛酸正丁酯,化学纯,天津市科密欧化学试剂开发中心。
Bt为南京天景山矿产品有限公司提供的钠基膨润土,呈浅红色,主要成分及理化性质如表1和表2所示。

表1 膨润土的主要成分Table 1 Composition of bentonite

表2 膨润土的理化性能Table 2 The physicochemical properties of bentonite
1.2 复合催化剂的制备
200 mL三角烧瓶中称取5.0 g Bt,加入100 mL蒸馏水,搅拌均匀,配成5%的矿浆悬浮液,将pH调节至6~8。根据Bt阳离子交换量,加入1.5 g的CTMAB (即CTMAB∶Bt=0.3∶1)。60 ℃恒温水浴电磁搅拌3 h,待完全溶解后静置离心,用蒸馏水多次洗涤,直至用0.1mol·g-1AgNO3检验滤液中无Br-。所得固体于100 ℃烘箱内干燥,研磨过200目筛,即制得CTMAB改性Bt,标记为C-Bt。
采用溶胶-凝胶法制备TiO2。向100 mL烧杯中加入24 mL无水乙醇,电磁搅拌下加入10 mL钛酸正丁酯形成均匀透明的淡黄色溶液A;将12 mL无水乙醇与6 mL浓度为1mol·L-1的HNO3混合,形成溶液B。电磁搅拌下将溶液B缓慢逐滴加至溶液A中,得到白色溶胶,在空气中静置陈化24 h得到TiO2凝胶。将凝胶放入恒温干燥箱,65 ℃真空干燥48 h去除水和有机溶剂。所得干凝胶置于玛瑙研钵中研磨,用蒸馏水洗至中性,100 ℃恒温箱内干燥,得到白色粉末。将白色粉末放在管式电炉内,在一定温度下煅烧2 h,自然冷却至室温即制得纳米TiO2光催化剂[26]。
以钛酸正丁酯为前驱物,无水乙醇为溶剂,形成淡黄色溶液A,取质量比为1∶1的Bt加入其中,充分搅拌混合均匀形成悬浮液C,将B溶液缓慢滴加到C中,持续搅拌至形成溶胶TiO2/Bt,在空气中陈化24 h,得到TiO2/Bt凝胶。将凝胶置于65 ℃恒温干燥箱内烘干,干凝胶置于玛瑙研钵中研磨,得到白色粉末。将白色粉末放在管式电炉内,在一定温度下进行煅烧2 h,即制得TiO2/Bt光催化剂。制备TiO2/C-Bt样品的实验操作与上述步骤相同,只需将质量比1∶1的Bt改为C-Bt,即可得到相应样品。
1.3 催化剂表征
采用D8 Advance(Bruker,德国)X射线衍射仪分析催化剂晶相,Cu Kα,λ= 0.154 18 nm,石墨单色器,工作电压40 kV,工作电流30 mA,扫描速率2°·min-1。采用Nexus 870(Nicolet,美国)傅里叶红外光谱仪检测材料表面官能团,KBr压片,扫面波段(4 000~400) cm-1,分辨率0.85 cm-1。采用S-4800(Hitachi,日本)场发射扫描电子显微镜观察样品的微观形貌,扫描电压3.0 kV。采用ASPA-2000(Micromeritics,美国)孔径/比表面积仪在-196 ℃下进行氮气吸附-脱附,BET法计算催化剂比表面积。采用PHI 5000(Ulvas-Phi,日本)X射线电子能谱仪进行XPS分析,单色化Al Kα(1 486.6eV)激发源,操作功率25W,样品室真空度≤5×10-7Pa,精确度±0.1 eV,谱图的荷电效以C 1s结合能(285.0 eV)进行校正。采用UV-3600(Shimadzu,日本)荧光分光光度计测定样品的光致发光光谱(PL),激发波长为325 nm,扫描范围(400~600) nm。
1.4 吸附性能研究
配制不同浓度的RhB溶液,取50 mL于200 mL锥形瓶中,称取0.1 g吸附剂(Bt、C-Bt、TiO2/Bt和TiO2/C-Bt),室温下恒温振荡(120 r·min-1),间隔一定时间取样,离心,取上清液稀释,用分光光度法于554 nm处测定剩余RhB的浓度。按下式计算吸附容量和去除率:
(1)
(2)
式中,Q为吸附容量,mg·g-1;V为RhB溶液的体积,L;c0为吸附前溶液中RhB的浓度,mg·L-1;η为去除率,%;c为吸附后溶液中RhB浓度,mg·L-1;W为吸附剂干重,g。
为研究吸附剂对RhB的吸附过程,对其动力学参数进行分析,确定吸附速率控制步骤和吸附机制。采用Langmuir吸附等温模型(式3)和Freundlich吸附等温模型(式4)对吸附过程进行模拟[27]。
(3)
(4)
式中,qe为RhB的平衡吸附量,mg·g-1;Qm为复合材料对RhB单层吸附的最大吸附量,mg·g-1;ce为RhB的平衡浓度,mg·g-1;KL为Langmuir模型的吸附常数,L·mg-1;n为与吸附强度有关的经验常数;KF为Freundlich模型的吸附常数,mg(1-n)·Ln·g-1。
采用准一级动力学模型[28](式5)和准二级动力学模型[29](式6)对吸附过程进行模拟。
ln(qt-qe)=lnqe-KF
(5)
式中,qt为时间t时的吸附量,mg·g-1;KF为准一级吸附速率常数,min-1。
(6)
式中,K2为准二级吸附速率常数,min-1。
采用内扩散模型[30](式7)和Boyd模型[31](式8)对吸附过程进行模拟。
qt=Kidt1/2+C
(7)
式中,qt为t时刻的吸附量,mg·g-1;Kid为第i阶段(i=Ⅰ、Ⅱ、Ⅲ)的速率常数,mg·(g·min1/2)-1,从qt对t1/2的直线斜率获得;C为截距。
(8)
式中,Bt是F(t)的函数,F(t)为t时刻污染物在吸附剂上吸附量与平衡时吸附量的比值:F(t)=qt/qe。通过傅里叶变换和随后的积分,当F(t)>0.85时,得到式(8)的近似值
Bt=-0.4977-ln[1-F(t)]
(9)
当F(t)<0.85时
(10)
1.5 光催化性能研究
将700 mL、20 mg·L-1的RhB溶液加入光催化反应器中,取0.35 g的TiO2/Bt和TiO2/C-Bt均匀分散于溶液中。暗处磁力搅拌30 min,吸附平衡后在300 W的高压汞灯模拟的光源下进行降解,同时开始计时,每5 min取样一次。离心5 min后提取上清液,用可见分光光度计(V-5100型)于λ=554 nm处测定溶液吸光度,根据标准曲线得RhB浓度并计算降解率。
采用表观一级动力学线型方程对光催化过程进行拟合,动力学方程为:
(11)
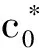
2 结果与讨论
2.1 材料表征结果
图1为合成材料的XRD图。根据Bragg方程(nλ=2dsinθ)计算膨润土的层间距d001。从图1可以看出,Bt与C-Bt的特征衍射峰分别出现在7.24°和3.27°,因此Bt和C-Bt的层间距分别为1.221 nm和2.702 nm。可见Bt经有机改性后,层间距明显大于改性前,说明季铵盐阳离子CTMA+与Bt层间的Na+进行离子交换进入了膨润土层间,并以倾斜的方式排列在膨润土层间[32-33],将片层撑开,增加了其层间距离,从而增强了吸附性能。由复合材料的XRD图可以看出,衍射角25.3°,37.9°,47.8°和54.3°处出现的(101)、(004)、(200)、(211)衍射峰归属于锐钛矿相TiO2,在25.3°和30.8°处有微弱的TiO2板钛矿相的特征峰[34],可以推测制备的TiO2为锐钛和板钛混晶,主要以锐钛矿相形式存在。负载TiO2后,复合材料的d001特征峰偏移至9.05°,层间距从1.221 nm减小至0.931 nm,说明TiO2成功嵌入膨润土层间。同时Bt在7.24°处的001面衍射峰强度明显降低,说明TiO2与Bt在晶区有一定的相互作用[35]。
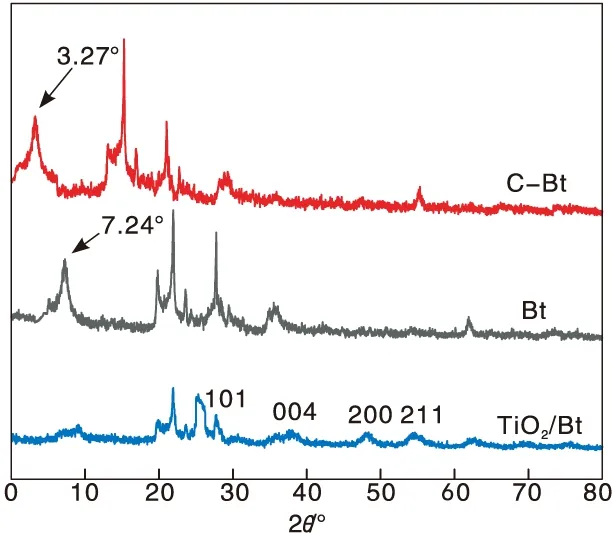
图1 不同材料的XRD图Figure 1 XRD patterns of different materials
Bt改性前后及TiO2/C-Bt催化剂的红外谱图如图2所示。从图2可以看出,改性后Bt的红外光谱峰型与改性前基本一致,均出现了Bt表面官能团的吸收峰,CTMAB改性并没有改变Bt的层状硅酸盐骨架[36]。与Bt相比较,C-Bt在2 918 cm-1和2 850 cm-1处出现了两个尖锐的强吸收峰,属于有机改性剂CTMAB中的--CH2反对称伸缩振动和对称伸缩振动。在3 020 cm-1处出现了C--N的反对称伸缩振动吸收峰,2 950 cm-1出现了较微弱的C--N对称伸缩振动峰,在1 481 cm-1处出现C--N的弯曲振动吸收峰,这个峰很弱并不能明显观察到,可能是由于含量太低,又受到附近1 469 cm-1处--CH2较强峰的影响[37]。这些峰的出现,说明CTMA+进入了蒙脱石的硅酸盐片层间,与膨润土发生了有效结合。

图2 不同材料的红外光谱图Figure 2 FT-IR spectra of materials
经高温焙烧后,复合催化剂的层间结合水消失,3 500 cm-1附近的吸收峰消失。除了膨润土的结构特征峰外,复合催化剂在(900~400) cm-1之间的峰被认为是Ti--O的拉伸和弯曲振动引起的,在940 cm-1附近有小峰出现,可能是Ti--O--Si键的形成引起的。
不同材料的形貌如图3所示。从图3可以看到,Bt表面颗粒大小、分布不均匀,出现部分结块。而改性后C-Bt颗粒明显增大,且颗粒分布均匀,没有结块现象。CTMAB改性使Bt表面由亲水性变为疏水性,除了离子交换反应外,CTMA+借助吸附在Bt的阳离子表面活性剂的疏水基生成疏水键可以分布在Bt的外表面,使得Bt的疏水性增强,吸附能力得到提升。由于高温煅烧,TiO2/Bt催化剂表面部分板结成块,影响了其对RhB的吸附性能,并且光生电子的数量也因表面被包裹而减少,对材料的光催化性能产生不利影响。而TiO2/C-Bt颗粒细散,尺寸均匀,说明TiO2在C-Bt中分散更均匀,有利于对污染物的吸附。
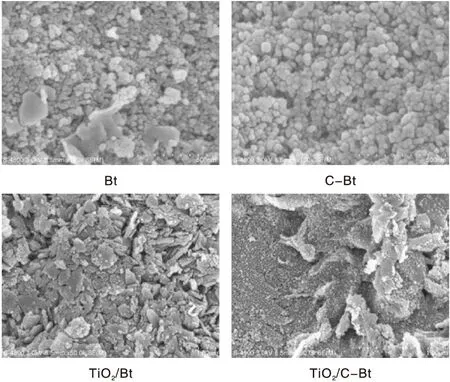
图3 不同材料的SEM照片 Figure 3 SEM images of different materials
BET测试结果表明,C-Bt平均孔径从8.08 nm增加到13.02 nm,然而有机阳离子在撑大层间域的同时覆盖了部分有效表面积,也阻塞了部分孔结构,导致比表面积从28.2 m2·g-1降至17.4 m2·g-1,总孔容也减少了57.6%。研究表明,改性膨润土BET比表面积测定值减小是由于膨润土表面有机化后对N2等无机气体的吸附性能变低,而其对有机物的吸附性能有显著改善。
制备的TiO2比表面积为5.2 m2·g-1,负载Bt后,复合催化剂的比表面积大幅增加(TiO2/Bt、TiO2/C-Bt比表面积分别为66 m2·g-1、79 m2·g-1),因此促进催化剂吸附性能的提高,进而提升材料的光催化活性。
图4为不同材料的XPS能谱图,复合催化剂表面检测到了Si、O、C及Ti信号,结果如表3所示。从图4可以看出,膨润土改性前后C 1s信号发生了很大的变化,实验条件下不能明显观察到改性膨润土的季铵离子中N元素的相关信号,这与红外分析结论一致,说明改性后季铵盐中已经插入到膨润土当中,所以表面检测不出氮。XPS分析结果表明,经有机改性后,复合催化剂表面的C原子分子数从10.15%升高到16.78%,而O元素和Ti元素的原子分数分别减少了3.15%和0.95%,这说明TiO2通过负载插入到膨润土的层间距当中。
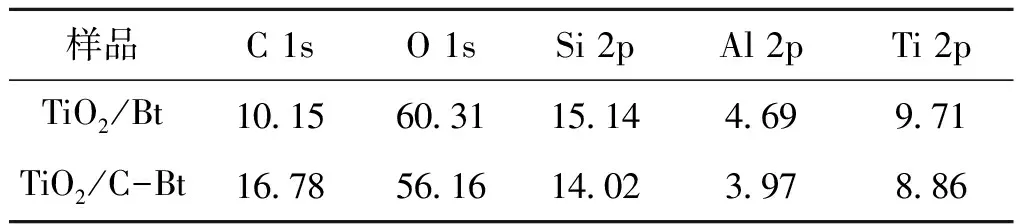
表3 复合催化剂表面的化学组成Table 3 Chemical composition of composite catalyst
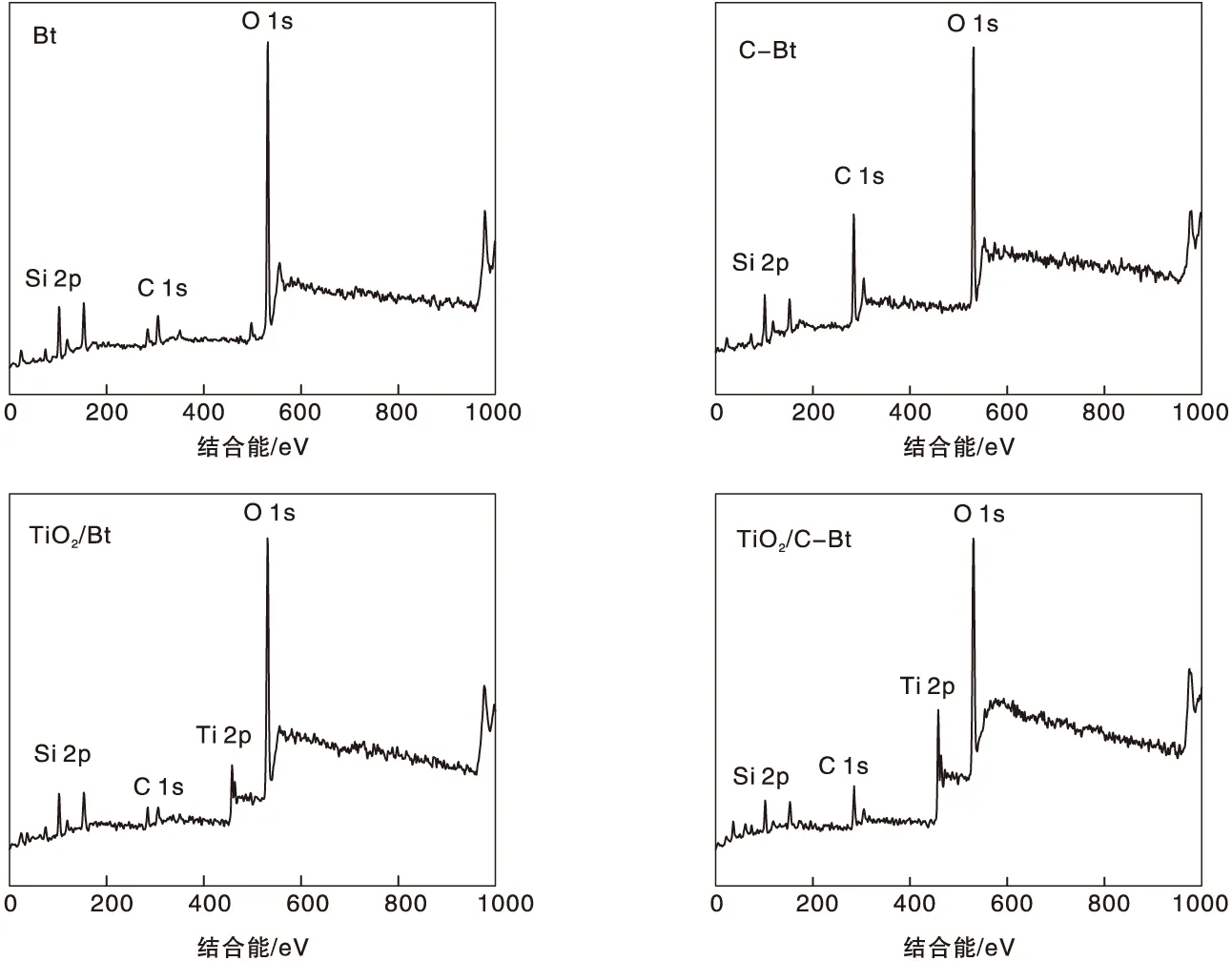
图4 不同材料的XPS能谱图Figure 4 XPS spectra of different materials
不同复合材料的XPS Ti 2p和O 1s高分辨谱图如图5所示。
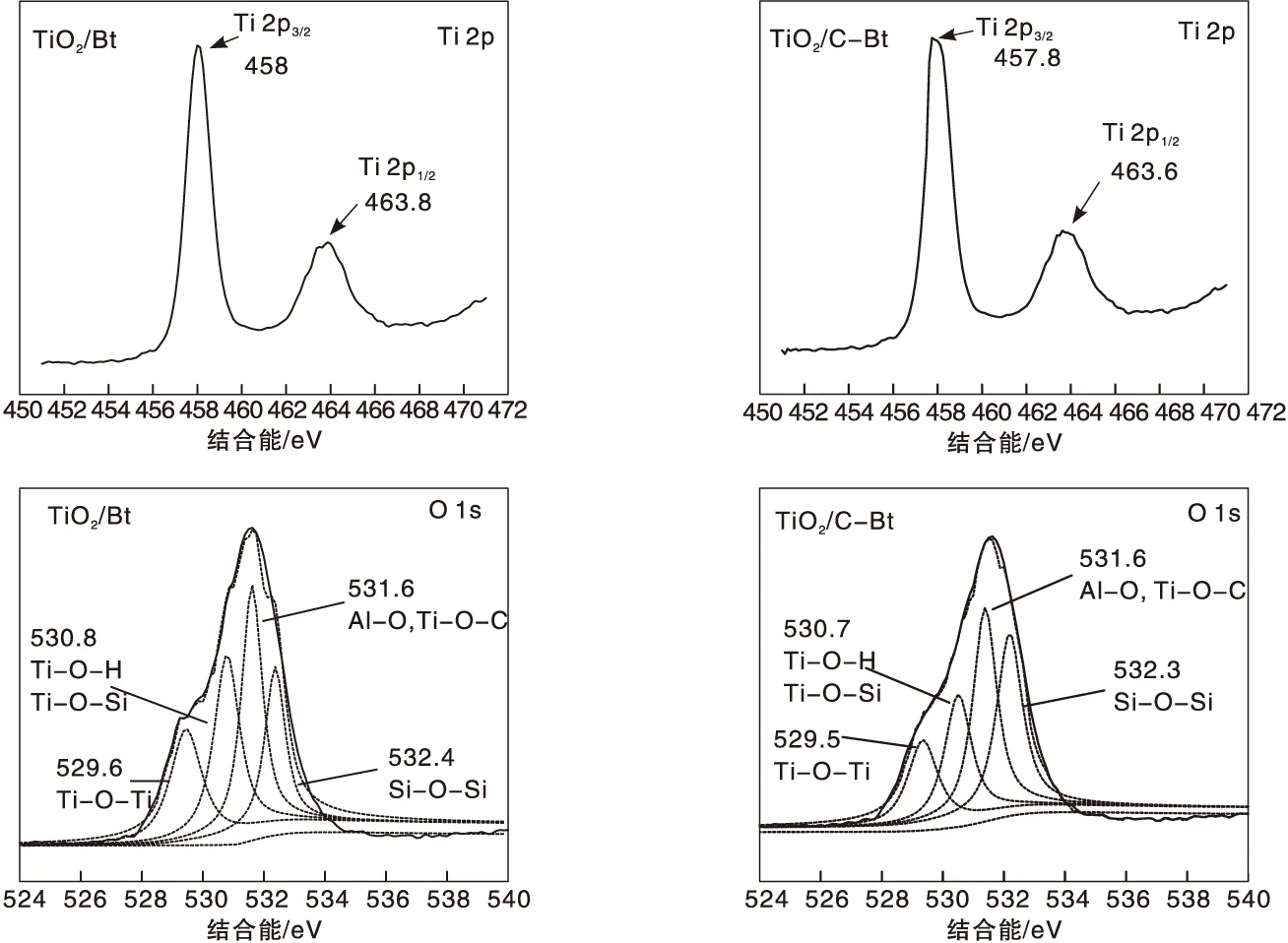
图5 复合催化剂的Ti 2p和O 1s能谱图Figure 5 XPS spectra of Ti 2p and O 1s in composite catalyst
从Ti 2p高分辨谱图可以看到, Ti 2p3/2峰和Ti 2p1/2峰中心位置分别为457.8 eV和463.6 eV,峰中心位相差5.8 eV,相关研究资料表明,TiO2中Ti元素的峰相差5.7 eV左右[38],结果与资料一致。而C-Bt/TiO2分别为458 eV和463.8 eV,与Bt/TiO2相比向左移动了0.2 eV,说明有机改性对TiO2结构产生了影响,这与前述红外表征分析和XRD表征分析结果一致。据文献报道,低能级的Ti 2p可能会导致较高的光催化活性[39]。从O 1s高分辨谱图可以看出,在529.6 eV、530.8 eV处出现的峰归属于Ti-O-Ti、Ti-O-H和Ti-O-Si,在531.6 eV处的峰归属于Al-O和Ti-O-C,在532.4 eV处对应的是Si-O-Si。Bt/TiO2与C-Bt/TiO2相比,Ti-O-Ti、Ti-O-H和Ti-O-Si峰的位置向低结合能位移了0.1 eV。
2.2 吸附实验结果
吸附时间对Bt改性前后吸附RhB的影响如图6所示。由图6可以看出,前30 min吸附率随着吸附时间的增加而迅速增加;30 min后吸附率增长缓慢,在120 min以后趋于稳定。这是因为在吸附初始阶段RhB浓度较高,膨润土表面的吸附活性位点较多,容易发生吸附。随着吸附时间增加,膨润土表面的活性位点逐渐减少,RhB浓度降低,吸附速率减缓,最后达到平衡,活性位点被完全覆盖,对RhB的吸附率不再变化。

图6 吸附时间对膨润土吸附RhB的影响Figure 6 Effect of time on adsorption of RhB over bentonite
吸附时间对TiO2及复合吸附剂吸附RhB的影响如图7所示。

图7 吸附时间对TiO2及复合吸附剂吸附性能的影响Figure 7 Effect of time on adsorption properties of TiO2 and composite adsorbents
由图7可以看出,两种复合吸附剂曲线相似,复合吸附剂对RhB的吸附在前15 min随吸附时间增加而迅速增加,15 min后吸附增长率逐渐变缓,90 min后吸附率趋于平衡。TiO2/C-Bt对RhB的吸附率明显优于TiO2/Bt,这与C-Bt对RhB的吸附率比Bt增加的结果一致。在同样试验条件下,单独TiO2对RhB的吸附性能很差,吸附去除率仅为6.52%,饱和吸附容量仅为1.63 mg·g-1,相对于复合吸附剂而言,TiO2对RhB的吸附很低。
RhB初始浓度对复合吸附剂吸附RhB的影响如图8所示。由图8可以看出,当复合吸附剂加入量为2 g·L-1时,随着RhB初始浓度的增加,复合吸附剂对RhB单位吸附量逐步增加,当RhB初始浓度增加到600 mg·L-1时,复合吸附剂对RhB的吸附量达到最大值,吸附量分别为24.7 mg·g-1和35.1 mg·g-1。

图8 RhB初始浓度对复合吸附剂吸附RhB的影响Figure 8 Effect of initial concentration of RhB on adsorption of RhB
结合表征结果可知,纳米TiO2与C-Bt复合后极大的提高了TiO2的吸附活性。通过改性,有机铵离子取代了Na+,使得有机基团进入层间插层,覆盖于粘土表面,使其表面性能由原来的亲水性变为疏水性,同时季铵盐阳离子对RhB存在良好的静电吸附,提高了其对RhB的吸附活性。有机改性有效改善了膨润土颗粒分布不均、堆积松散、孔隙度大的微观结构形态,增大了膨润土晶层间距和平均孔径,使得对有机污染物的去除能力大大提高。
根据吸附实验结果,分别利用Langmiur模型和Freundlich模型对复合材料吸附过程进行非线性拟合,结果如图9和表4所示。复合材料对RhB的吸附行为较为符合Freundlich模型,表明复合催化剂对RhB的吸附主要为多层非均相吸附。
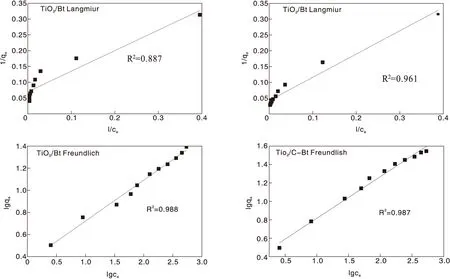
图9 Langmiur和Freundlich等温吸附拟合曲线 Figure 9 Adsorption isotherms linear-fitted by Langmuir or Freundlich models

表4 复合材料对RhB吸附的吸附等温线参数
准一级动力学模型和准二级动力学模型的拟合结果如图10和表5所示。
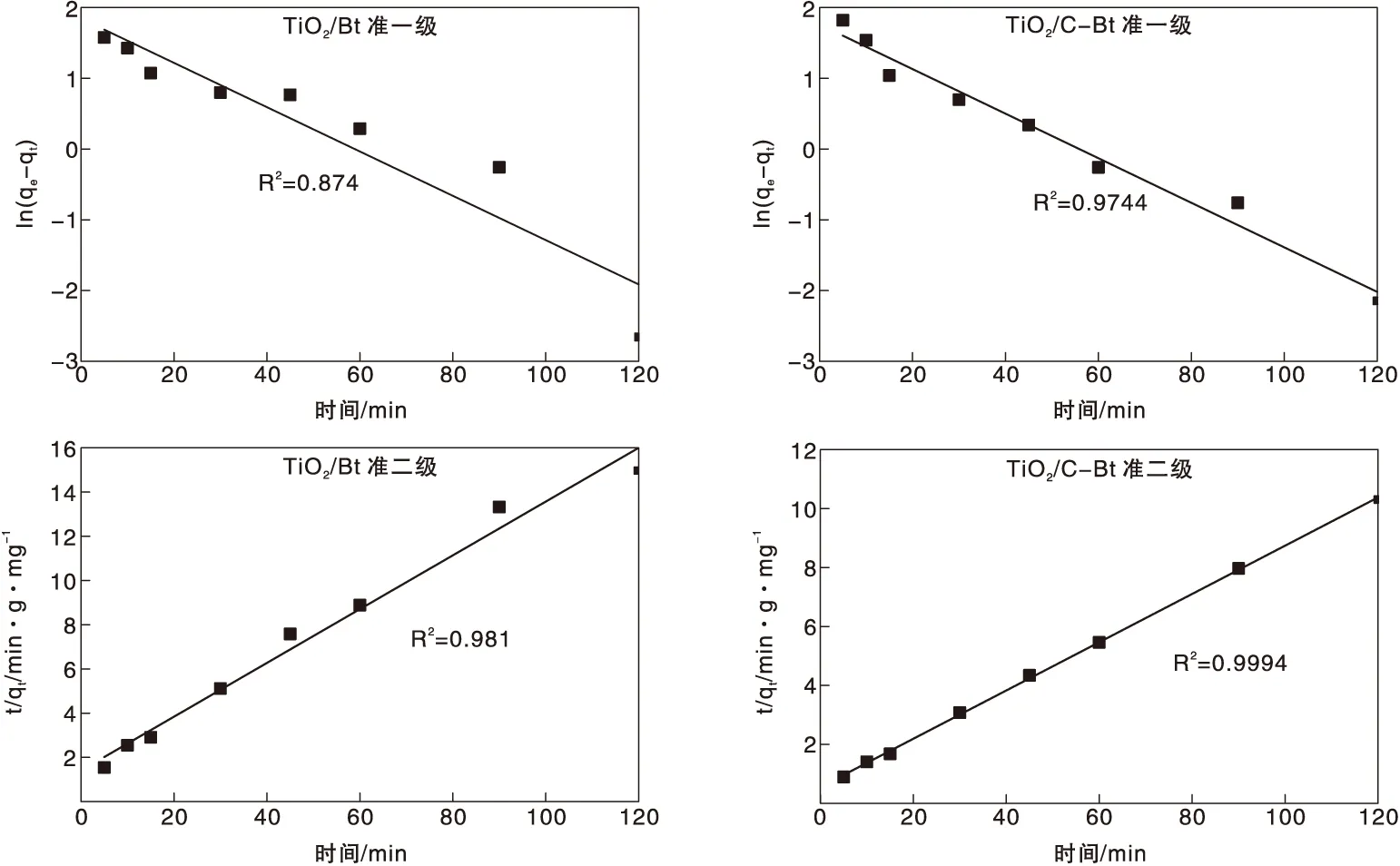
图10 复合材料吸附RhB的准一级和准二级动力学拟合结果Figure 10 Linear-fitting results by pseudo first and second order kinetics of RhB adsorption on the composites
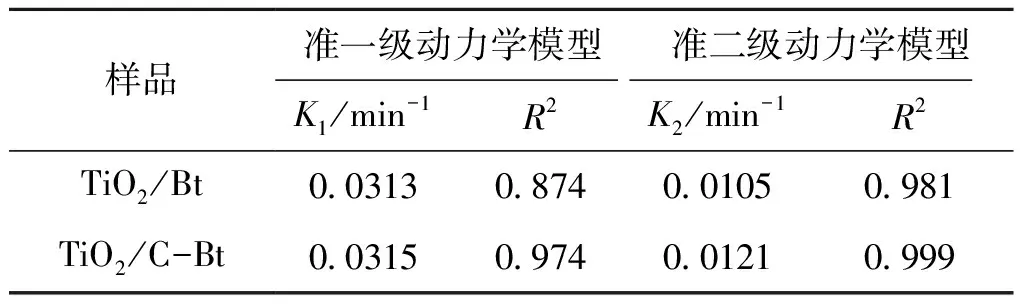
表5 复合材料吸附RhB的动力学参数Table 5 Kinetic parameters of RhB adsorption on composites
动力学研究结果表明,采用准二级动力学模型能更好的拟合吸附过程,为验证RhB从溶液转移至催化剂孔隙中的过程对反应速率的影响,利用内扩散模型对实验结果进行拟合。图11为t1/2和qt的拟合结果,根据该模型,如果qt对t1/2的图像为过原点的直线,则粒子内扩散是限速过程[40]。然而可以看到,曲线呈多线性,表明该过程中还涉及其他机制[41]。每条曲线由三部分组成,分别归因于外部质量转移、表面扩散和颗粒内RhB扩散[42]。表6给出了由该图所获得的Kid和R2值。每条曲线的K1d值最高,说明外部传质在RhB吸附中的扩散阻力最小,即外部传质起最重要的作用。因此,研究RhB从本体溶液向材料的转移是十分必要的。
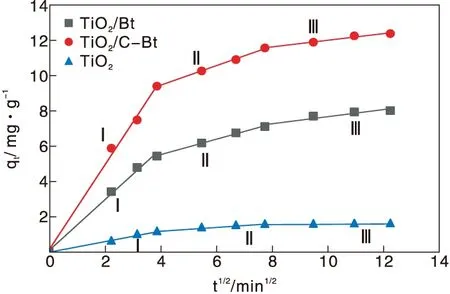
图11 不同材料对RhB吸附的内扩散模型Figure 11 Internal diffusion model of RhB adsorption on prepared materials
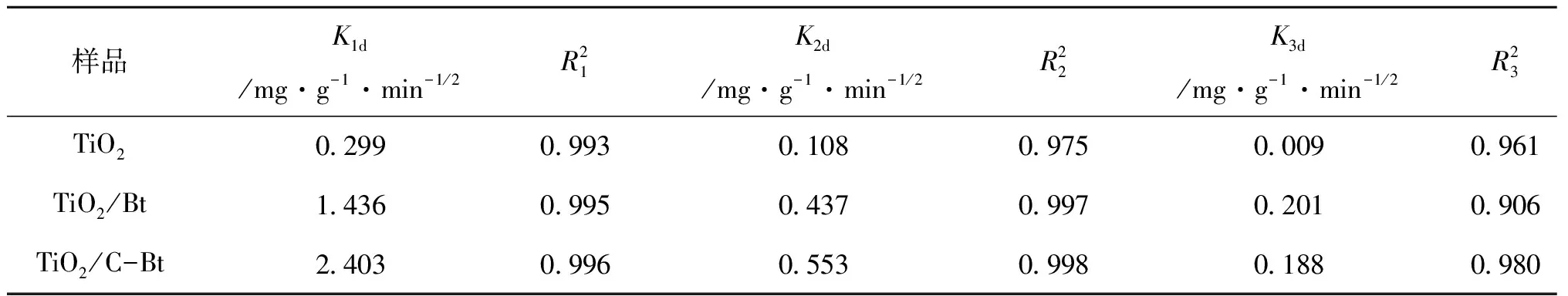
表6 RhB在复合材料上吸附的颗粒内扩散模型常数和相关系数Table 6 Intra particle diffusion model constants and correlation coefficients of RhB adsorption on composites
利用Boyd模型进一步分析了RhB在制备样品上的吸附,以确定外部传质的控制作用。图12为计算的Bt值和t之间的关系。得到的不同样品吸附反应的直线没有通过原点,表明RhB的外部传质控制了吸附过程,结果与粒子内扩散模型的结果非常一致。

图12 RhB在不同材料上吸附的Boyd图Figure 12 Boyd plots for the adsorption of RhB on the as-prepared materials
由此可见,RhB的外传质对其吸附起最重要的作用,通过Fick定律计算吸附过程表面及内部扩散系数,简化Fick定律公式如下所示[43]:
(12)
(13)
式中,a为颗粒半径,nm;D1为表面扩散系数,m·s-1;D2为内部扩散系数,m·s-1。
对内扩散模型曲线第一段数据用式12计算,第二段部分数据用式13计算并作图,结果如图13所示。同时计算了N-Bt和C-Bt吸附过程表面及内部扩散系数,相关数据列于表7。结果显示,复合后材料的表面扩散系数D1和内部扩散系数D2均得到了明显提高,表明改性膨润土的复合不仅促进了染料分子在复合材料表面的扩散,还提高了其内部扩散速率。
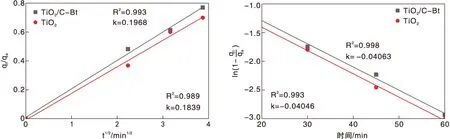
图13 TiO2和TiO2/C-Bt吸附RhB的Fick定律模型拟合Figure 13 Fick’s law model fitting for the adsorption of RhB on TiO2 and TiO2/C-Bt
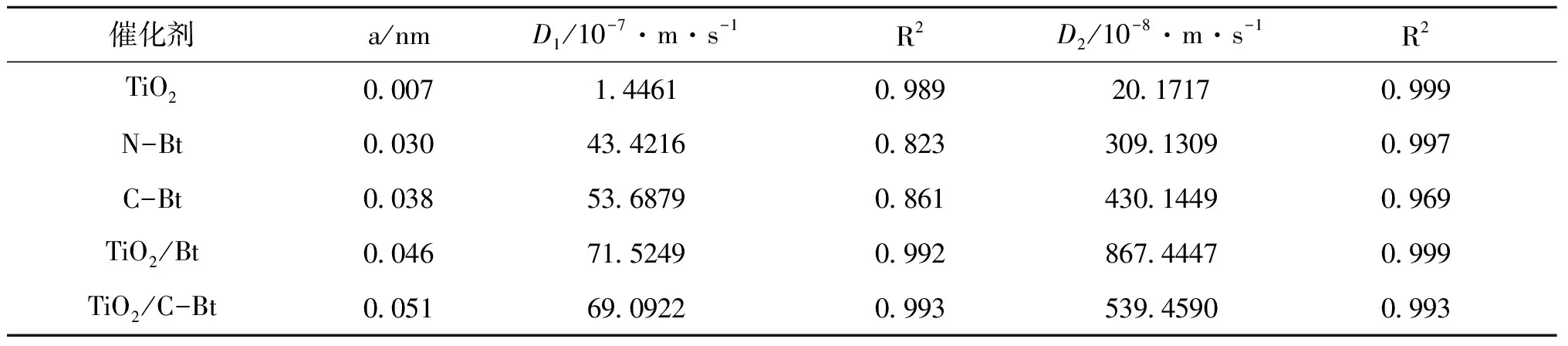
表7 复合前后吸附过程表面及内部扩散系数
2.3 光催化实验结果
可见光条件下复合催化剂对RhB的降解率如图14所示。

图14 紫外光下RhB的光催化降解曲线Figure 14 Photocatalytic degradation curve of Rhodamine B under ultraviolet light
由图14可见,复合催化剂降解RhB的效率明显高于单独TiO2材料,其中TiO2/C-Bt复合材料效果最好,3 h后RhB的降解率为91.82%,相比于纯TiO2材料,降解率显著提升了36.33个百分点。此外,光照初期RhB溶液的降解率随紫外光照时间的延长而增加,RhB去除率也越来越高,在180 min以后RhB去除率趋于平稳。这可能是因为在反应过程中,随着光照时间的延长,产生自由电子的数量越来越多,催化剂表面不断的吸附、氧化、再吸附和再氧化,使得催化剂有效表面积增加,可保持较多的催化活性位,而且可加速RhB在催化剂表面的物质运输,强化反应速度,因此具有较高的氧化效率。
采用表观一级动力学线型方程对图14数据进行拟合,结果见图15。由图15可知,不同材料的紫外光催化过程均符合一级反应动力学特征,对数据进行拟合后,可得出其直线斜率k,即独立于吸附阶段的光催化过程一级动力学常数。TiO2的一级动力学常数k为0.00498,而TiO2/C-Bt复合催化剂的一级动力学常数k达到0.0138,接近复合前的3倍。
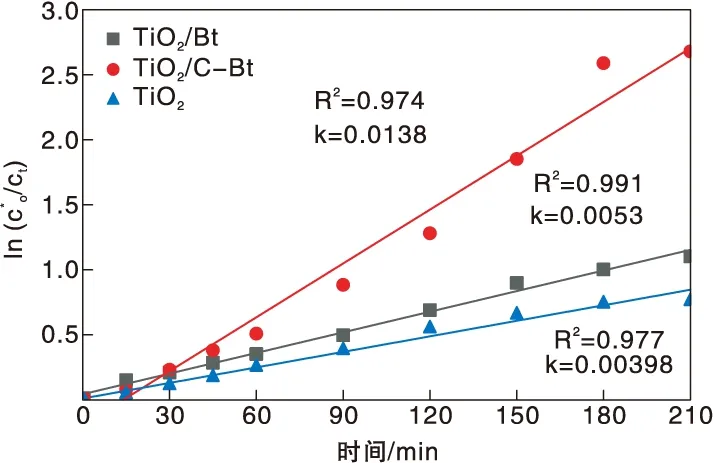
图15 紫外光下催化剂光催化降解RhB的表观一级动力学拟合结果Figure 15 Apparent first order liner fitting of the degradation of RhB on catalyst under ultraviolet light
3 结 论
(1)采用湿法制备了改性膨润土(C-Bt),并利用溶剂-凝胶法对其负载TiO2,成功制备出TiO2/C-Bt异质结复合催化剂,TiO2在C-Bt上分布均匀。
(2)复合催化剂对RhB的吸附与准二级动力学较好地拟合,复合催化剂对RhB的吸附等温线符合Freundlich模型。以50 mg·L-1的RhB为目标污染物,当pH接近5,TiO2投加量为2 g·L-1时,TiO2对RhB的吸附去除率仅为6.52%。而相同条件下,TiO2/C-Bt的吸附去除率为48.34%。
(3)复合材料对RhB光催化降解率显著提升。在相同测试条件下,TiO2/C-Bt对RhB降解率达91.82%,而TiO2仅为55.49%,复合催化剂上RhB的光催化降解表观速率常数可达复合前TiO2的3倍。
(4)复合催化剂对RhB高效去除是吸附-光催化协同作用的结果。TiO2与C-Bt的复合改善了TiO2吸附性能,使得复合材料的内扩散速率和外扩散速率均显著提升,进而提高了材料的光催化活性。
