血管生成素样蛋白3抑制剂研究进展
2021-07-14于洋杰谢坤施海明
于洋杰 谢坤 施海明
(复旦大学附属华山医院心内科,上海 200040)
血脂异常是动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)的重要危险因素之一。在众多血脂指标当中,降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是目前治疗动脉粥样硬化最有效的手段。主要针对LDL-C的调脂药物包括他汀类药物、依折麦布和前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂,其均已写入最新的指南并应用于临床治疗中[1]。这些药物均能在大部分人群中有效地降低LDL-C,并改善ASCVD患者的预后。用于控制LDL-C的新型药物的研发也从未停止。2019年的CLEAR Harmony研究(n=2 230)中应用的贝培多酸是一种可降低LDL-C的三磷酸腺苷柠檬酸裂解酶抑制剂[2]。2020年的ORION-10(n=1 561)和ORION-11(n=1 617)研究中应用的Inclisiran则是一种小干扰RNA,它可抑制PCSK9合成从而发挥降低LDL-C的作用[3]。然而,对于家族性高胆固醇血症患者,这些药物的治疗效果并不理想。而近期研究表明,血管生成素样蛋白3(angiopoietin-like protein 3,ANGPTL3)的单克隆抗体可显著降低家族性高胆固醇血症患者的LDL-C。现围绕ANGPTL3对血脂和冠心病的影响进行综述。
1 家族性高胆固醇血症患者的困境
家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种常染色体显性遗传病。FH患者由于基因突变导致低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)缺陷,其临床特征主要表现为LDL-C水平升高以及早发冠状动脉疾病风险增加[4]。LDLR存在于肝细胞表面,可清除血液内的LDL-C[5]。杂合子FH(HeFH)患者的血液中LDL-C的水平通常会比普通人高1~2倍,其ASCVD风险也会增加3.5~16.0倍[6]。传统降脂药物发挥其降脂作用均在某种程度上需LDLR的参与[7]。由于HeFH患者仍存在一条编码LDLR的染色体,传统的降脂药物对他们仍有一定的效果。然而对于纯合子FH(HoFH)患者,其肝细胞表面的LDLR完全缺陷,传统调脂药物对于这类患者的效果非常不理想。因此,研发通过非LDLR途径降低LDL-C的药物对于HoFH患者至关重要。
2 ANGPTL3概述
1999年Conklin等[8]最早从人的胎儿肝/脾cDNA库分离出了ANGPTL3 cDNA。他们发现ANGPTL3蛋白由460个氨基酸组成,且与血管生成素有类似的结构。Conklin等[8]同时在小鼠体内也找到了由455个氨基酸组成的ANGPTL3蛋白,该蛋白与人的ANGPTL3有76%的氨基酸序列相同。人类ANGPTL3基因定位于1号染色体短臂(1p30.3),包含7个外显子。ANGPTL3主要在肝脏表达,人体组织的Northern印记杂交显示肝脏中有4种ANGPTL3的转录产物,大小分别为4.5 Kb、3.0 Kb、2.8 Kb和1.7 Kb,其中1.7 Kb的ANGPTL3 mRNA在人肾脏足细胞中也有微量表达。该研究还发现,人类ANGPTL3和小鼠ANGPTL3通过可逆地抑制脂蛋白脂肪酶(lipoprotein lipase,LPL)的催化活性,升高血浆甘油三酯(triglyceride,TG)水平,该结构域的过表达也可提高小鼠的血浆TG水平。
2002年Yoshida等[9]在具有肥胖、高血糖和高血脂的KK小鼠中发现了低血脂表现的KK/San小鼠,并最早提出了ANGPTL3与血脂的相关性。这一亚群小鼠的血浆TG、总胆固醇(total cholesterol,TC)和游离脂肪酸水平均低于KK小鼠。该研究通过基因测序发现KK/San小鼠几乎不表达ANGPTL3。而诱导KK/San小鼠ANGPTL3基因过表达,或静脉注射纯化的ANGPTL3蛋白则会提高小鼠血浆TG、TC和游离脂肪酸的水平,从而证实了ANGPTL3基因是KK/San小鼠低血脂表现的原因。
人群中也存在ANGPTL3基因(OMIM:604774)的天然突变个体,ANGPTL3基因突变会导致家族性低β脂蛋白血症2型。这是一种以极低的血浆TG、LDL-C和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平为特征的常染色体隐性遗传病。Musunuru等[10]对低β脂蛋白血症家族的两个成员进行了基因组测序,发现这两个患者ANGPTL3基因的第一个外显子上携带无义突变S17X和E129X,且两人血液中几乎检测不到ANGPTL3,进而提出了ANGPTL3基因的功能缺失型突变为家族性低β脂蛋白血症2型的病因。随后,有研究者观察并随访了数名家族性低β脂蛋白血症2型患者,发现他们均长期处于健康状态,且未患脂肪肝、严重颈动脉硬化或狭窄和肝功能异常等疾病,提示家族性低β脂蛋白血症2型本身对人体健康无明显不良影响[11]。
后续研究发现,ANGPTL3可通过抑制脂LPL和内皮脂肪酶(endothelial lipase,EL)的活性从而调节TG和HDL-C的水平,而对于LDL-C的调节机制目前尚不明晰[12]。LPL位于肝外组织的毛细血管内皮细胞表面,能使极低密度脂蛋白和乳糜微粒中携带的TG逐步水解并产生甘油和非酯化脂肪酸(non-esterified fatty acid,NEFA)(图1)[12-13]。ANGPTL3能使具有催化活性的LPL二聚体解离成无活性的LPL单体,从而导致血浆TG水平升高。EL位于血管内皮细胞的表面,可通过水解HDL磷脂降低HDL水平,阻碍胆固醇逆向转运[14]。ANGPTL3通过抑制EL的活性来升高血浆HDL-C水平。因此ANGPTL3缺失可导致TG和HDL-C水平的降低。ANGPTL3缺失也可导致LDL-C水平降低,但其机制目前尚未研究透彻,目前可明确的是ANGPTL3缺失导致的LDL-C降低与LDLR无关[15]。最新的研究发现,同时敲除小鼠的LDLR和EL后,ANGPTL3抑制剂并不能降低LDL-C,因此ANGPTL3抑制剂很可能是通过EL依赖的途径降低LDL-C[16]。
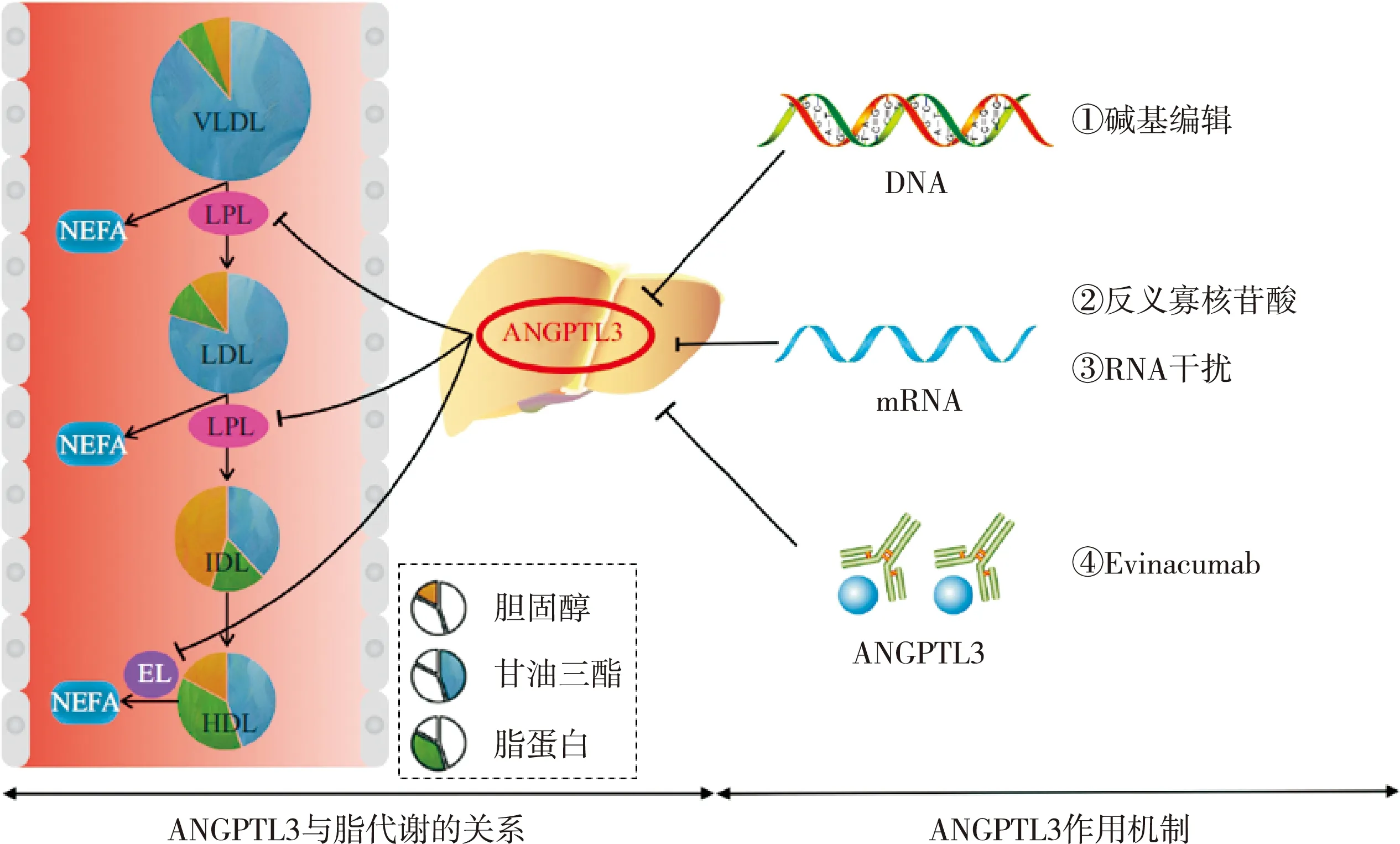
图1 ANGPTL3对脂质代谢的影响及降脂治疗方法
3 ANGPTL3抑制剂的临床研究进展
众所周知,TG和LDL-C的升高均可增加ASCVD的发病风险。由于ANGPTL3的缺失可导致TG和LDL-C水平的降低,ANGPTL3抑制剂应运而生。目前一共有4种方法针对性地抑制ANGPTL3基因或ANGPTL3蛋白:基因编辑技术、单克隆抗体、反义寡核苷酸和RNA干扰[17]。真正进入临床研究阶段的方法目前仅有两种——单克隆抗体和反义寡核苷酸。
3.1 基因编辑技术
从基因层面诱导ANGPTL3基因的功能失活的方法被称为基因编辑技术。2018年Chadwick等[18]利用碱基编辑器3使C57BL/6J小鼠产生ANGPTL3无义突变。他们发现,与对照组相比,基因编辑组ANGPTL3、TG和TC分别下降了49%、31%和19%,从而证实了在小鼠体内基因编辑技术是靶向抑制ANGPTL3的有效策略,但该技术能否应用于人体目前尚无研究。因此基因编辑技术进入临床研究阶段还有很长的路要走。
3.2 单克隆抗体
Evinacumab是ANGPTL3的单克隆抗体。2015年Gusarova等[19]的研究表明,在血脂正常或异常小鼠中,Evinacumab能增加LPL活性,并降低血浆TG、LDL-C和HDL-C水平。2017年,Dewey等[20]在高胆固醇血症小鼠中发现Evinacumab在显著降低血浆TG和TC的同时,还能减小动脉粥样硬化病变面积和坏死物质含量。同年,Evinacumab在对HoFH患者的一期临床试验中显示出了卓著的疗效。经过Evinacumab治疗4周后,入选的9例HoFH患者LDL-C和TG水平降低了近50%,HDL-C水平降低了40%[21]。2020年Evinacumab的三期临床研究得到了令人振奋的结果。该研究最终纳入了65例HoFH患者,他们均接受了标准的传统降脂药物治疗,然而其LDL-C基线水平的均值仍为6.6 mmol/L。在此基础上,经过24周的治疗后,Evinacumab组患者(n=43)相较于安慰剂组患者(n=22)LDL-C水平降低49%,TG降低50%,HDL-C降低30%[22]。并且在整个研究过程中,Evinacumab组的患者未发现明显的不良反应。
3.3 反义寡核苷酸
ANGPTL3反义寡核苷酸可介导ANGPTL3 mRNA在细胞内的灭活。2017年Graham等[23]的研究表明,在各种高胆固醇血症小鼠模型中,ANGPTL3反义寡核苷酸可有效降低肝源性ANGPTL3 mRNA的表达和血浆ANGPTL3的浓度,并剂量依赖性地减少了血浆TG、LDL-C和HDL-C水平,延缓小鼠动脉粥样硬化的进程。2017年,ANGPTL3的反义寡核苷酸的一期临床研究也得到了令人兴奋的结果。经过不同剂量的IONIS-ANGPTL3-LRx治疗6周后,患者的LDL-C降低幅度为1.3%~32.9%,TG降低幅度为33.2%~63.1%[23]。而在2020年ANGPTL3反义寡核苷酸的二期临床研究中,Vupanorsen显示出了良好的降脂作用。该研究选择的人群并非HoFH的患者,而是有高TG血症、2型糖尿病合并脂肪肝的患者。与安慰剂组相比,每四周给予患者80 mg的Vupanorsen可使患者的TG降低44%,LDL-C降低7%,HDL-C降低24%[24]。整个研究过程中,Vupanorsen组的患者同样未发现明显的不良反应。
3.4 RNA干扰
RNA干扰技术可对目标mRNA进行高效和特异的抑制,引导基因的转录后沉默。Xu等[25]在多种小鼠模型及人肝癌细胞中利用RNA干扰介导ANGPTL3基因沉默,发现RNA干扰能降低野生型和肥胖小鼠的血浆TG、HDL-C和LDL-C水平。目前关于ANGPTL3的RNA干扰技术相关研究较少,其作用强度和生物安全性也需更多研究进一步的补充及验证。
4 ANGPTL3抑制剂可能存在的问题
既往的重大研究,如IMPROVE-IT、FOURIER和DYSSEY OUTCOMES研究,均证实LDL-C的降低导致的ASCVD风险的降低源自LDL-C降低本身[26-28]。所以虽然Evinacumab的三期临床研究并未对患者的远期预后进行随访,但从LDL-C的降低幅度和降低的绝对值来看,可预测患者远期的ASCVD风险会大幅降低。但Evinacumab降低LDL-C的同时也会导致HDL-C的水平降低,幅度为30%。HDL-C可从动脉硬化斑块中转运走多余的胆固醇,故HDL被认为是“有益的”脂蛋白。到目前为止,大量相关研究也已证实HDL-C的水平与ASCVD患者的预后有明确的相关性[29-30]。因此难免会对HDL-C的降低有所担心。
除此之外,还需思考另外的问题——Evinacumab能否用于非FH患者?是否能用于他汀类药物、依折麦布和PCSK9抑制剂治疗效果不佳的患者?或是否比传统药物的使用优先级更高?对于TG的降低幅度,ANGPTL3的单克隆抗体和反义寡核苷酸均表现出了类似的效果。然而Vupanorsen对于LDL-C的降低幅度并没有Evinacumab那么高,其原因可能是两个研究所纳入的人群不同,基线LDL-C水平不同。这也提示ANGPTL3抑制剂在正常人群中并不能替代传统的调脂药物,或并不优于传统调脂药物。这一系列问题还有待未来研究阐明。
5 结语
ANGPTL3单克隆抗体制剂三期临床试验的成功使家族性高胆固醇血症的患者看到了希望。研究人员也期待ANGPTL3的反义寡核苷酸制剂在未来能获得良好的临床效果。当然,关于ANGPTL3还有一系列问题有待未来的研究阐明。首先,目前尚且不清楚ANGPTL3影响LDL-C水平的具体机制;其次,抑制ANGPTL3导致的致动脉粥样硬化脂蛋白减少的获益是否能弥补HDL-C降低的影响,长期应用是否真的能降低ASCVD风险;此外,长期使用ANGPTL3抑制剂的安全性尚不明确。相信随着对ANGPTL3的深入研究,上述问题将逐渐被解开。